
- •Лекция № 1 Предмет и содержание курса «охт»
- •Анализ эффективности проведения хтп
- •Лекция № 2 Химико-технологическая система, ее состав и структура
- •Основные принципы системного подхода
- •Состав хтс
- •Структура хтс
- •Лекция № 3 Основные этапы создания хтс
- •Формы представления хтс (классификация моделей)
- •Классификация технологических схем
- •Лекция № 4 Сырье в химической промышленности
- •Классификация сырья
- •Сырье для промышленности органического синтеза
- •Углеводородные газы
- •Сырье для промышленности неорганического синтеза
- •Выбор и обоснование сырьевой базы
- •Лекция № 5 Закономерности управления химико-технологическими процессами
- •Технологическая классификация химических процессов (модели реакций)
- •Закономерности управления простым необратимым гомогенным процессом
- •Лекция № 6 Закономерности управления простым необратимым гетерогенным процессом
- •Методы интенсификации гетерогенного процесса, протекающего в диффузионной области
- •Процессы массопередачи в гомогенных средах
- •Лекция № 7 Закономерности управления простым обратимым гомогенным процессом
- •Лекция № 8 Закономерности управления сложными процессами
- •Лекция № 9 Закономерности управления каталитическими процессами
- •Основные стадии и кинетические особенности гетерогенно-каталитических процессов
- •Требования к гетерогенным катализаторам:
- •Химические свойства катализатора
- •Физические свойства катализатора
- •Лекция № 11 Теория химического реактора
- •Классификация химических реакторов
- •Материальный баланс реактора
- •Лекция № 12 Гидродинамические модели реакторов. Вывод характеристических уравнений.
- •Реактор идеального вытеснения непрерывного действия
- •Сравнение рис и рив
- •Каскад реакторов идеального смешения непрерывного действия
- •Гидродинамические режимы в реальных реакторах
- •Распределение времени пребывания в проточных реакторах
- •Лекция № 14 Теплоперенос в химических реакторах
- •Уравнение теплового баланса реактора
- •1.Политропический режим
- •2. Адиабатический режим
- •3.Изотермический режим
Лекция № 14 Теплоперенос в химических реакторах
Температура оказывает существенное влияние на скорость химического процесса и другие показатели его эффективности. При проведении реакций разного типа требуется различный температурный режим. Под температурным режимом реактора понимают поддержание в нем необходимой и оптимальной для данного процесса температуры. В промышленной практике используют два типа температурного режима:
режим постоянных температур
режим переменных температур.
Выбор режима определяется, в основном, технологическим классом реакции.
|
Тип реакции |
Критерии эффективности процесса |
Температурный режим |
|
1. Простая необратимая реакция |
скорость реакции при Т↑ r↑ |
постоянная максимально оптимальная температура или повышающийся температурный режим |
|
2. Простая обратимая реакция
а) эндотермическая или слабо экзотермическая
б) сильно экзотермическая |
скорость реакции, положение равновесия при Т↑ r↑, α*↑
при Т↑ r↑, α*↓ |
постоянная максимально оптимальная температура
понижающийся температурный режим |
|
3. Сложные реакции
а) Еа цел.р.= Еа побоч..р.
б) Еа цел.р.>Еа побоч..р.
в) Еа цел.р.< Еа побоч..р.
|
скорость реакции, селективность при Т↑ r↑,S=const
при Т↑ r↑,S↑
при Т↑ r↑,S↓ |
постоянная максимально оптимальная температура
постоянная максимально оптимальная температура
постоянная минимально оптимальная температура
|
Температура в реакторе может изменяться по двум причинам:
за счет протекания химической реакции (если реакция экзотермическая, температура повышается, если эндотермическая – понижается);
за счет теплообмена с окружающей средой, то есть температура в реакторе зависит от теплового режима реактора.
По тепловому режиму выделяют три модели реакторов: адиабатический, изотермический и политропический.
Учет всех тепловых явлений осуществляется при составлении теплового баланса реактора, уравнение которого, наряду с уравнением материального баланса, является основой для расчета реакторов.
Уравнение теплового баланса реактора
В общем виде уравнение теплового баланса записывается
Qприход=Qрасход,
где Qприход– количество тепла, поступающего в реактор в единицу времени,Qрасход– количество тепла, расходуемого в реакторе в единицу времени.
Тепло приходит в реактор с реагентами Qреаг.и выделяется (или поглощается) в результате химической реакцииQхим.р.
Qприход=Qреаг.±Qхим.р.
Расход тепла происходит в результате уноса тепла с продуктами Qпрод., теплообмена с окружающей средойQт/об.; часть тепла накапливается в реактореQнакоп..
Qрасход=Qпрод.±Qт/об.+Qнакоп.
Qреаг.±Qхим.р.=Qпрод.±Qт/об.+Qнакоп.
Обозначим Qпрод.-Qреаг.=Qконв.– конвективный перенос тепла.
Тогда после преобразований получим
Qнакоп.= -Qконв.±Qт/об.±Qхим.р.- уравнение теплового баланса реактора в общем виде.
Если температура неодинакова в разных точках объема реактора или во времени, используют дифференциальную форму уравнения теплового баланса, выведенную для некоторого элементарного объема dxdydz.
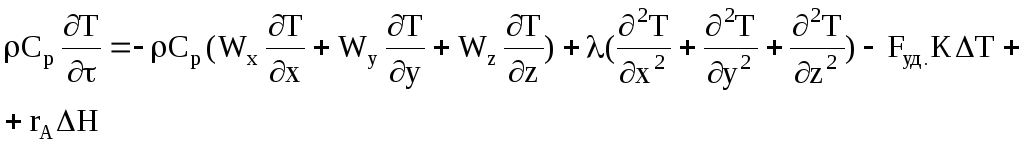
где ρ – плотность реакционной смеси; Ср– удельная теплоемкость реакционной смеси;x,y,z– пространственные координаты,Wx,Wy,Wz- составляющие скорости движения потока в направлении осейx,y,z; λ – коэффициент молекулярной и турбулентной теплопроводности реакционной смеси;Fуд.– удельная поверхность теплообмена; К – коэффициент теплопередачи; ∆Т = Т – Тт/нос.( Т – температура реакционной смеси, Тт/нос.– температура теплоносителя);rA- скорость химической реакции; ∆Н – тепловой эффект реакции.
Решение дифференциального уравнения связано с большими трудностями. Однако в каждом конкретном случае его можно упростить. Например, при стационарном режиме в проточных реакторах Qнакоп.= 0, для периодических реакторов отсутствует конвективный перенос теплаQконв.= 0.
Выведем уравнения теплового баланса для различных гидродинамических и тепловых моделей реакторов.
