
Охрана вод часть 1
.pdf11
По степени однородности дисперсные системы подразделяют на два
типа:
1)гомогенные, т.е. системы, в которых отсутствует чётко выраженная граница раздела фаз;
2)гетерогенные, т.е. системы, в которых имеется чётко выраженная граница раздела фаз.
Понятия гомо- и гетерогенности системы являются относительными и зависят от масштаба рассмотрения. Практически любая система, гомогенная в макромасштабе, может с уменьшением масштаба рассмотрения переходить в гетерогенную. В основном к гомогенным системам относят истинные растворы, а коллоидные и другие системы, в принципе, следует считать гетерогенными.
По кинетическим свойствам дисперсной фазы дисперсные системы подразделяют на два класса:
1)свободнодисперсные системы, в которых дисперсная фаза подвижна;
2)связнодисперсные системы, в которых частицы дисперсной фазы связа-
ны между собой и не могут свободно перемещаться. Свободнодисперсные системы в свою очередь по степени дисперс-
ности подразделяют на 3 вида:
1)ультрамикрогетерогенные – размер частиц лежит в пределах от 10-9 до 10-7 м. Их часто называют истинно коллоидными или просто коллоидными. Частицы дисперсной фазы в этих системах настолько малы, что вещество, из которого они состоят почти целиком, находится в коллоидном состоянии, т.е. практически содержит только поверхностные атомы и молекулы. Такие частицы, в отличие от отдельных молекул, обладают определённым агрегатным состоянием. С ростом числа молекул в частице последняя постепенно приобретает все свойства фазы. В современной литературе ультрагетерогенные системы часто называют
12
«золями». Среди них различают: твёрдые золи – системы Т/Т (большинство твёрдых тел), аэрозоли – золи с газообразной дисперсионной средой, лиозоли – золи с жидкой дисперсионной средой;
2)микрогетерогенные – размер частиц от 10-7 до 10-5 м. К ним относят суспензии (Т/Ж), эмульсии (Ж/Ж), порошки (Т/Г), пены (Г/Ж);
3)грубодисперсные - размер частиц от 10-5 м и более. В основном это системы Т/Г (песок, щебень и др.).
Свободнодисперсные системы в зависимости от механизма процесса образования подразделяются на 2 вида:
1)лиофобные - образующиеся в результате принудительного диспергирования одной из фаз;
2)лиофильные - образующиеся при самопроизвольном диспергировании одной из фаз.
Связнодисперсные системы классифицируются по размерам пор:
1)микропористые – размер пор до 2•10-9м;
2)переходнопористые - размер пор от 2•10-9м до 2•10-7м;
3)макропористые - размер пор свыше 2•10-7м.
Системы Т/Т часто удобнее подразделять по дисперсности так же, как свободнодисперсные системы.
Устойчивость дисперсных систем
Устойчивость дисперсных систем подразделяют на два вида:
1)устойчивость к осаждению дисперсной фазы (седиментационная устойчивость) – характеризует способность дисперсной системы сохранять равномерное распределение частиц дисперсной фазы по объёму дисперсионной среды;
13
2)устойчивость к агрегации частиц дисперсной фазы (агрегативная устойчивость) - характеризует способность дисперсной системы противодействовать процессам укрупнения частиц дисперсной фазы.
Седиментационная устойчивость
Для свободнодисперсных систем, в которых движение частиц дисперсной фазы не осложнено их агрегацией, характерны общие закономерности седиментации (разделения фаз). Скорость этого процесса определяется следующими свойствами:
•дисперсная фаза: удельный вес, размер и форма частиц;
•дисперсионная среда: плотность и вязкость.
Для дисперсных систем, в которых дисперсионной средой является жидкость, комплексным параметром, оценивающим их седиментационную устойчивость, который учитывает все указанные свойства, является гидравлическая крупность частиц дисперсной фазы, т.е., по сути, усреднённая скорость вертикального движения (осаждения или всплывания) этих частиц (мм/с).
Агрегативная устойчивость
Лиофобные системы по определению должны обладать избытком поверхностной энергии, если она не скомпенсирована введением стабилизаторов. Поэтому в таких системах постоянно происходят самопроизвольные процессы укрупнения частиц дисперсной фазы, т.е. происходит снижение поверхностной энергии за счёт уменьшения удельной поверхности. Таким образом, лиофобные системы являются агрегативно неустойчивыми.
14
Укрупнение частиц может осуществляться двумя путями:
1)изотермической перегонкой - переносом вещества от мелких частиц к крупным, в результате чего мелкие частицы постепенно растворяются (испаряются), а крупные – растут.
2)коагуляцией – слипанием и слиянием частиц. В общем смысле под коагуляцией понимают потерю агрегативной устойчивости дисперсной системой. Она в конечном итоге приводит к расслоению (разделению) фаз. К этому процессу также относят адгезионное взаимодействие частиц дисперсной фазы с макроповерхностью (адагуляция). В более узком смысле коагуляцией называют слипание частиц, а процесс слияния частиц – коалисценцией.
Устойчивая свободнодисперсная система, в которой дисперсная фаза равномерно распределена по всему объёму дисперсионной среды, может образоваться в результате конденсации из истинного раствора. Потеря агрегативной устойчивости приводит к коагуляции, первый этап которой состоит в сближении частиц дисперсной фазы и взаимной их фиксации на небольших расстояниях друг от друга. Между частицами остаются прослойки дисперсионной среды. В результате образуются коагуляционные структуры, отличающиеся подвижностью частиц относительно друг друга под действием сравнительно небольших нагрузок, или флокулы (флокуляция – образование агрегатов из нескольких частиц, разделённых прослойками среды).
Более глубокий процесс коагуляции приводит к разрушению прослоек дисперсионной среды и непосредственному контакту частиц. В итоге образуются жесткие агрегаты из твёрдых частиц или происходит полное слияние жидких и газообразных частиц (коалисценция).
Таким образом, понятие коагуляции включает в себя несколько процессов, идущих с уменьшением удельной поверхности дисперсной фазы.
15
Агрегативная устойчивость нестабилизированных лиофобных систем носит кинетический характер. Судить о ней можно по скорости процессов, обусловленных избытком поверхностной энергии:
•при изотермической перегонке - по скорости массопереноса от мелких частиц к крупным;
•при коагуляции - по скорости слипания (слияния) частиц.
Кроме того, агрегативная устойчивость может носить термодинамический характер. Это наблюдается, если дисперсная система не обладает избытком поверхностной энергии. В таких системах не происходит процесс коагуляции.
Различают термодинамически агрегативно устойчивые системы и системы, термодинамически устойчивые к коагуляции. Лиофильные системы термодинамически агрегативно устойчивы, и для них процесс коагуляции не характерен. Лиофобные стабилизированные системы – термодинамически устойчивы к коагуляции. Термодинамически устойчивые к коагуляции системы являются термодинамически неустойчивыми к изотермической перегонке.
Существуют термодинамические и кинетические факторы агрегативной устойчивости дисперсных систем. Термодинамическими являются факторы, снижающие поверхностное натяжение. Кинетические факторы в основном связаны с гидродинамическими свойствами среды, а именно, с замедлением сближения частиц, вытекания и разрушения прослоек среды между ними.
Различают следующие термодинамические и кинетические факторы устойчивости дисперсных систем:
•электростатический фактор – уменьшение межфазного натяжения в результате возникновения двойного электрического слоя на поверхности частиц;
16
•адсорбционно-сольватный фактор – уменьшение межфазного натяжения при воздействии частиц дисперсной фазы с дисперсионной средой;
•энтропийный фактор – стремление дисперсной фазы к равномерному распределению по объёму дисперсионной среды;
•структурно-механический фактор - образование на поверхности частиц пленок, обладающих упругостью и механической прочностью, разрушение которых требует затраты энергии и времени;
•гидродинамический фактор – снижение скорости коагуляции за счет изменения вязкости среды и плотности дисперсной фазы и дисперсионной среды;
•смешанные факторы – совокупность термодинамических и кинетических факторов, приводящих к снижению поверхностного натяжения и проявлению структурно-механических свойств прослоек.
Сточная вода представляет собой отличную от обычных гидросмесей
среду со специфическими физическими свойствами, определяемыми содержанием в ней растворённых веществ и коллоидов; т.е. сточную жидкость следует считать и суспензоидом и эмульсоидом.
Взвешенные вещества сточных вод делятся на оседающие и неоседающие. К оседающим относят вещества, выпадающие на дно сосуда в виде осадка в результате двухчасового отстаивания в лабораторных условиях. Характеристика этих взвешенных веществ может быть получена по кинетике их выпадения в осадок.
После сушки выпавшей взвеси при 1050 С и взвешивания определяют содержания (в мг/л) оседающих веществ. Отношение массы оставшейся золы после прокаливания воздушно-сухого осадка при температуре 6000 С к общей массе абсолютно-сухого вещества осадка, выраженное в процентах, даёт зольность осадка. Потеря при прокаливании определяет количество беззольного вещества.
17
Общее количество взвешенных веществ в бытовых сточных водах принимается около 65г на одного человека в сутки, из них 60-75% - оседающие с зольностью 20-30% (СНиП 2.04.03-85).
Сток дождевых вод отличается высоким содержанием взвеси. Основное её количество представлено мелкодисперсными частицами. Такой состав взвеси и малая способность частиц к агломерации обуславливают низкую скорость осветления этой категории сточных вод при отстаивании. Образующийся при этом осадок характеризуется высокой зольностью (7080%). На долю твёрдой фазы стока приходится основное количество органических примесей: около 70% эфирорастворимых и около 90% от общего количества окисляющихся веществ.
1.2.2. Бактериальное загрязнение сточных вод
Любая вода содержит некоторое количество различных организмов, среди которых находятся и болезнетворные бактерии. Наибольшее количество микроорганизмов содержится в поверхностных водах, а также фекальных стоках и сточных водах животноводческих комплексов. Это объясняется наличием в них большого количества органических веществ. Под действием микроорганизмов происходит минерализация органики, т.е. распад органических соединений до СО2 и Н2О.
Все микроорганизмы делятся на аэробные, т.е. развивающиеся только в присутствии кислорода, и анаэробные, развивающиеся в бескислородной среде.
Для оценки бактериального загрязнения воды используют три показателя: коли-титр, коли-индекс и общее микробное число.
Первые два показателя указывают на количество болезнетворных бактерий в воде и измеряются: коли-титр - в л/шт, коли-индекс - в шт/л.
18
Общее микробное число показывает количество всех видов микроорганизмов, находящихся в воде (шт/л).
1.3. ХИМИЧЕСКОЕ И БИОХИМИЧЕСКОЕ ПОТРЕБЛЕНИЕ КИСЛОРОДА
Для определения степени загрязненности сточных вод органическими веществами используются два параметра: химическое (ХПК) и биохимическое потребление кислорода (БПК).
1.3.1. Химическое потребление кислорода
ХПК – количество кислорода (или окислителя в пересчете на кислород) в мг/л, необходимое для полного окисления содержащихся в пробе сточных вод органических веществ, при котором углерод, водород, сера, фосфор и другие элементы (кроме азота), если они присутствуют в органическом веществе, окисляются до CO2, Н2О, P2O5, SO3, а азот превращается в аммонийную соль. При этом кислород, входящий в состав окисляемых веществ, участвует в процессе окисления, а водород этих соединений отдаёт по 3 атома на каждый атом азота при образовании аммонийной соли.
Значение ХПК находится в прямой зависимости от содержания взвешенных веществ в воде. Например, по данным лаборатории поверхностного стока ВНИИВО, полученным на 17 водосборных бассейнах Харькова, эта зависимость имеет вид
ХПК = 4,8В23 ,
где В – содержание взвешенных веществ в воде, мг/л.
19
ХПК взвеси в дождевых водах составляет около 0,4 мг на 1 мг органических веществ; тот же показатель для проб почвы с газонов - в 5-8 раз меньше.
1.3.2. Биохимическое потребление кислорода
БПК называют количество кислорода в мг/л, требуемое для окисления находящихся в 1л воды органических веществ в аэробных условиях в результате происходящих в воде биологических процессов. БПК не включает расхода кислорода на нитрификацию, т.е., другими словами, этот показатель можно считать составной частью ХПК.
По времени определения различают БПК5, БПК20 и БПКполн. Биохимическое окисление различных органических веществ проис-
ходит с разной скоростью. По данным профессора В.Т. Каплина, к легко окисляемым - ”биологически мягким” веществам относят формальдегид, глюкозу, мальтозу, низшие алифатические спирты, фенол, фурфурол и др. Константы скорости их окисления составляют 1,4-0,30 суток-1. Среднее место (k=0,30-0,05 суток–1) занимают крезолы, нафтолы, ксиленолы, резорцин, пирокатехин, пирогаллол, гваякол, анионактивные ПАВ и др. К медленно разрушающимся - ”биологически жестким” веществам (k=0,029- 0,002 суток–1) следует отнести тимол, гидрохинон, сульфанол НП-1, неионогенные ПАВ и др. Скорость окисления также зависит от того, насколько данная микрофлора адаптировалась к тем веществам, которые находятся в воде. Процесс биохимического окисления может быть относительно коротким (2-3 суток), но может и затянуться на 10-15 суток. Поэтому определение БПК сточных вод производят до тех пор, пока содержание органических веществ в пробе не будет постоянным. Это так называемое БПКполн. Часто ограничиваются определением БПК за определённое время
20
прохождения процесса (инкубации). Это БПК5 или БПК20, что допустимо для стоков, не содержащих ”биологически жестких” веществ.
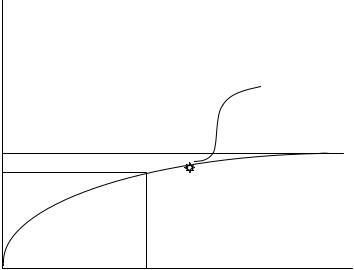
Как говорилось выше, величина БПК не учитывает расход кислорода на нитрификацию, т.е. на превращение аммонийных ионов в нитрит ионы, а затем в нитрат ионы. Этот процесс совершается под действием нитрифицирующих микроорганизмов и начинается, когда большая часть органических веществ уже окислена, а остались только наиболее «биологически жесткие» (рис. 1.2).
БПК мгО2/л
нитрификация
БПКполн
БПК5
Начало нитрификации
0 |
3 |
6 |
9 |
сутки |
Рис. 1.2. Зависимость БПК от времени
В течение ряда лет за БПКполн условно принимали расход кислорода на биохимическое окисление органических веществ до начала нитрификации, определяемого по появлению в растворе нитрит-ионов.
Эта величина была ниже истинной. Ошибка в данном случае была тем больше, чем сильнее сточная вода была загрязнена промышленными отходами. Кроме того, анализ сточных вод, прошедших биологическую очистку и поэтому содержащих изначально нитриты, был вообще невозможен. Указанное затруднение удалось устранить, когда были найдены вещества, которые в очень малых концентрациях полностью подавляют
