
1 Определение поверхностного натяжения жидкости
1.1 Общие сведения
Поверхностное натяжение относится к группетак называемых поверхностных явлений, которые происходят на границе раздела фаз. К наиболее известным из них можно также отнести адсорбционные явления, адгезионно-когезионные процессы, капилярные явления. Поверхностным натяжением характеризуется повышенная активность молекул поверхностного слоя и в этом смысле поверхностное натяжение является фактором интенсивности поверхностной энергии. Из рисунка 1 видно, что на молекулы, расположенные внутри жидкости (молекулы В), силы притяжения соседних молекул действуют со всех сторон одинаково. В то же время, на молекулы находящиеся на поверхности (молекулы П), силы притяжения действуют не одинаково. Равно действующая этих сил (силаR) направлена вглубь жидкости. В результате жидкость стремится сократить свою поверхность, провоцируя увеличение поверхностного натяжения.
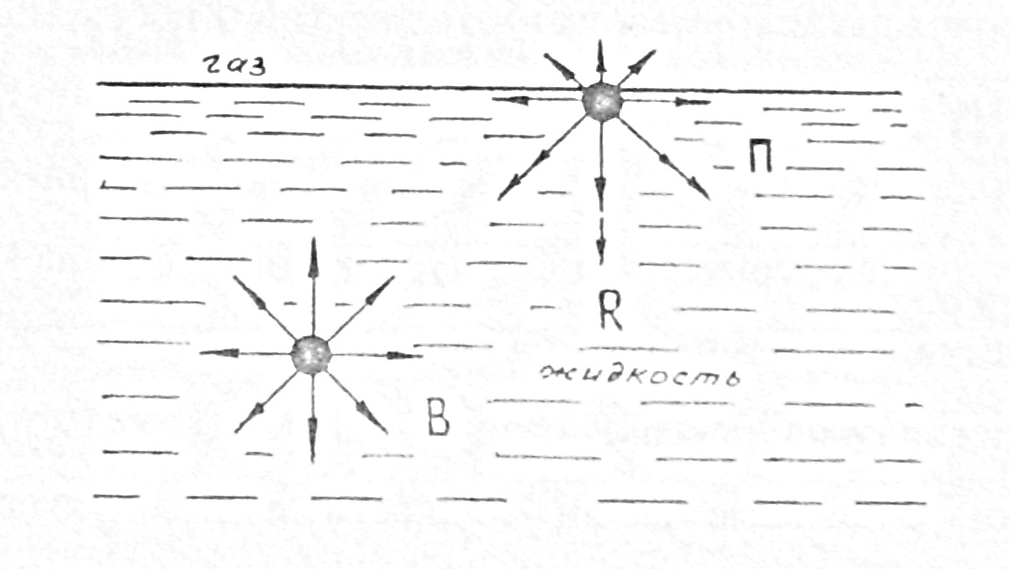
Рис. 1. Силовое взаимодействие молекул
С другой стороны, чтобы увеличить поверхностность жидкости необходимо вывести молекулы жидкости из глубины на поверхность. Для этогонеобходимо совершить работу численно равную величине поверхностного натяжения. Например, поверхностное натяжение воды составляет 73 Дж\м2. Это означает, что нужно затратить количество работы (энергии) в 73 Дж, чтобы увеличить поверхность воды на 1 м2. Величина этой работы, отнесенная к единице образованной поверхности, называется поверхностным натяжением или коэффициентом поверхностного натяжения и может быть определена по формуле:
![]() (1)
(1)
-где ![]() - изменение энергии поверхностного слоя
жидкости (энергии Гиббса) при изменении
площади свободной поверхности жидкости
∆П.
- изменение энергии поверхностного слоя
жидкости (энергии Гиббса) при изменении
площади свободной поверхности жидкости
∆П.
Поверхностное натяжение жидкости зачастую определяют по отношению к границе газовой фазы (воздуху). Из-за несимметричности силовых полей на границе раздела между жидкой и газовой фазами (см. рис.1) энергия Гиббса на поверхности раздела выше, чем в объеме фаз. Из второго закона термодинамики следует, что любые процессы, которые сопровождаются уменьшением энергии Гиббса, протекают самопроизвольно. Поэтому жидкая фаза стремится принять такую форму, в которой удельная поверхность минимальна. Например, капля жидкости принимает сферическую форму, в которой отношение величины поверхности к величине объема минимальное. Любые процессы, ведущие к уменьшению поверхностного натяжения, являются самопроизвольными Отдельные капли жидкости при соприкосновении сливаются в более крупные, потому что при одинаковом объеме поверхность крупной капли меньше, чем нескольких мелких капель в сумме. А уменьшение площади поверхности ведет к уменьшению энергии Гиббса и следовательно уменьшению поверхностного натяжения.
Поверхностное натяжение зависит от различных факторов:
от природы самих жидкостей (см. табл. 1);
-от температуры жидкости (с ростом температуры поверхностное натяжение жидкости уменьшается, а при критической температуре равно нулю);
от примесей, растворенных в жидкости (растворенные в жидкости вещества способны как понижать, так и повышать поверхностное натяжение).
Поверхностное натяжение в жидкости можно измерить сравнительно легко, а для твердых тел измерение поверхностного натяжения связано со значительными трудностями и, как правило, определяется косвенными методами.
Таблица 1 Поверхностное натяжение веществ в жидком состоянии
-
Вещество
Температура
измерения, К

10-3 Н/м

Дж/м2
Спирт (этиловый)
293
21,6
Вода
293
73
72,75
Ртуть
293
480
485
Железо
1808
1800
Шлак синтетический
2023 - 2073
200 -400
Повышение температуры вызывая увеличение кинетической энергии молекул приводит к ослаблению сил взаимного притяжения молекул как внутри фазы, так и на границе раздела. Поэтому при повышении температуры поверхностное натяжение уменьшается. Это уменьшение поверхностного натяжения при постоянном давлении в широком интервале температур происходит по линейному закону
𝜎Т=𝜎0-АТ (2)
где 𝜎Т - поверхностное натяжение при заданной температуре,
𝜎0 - поверхностное натяжение при некотором стандартном состоянии.
А-коэффициент
Экстраполируя эту зависимость в область высоких температур, можно найти критическую температуру, при которой 𝜎Т=0. В этих условиях жидкая фаза существовать не может, но это те условия, в которых начинается процесс возникновения поверхностного натяжения и, используя которые, можно определить коэффициент А. 𝜎Т=0 в уравнение (2) определяет коэффициент в виде А=𝜎/Т, а с учетом𝜎=∆G (см. уравнение 1).
![]()
Если сравнить полученное выражение с выражением изменения энтропии (∆s) через изменение энергии Гиббса (∆G)
![]()
нетрудно убедиться, что коэффициент А в уравнении (2) есть изменение энтропии при образовании единицы площади поверхности однокомпонентной жидкой фазы. Введение нового компонента в жидкость изменяет поверхностное натяжение. В зависимости от характера взаимодействия растворенного вещества с растворителем концентрация растворенного вещества может быть в поверхностном слое выше, чем в глубинных слоях и наоборот. В первом случае растворенное вещество называется поверхностно- активным веществом (ПАВ). Во втором случае - поверхностно неактивным веществом. Для описания этих явлений используют величину Г, называемую адсорбцией, которая показывает наличие избытка растворенного вещества в поверхностном слое раствора.
Качественная связь между адсорбцией (Г), поверхностным натяжением (𝜎) и концентрацией растворенного вещества (с) описывается уравнением Гиббса
![]() T
(3)
T
(3)
где R-газовая постоянная
Т - абсолютная температура
![]() -
мера поверхностной активности
-
мера поверхностной активности
При введении ПАВ поверхностное натяжение (𝜎) жидкости уменьшается с увеличением концентрации (с) этого поверхностно активного вещества. Из уравнения Гиббса очевидно, что отношение𝜕𝜎/𝜕c будет величиной отрицательной, т.к. приращение величины поверхностного натяжения в этом случае отрицательное, а приращение величины концентрации растворенного вещества положительное. В целом, с учетом знака «минус» адсорбция «Г» по уравнению (3) получается величиной положительной, т.е. Г>0.
Если расписать уравнение (3) по отношению к поверхностному натяжению и считать, что процесс растворения протекает при постоянной температуреи постоянном давлении, получим
![]() (4)
(4)
После интегрирования уравнение (4) буден выглядеть
𝜎=А+В ln c (5)
где А и В – коэффициенты регрессии, которые можно найти методом наименьших квадратов, используя экспериментальные данные.
Для определения поверхностного натяжения жидкости существует несколько методов. В лабораторной работе используется наиболее распространенный классический метод – метод наибольшего давления газовых пузырьков, образующихся в жидкости непосредственно под поверхностью. Метод определения реализуется на установке, являющейся прототипом известного прибора Ребиндера и представленной на рис.2:
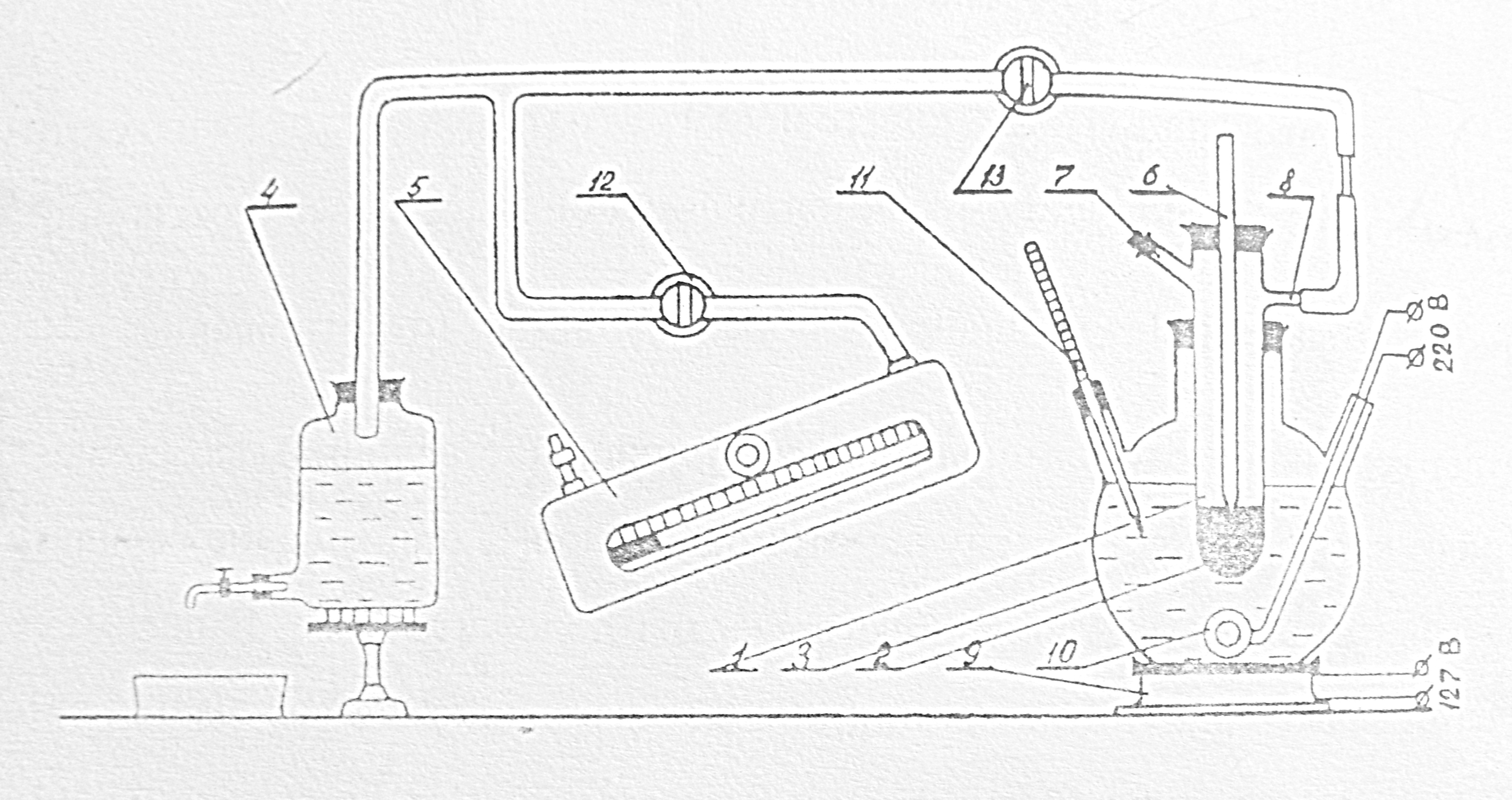
Рис.2. Схема экспериментальной установки
