
- •1. Строение атома. Периодический закон
- •Количественные характеристики химических элементов
- •1.2. Модель Бора электронного строения атома водорода и водородоподобных ионов
- •1.3. Волны материи
- •1.4. Вероятностная модель строения атомов. Электронные и электронно-графические формулы атомов
- •1.5. Периодическая система химических элементов и закономерности изменения атомных характеристик элементов.
- •2. Химическая связь
- •Ионная модель химической связи. Поляризация ионов.
- •2.2 Теория кристаллического поля.
- •2.3. Метод валентных связей.
- •2.4. Метод молекулярных орбиталей
- •2.4.2. Металлическая связь. Зонная теория кристаллов.
- •2.5. Метод гипервалентных связей
- •2.6. Водородная связь
- •2.7. Межмолекулярное взаимодействие.
2.2 Теория кристаллического поля.
 Подобно ионной
модели, теория кристаллического поля
(ТКП) предполагает, что комплексные
соединения образуются в результате
электростатического взаимодействия
между центральным ионом
комплексообразователем и лигандами.
Однако, в отличие от лигандов, которые
рассматриваются как точечные заряды
или диполи, центральный ион
рассматривается с учетом эго электронной
структуры и ее изменения под действием
электрического поля лигандов.
Подобно ионной
модели, теория кристаллического поля
(ТКП) предполагает, что комплексные
соединения образуются в результате
электростатического взаимодействия
между центральным ионом
комплексообразователем и лигандами.
Однако, в отличие от лигандов, которые
рассматриваются как точечные заряды
или диполи, центральный ион
рассматривается с учетом эго электронной
структуры и ее изменения под действием
электрического поля лигандов.
 Основным эффектом
действия электрического поля лигандов
на электронную структуру центрального
иона d-металла является расщепление
его пятикратно вырожденных
валентных d-орбиталей, в результате
различного направления в пространстве
dxy,
dxz,
dyz,
dz2,
dx2-y2
орбиталей и, как следствие
этого, различной эффективности
взаимодействия d-электронов c
лигандами. Характер расщепления
d-орбиталей зависит от
пространственного
расположения (симметрии) лигандов
вокруг иона металла Чем ниже
симметрия лигандного окружения
иона металла, тем расщепление d-орбиталей
больше:
Основным эффектом
действия электрического поля лигандов
на электронную структуру центрального
иона d-металла является расщепление
его пятикратно вырожденных
валентных d-орбиталей, в результате
различного направления в пространстве
dxy,
dxz,
dyz,
dz2,
dx2-y2
орбиталей и, как следствие
этого, различной эффективности
взаимодействия d-электронов c
лигандами. Характер расщепления
d-орбиталей зависит от
пространственного
расположения (симметрии) лигандов
вокруг иона металла Чем ниже
симметрия лигандного окружения
иона металла, тем расщепление d-орбиталей
больше:
Тетраэдр Сферическое Октаэдр Тетрагонально Плоский
электрическое искаженный квадрат
поле лигандов октаэдр
Схема 1. Качественная диаграмма расщепление d-орбиталей.
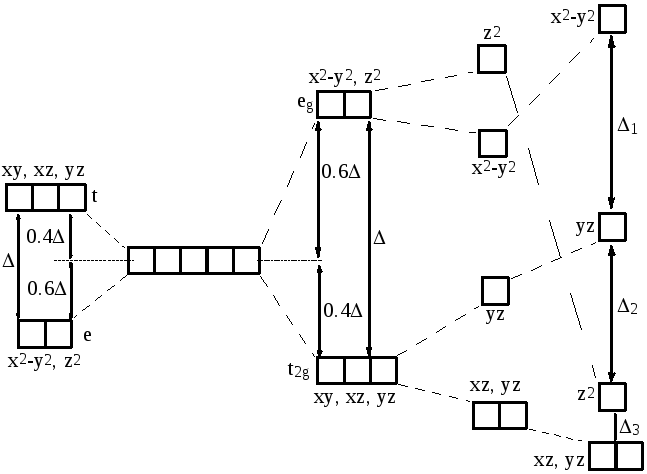
Действие электрического поля лигандов, расположенных в вершинах октаэдра на координатных осях x, y и z приводит для октаэдрических комплексов [ML6]z к расщеплению пятикратно вырожденных d-орбиталей центрального иона металла 2 группы - низкоэнергетические трехкратно вырожденные t2g(dxy, dxz, dyz) орбитали и более высокоэнергетические двукратно вырожденные eg(dx2-y2, dz2) орбитали. Для тетраэдрических комплексов [ML4]z d-орбитали металла также расщепляются на 2 группы, но энергия трехкратно вырожденных t-орбиталей выше по сравнению с энергией е-орбиталей. Понижение симметрии лигандного окружения центрального иона металла при переходе от октаэдрических к тетрагонально искаженным и плоскоквадратным комплексам: [ML6]z транс-[ML4X2]z [ML4]z приводит к дальнейшему расщеплению d-орбиталей иона металла.
Разность энергий между расщепленными орбиталями называется параметром расщепления кристаллическим полем и обозначается или 10Dq. Поскольку средняя энергия d-орбиталей при переходе от сферически симметричного поля лигандов к октаэдрическому полю остается неизменной, то относительное понижение энергии трехкратно вырожденных t2g-орбиталей происходит на величину 0.4, а повышение энергии eg-орбиталей на 0.6. Величина параметра для данного комплекса определяется эффективностью действия электрического поля лигандов на центральный ион комплексообразователь и зависит как от природы центрального иона металла, так и лигандов:
с увеличением главного квантового числа валентных d-орбиталей иона металла 3d4d5d в результате увеличения их размера величина в подобных октаэдрических комплексах последовательно увеличивается примерно на 30-50%;
с увеличением степени окисления металла величина увеличивается – для подобных октаэдрических комплексов со степенью окисления металла +3 величина примерно на 40-80% больше, чем для металла со степенью окисления +2;
наиболее распространенные лиганды могут быть расположены в ряд, называемый спектрохимическим рядом лигандов, по возрастанию величины для их комплексов с ионами металлов в их обычном низшем окислительном состоянии: I- < Br- < Cl- ~ SCN- < F- < OH- < C2O42- ~ H2O < NCS- < NH3 < NO2 < H- < CN- ~ CO;
величина параметра т для тетраэдрических комплексов составляет примерно 40-50% от величины о для аналогичных октаэдрических комплексов, что близко к теоретическому значению: т = 4/9; полная величина расщепления (1 + 2 + 3) для плоскоквадратных комплексов примерно на 30% больше параметра расщепления для аналогичных октаэдрических комплексов.
Пример 1. Расположить следующие комплексы в порядке увеличения параметра : а) [CoF6]3-, [Co(CN)6]3-, [Co((NH3)6]3+; б) [CoF6]3-, [RhF6]-, [IrF6]3-; в) [CoCl4]2- (тетраэдр), [CoCl6]4-.
Решение. а) величина в ряду октаэдрических комплексов Co(III) определяется положением лигандов в спектрохимическом ряду: [CoF6]3- < [Co(NH3)6]3+ < [Co(CN)6]3-;
б) в ряду фторидных октаэдрических комплексов [MF6]3- увеличивается значение главного квантового числа валентных d-орбиталей иона металла Co3+(3d6), Rh3+(4d6), Ir3+(5d6), что и приводит к увеличению параметра в ряду: [CoF6]3- < [RhF6]3- < [IrF6]3-;
в) с уменьшением координационного числа при переходе от октаэдрических к однотипным тетраэдрическим комплексам параметр уменьшается: [CoCl6]4- > [CoCl4]2- (тетраэдр).
Заполнение электронами расщепленных d-орбиталей металла в комплексах происходит в соответствии с принципом минимума энергии, принципом Паули и правилом Хунда. Для октаэдрических комплексов с d1, d2, d3, d8, d9 и d10 электронной конфигурацией центрального иона металла независимо от параметра минимальной энергии комплекса соответствует только один порядок распределения электронов по t2g и eg орбиталям с неизменным по сравнению со свободным ионом металла значением спиновой мультиплетности (2S+1):
|
Мz+ |
(2S+1) |
[Mz+L6]x |
(2S+1) |
|
d1 |
2 |
(t2g)1 |
2 |
|
d2 |
3 |
(t2g)2 |
3 |
|
d3 |
4 |
(t2g)3 |
4 |
|
d8 |
3 |
(t2g)6(eg)2 |
3 |
|
d9 |
2 |
(t2g)6(eg)3 |
2 |
|
d10 |
1 |
(t2g)6(eg)4 |
1 |
В тоже время, для ионов металлов с d4, d5, d6, d7 электронной конфигурацией в зависимости от соотношения параметра и энергии межэлектронного отталкивания (Eм.о.) минимальной энергии комплекса могут соответствовать два типа распределения электронов по t2g и eg орбиталям металла: 1) если < Eм.о., то заполнение электронами t2g и eg орбиталей происходит в соответствии с правилом Хунда и спиновая мультиплетность таких высокоспиновых комплексов совпадает с мультиплетностью свободного иона металла; 2) если же > Eм.о., то первоначально происходит полное заполнение электронами t2g орбиталей и только потом eg орбиталей; спиновая мультиплетность таких низкоспиновых комплексов уменьшается по сравнению со свободным ионом металла:
|
Mz+ |
(2S+1) |
[Mz+L6]x | |||
|
Высокоспиновый |
(2S+1) |
Низкоспиновый |
(2S+1) | ||
|
d4 |
5 |
(t2g)3(eg)1 |
5 |
(t2g)4(eg)0 |
4 |
|
d5 |
6 |
(t2g)3(eg)2 |
6 |
(t2g)5(eg)0 |
3 |
|
d6 |
5 |
(t2g)4(eg)2 |
5 |
(t2g)6(eg)0 |
1 |
|
d7 |
4 |
(t2g)5(eg)2 |
4 |
(t2g)6(eg)1 |
3 |
Пример 2. Опишите электронное строение, определите спиновую мультиплетность и охарактеризуйте магнитные свойства следующих октаэдрических комплексов: а) [CrF6]3- и [Cr(CN)6]3-; б) [CoF6]3- и [Co(CN)6]3-; в) [IrF6]3- и [Ir(CN)6]3-.
Решение. а) электронное строение иона Cr3+(3d3) определяет независимо от природы лигандов единственный порядок заполнения электронами его расщепленных в октаэдрическом поле лигандов орбиталей, отвечающих минимальной энергии комплексов: (t2g)3(eg)0. Спиновая мультиплетность комплексов [CrF6]3- и [Cr(CN)6]3- совпадает с мультиплетностью свободного иона Cr3+ и составляет (2S+1) = 4. Наличие трех неспаренных электронов определяет парамагнитные свойства обоих комплексов;
б) электронное строение иона Co3+(3d6) определяет в зависимости от силы поля лигандов возможность образования как высокоспиновых, так и низкоспиновых октаэдрических комплексов. Поскольку из положения в спектрохимическом ряду лигандов следует, что F- является лигандом слабого поля, а CN- - лигандом сильного поля, то электронное строение [CoF6]3- соответствует высокоспиновому комплексу с (t2g)3(eg)1 электронной конфигурацией Co(III) и спиновой мультиплетностью (2S+1) = 5, характеризующей парамагнитные свойства комплекса, тогда как [Co(CN)6]3- является низкоспиновым комплексом с (t2g)6(eg)0 электронной конфигурацией Co(III) и спиновой мультиплетностью (2S+1)= 1 – комплекс характеризуется диамагнитными свойствами;
в) поскольку, увеличение параметра в ряду 3d < 4d < 5d переходных металлов определяет для комплексов тяжелых 4d и 5d переходных металлов практически независимо от силы поля лигандов образование низкоспиновых комплексов, то комплексы [IrF6]3- и [Ir(CN)6]3- характеризуются подобной электронной конфигурацией иридия(III) (t2g)6(eg)0 и спиновой мультиплетностью (2S+1) = 1, определяющей диамагнитные свойства комплексов.
Для тетраэдрических и плоскоквадратных комплексов с координационным числом 4 принципиально также возможно образование двух типов комплексов – высокоспиновых и низкоспиновых. Однако, поскольку величина для тетраэдрических, октаэдрических и плоскоквадратных комплексов увеличивается примерно на 45% и 30%, то, для ионов 3d-переходных металлов образование тетраэдрических комплексов характерно с лигандами слабого поля и такие комплексы являются высоспиновыми, тогда как для лигандов сильного поля образуются плоскоквадратные низкоспиновые комплексы; увеличение параметра при переходе от ионов 3d к 4d и 5d переходным металлам приводит к образованию ими только низкоспиновых плоскоквадратных комплексов.
Пример 3. Опишите электронное строение, определите спиновую мультиплетность и охарактеризуйте магнитные свойства комплексов [NiCl4]2- и [Ni(CN)4]2-.
Решение. Положение в спектрохимическом ряду определяет Cl- и CN- в качестве лигандов слабого и сильного поля. Поэтому ион Ni2+(3d8) с хлоридным лигандом образует высокоспиновый тетраэдрический комплекс [NiCl4]2- с электронной конфигурацией e4t4 и спиновой мультиплетностью (2S+1) = 2, определяющей его парамагнитные свойства, тогда как с цианидным лигандом образуется низкоспиновый плоскоквадратный комплекс [Ni(CN)4]2- с электронной конфигурацией (dxz,yz)4(dz2)2(dxy)2, спиновой мультиплетностью (2S+1) = 1 и диамагнитными свойствами.
Наряду с магнитными свойствами, ТКП позволяет объяснить и предсказывать оптические свойства комплексов, которые определяются фотоиндуцированным переходом электрона с более низкоэнергетических d-орбиталей на свободные более высокоэнергетические орбитали. Так, оптические свойства и окраска октаэдрических комплексов [Ti3+L6]z с (t2g)1(eg)0 электронной конфигурацией иона металла определяются переходом электрона между t2g и eg орбиталями при поглощении квантов света, энергия которых соответствует энергетическому различию между t2g и eg орбиталями: Е = hc/ = . Поскольку величина параметра зависит от природы лигандов и центрального иона металла, то комплексы с различными лигандами и ионами металлов поглощают кванты света различной энергии, что и определяет различие в их оптических спектрах поглощения. Если длина волны поглощаемых комплексами квантов света соответствует видимой области света = 400 – 750 нм, то комплексы имеют характерную окраску, соответствующую не поглощенным квантам видимого света. Например, полоса поглощения с максимумом при 493 нм в спектре [Ti(H2O)6]3+ соответствует желто-зеленой области видимого света. Поскольку более коротковолновые “синие” и более длинноволновые “красные” кванты видимого света не поглощаются, то их суперпозиция определяет фиолетовую окраску комплекса [Ti(H2O)6]3+.
Пример 4. Определить максимум полосы поглощения комплекса [TiCl6]3-, если параметр для данного комплекса составляет 1.58 Эв. Какой области спектра видимого света соответствуют поглощаемые комплексом кванты?
Решение. Условием фотоиндуцированного перехода (t2g)1(eg)0 (t2g)0(eg)1 в комплексах Ti3+ является равенство энергии квантов света параметру и максимум полосы поглощения определяется соотношением: max = hc/
1.58 эВ = (1.5896495)/6.0231023) = 2.5310-19 Дж,
max = (6.62610-343108)/2.5310-19 = 7.8610-7 м = 786 нм,
Длина волны соответствует красной границе видимого света.
Важной характеристикой комплексов, отражающей влияние лигандов на изменение электронного строения центрального иона комплексообразователя, является энергия стабилизации кристаллическим полем (ЭСКП) – выигрыш в энергии при заполнении электронами расщепленных d-орбиталей металла в комплексе данной симметрии по сравнению с заполнением электронами пятикратно вырожденных d-орбиталей металла в эквивалентном сферически симметричном электрическом поле. Например, для октаэдрических комплексов заселение каждым электроном t2g орбиталей приводит к понижению энергии на величину 0.4, а заселение eg орбиталей - к повышению энергии на 0.6:
|
Мz+ |
[ML6]x |
ЭСКП |
Мz+ |
[ML6]x |
ЭСКП |
|
d1 |
(t2g)1(eg)0 |
0.4 |
d10 |
(t2g)6(eg)4 |
0 |
|
d2 |
(t2g)2(eg)0 |
0.8 |
d9 |
(t2g)6(eg)3 |
0.6 |
|
d3 |
(t2g)3(eg)0 |
1.2 |
d8 |
(t2g)6(eg)2 |
1.2 |
|
d4 |
(t2g)3(eg)1 (t2g)4(eg)0 |
0.6 |
d7 |
(t2g)5(eg)2 (t2g)6(eg)1 |
0.8 |
|
d5 |
(t2g)4(eg)2 (t2g)4(eg)0 |
0 |
d6 |
(t2g)4(eg)2 (t2g)4(eg)0 |
0.4 |
Величина ЭСКП является важным параметром ТКП для объяснения и предсказания различий в энергии между разными комплексами и, как следствие этого, в их свойствах.
Пример 5. Как и почему изменяются окислительно-восстановительные свойства аквакомплексов: [Cr(H2O)6]2+, [Cr(H2O)6]3+, [Cr(H2O)6]4+?
Решение. Поскольку вода является лигандом слабого поля, то аквакомплексы хрома являются высокоспиновыми и характеризуются следующими электронными конфигурациями иона металла и значениями ЭСКП: [Cr(H2O)6]2+ (t2g)3(eg)1, ЭСКП = 0.6; [Cr(H2O)6]3+ (t2g)3(eg)0, ЭСКП = 1.2; [Cr(H2O)6]4+ (t2g)2(eg)0, ЭСКП = 0.8. Чем больше величина ЭСКП, тем более устойчиво окислительное состояние хрома. Таким образом, наиболее устойчивым среди аквакомплексов хрома является комплекс хрома(III), для которого не характерны ни заметные окислительные ни восстановительные свойства. Наоборот, для менее устойчивых аквакомплексов Cr(II) характерны восстановительные свойства, а для аквакомплексов Cr(IV) – окислительные свойства, обеспечивающие их переход в более устойчивый комплекс хрома(III):
[Cr(H2O)6]4+ + e [Cr(H2O)6]3+ + e [Cr(H2O)6]2+.
Пример 6. Почему в ряду двухзарядных катионов ранних d-элементов с октаэдрическим окружением молекулами воды изменение радиуса с ростом заряда ядра происходит не монотонно: Sc2+ (~90 пм) > Ti2+ (86 пм) > V2+ (79 пм) Cr2+ (80 пм) < Mn2+ (83 пм)?
Решение. Если бы все катионы М2+ имели сферическую симметрию распределения электронной плотности вокруг ядра, то увеличение заряда ядра приводило бы к монотонному уменьшению ионного радиуса. Однако, для катионов d-элементов расщепление d-орбиталей под действием электрического поля лигандов и различный характер заселения их электронами приводит к несимметричному распределению электронной плотности по отношению к ядру, что и определяет влияние электронной конфигурации катиона на величину его эффективного радиуса.
Октаэдрические аквакомплексы комплексы М2+ катионов ранних 3d-элементов являются высокоспиновыми и характеризуются следующими электронными конфигурациями и значениями ЭСКП: Sc2+ (t2g)1(eg)0, ЭСКП = 0.4; Ti2+ (t2g)2(eg)0, ЭСКП = 0.8; V2+ (t2g)3(eg)0, ЭСКП = 1.2; Cr2+ (t2g)3(eg)1, ЭСКП = 0.6; Mn2+ (t2g)3(eg)2, ЭСКП = 0. Таким образом, в ряду Sc2+Ti2+V2+ в результате заселения электронами t2g орбиталей происходит последовательное увеличение величины ЭСКП, что приводит к усилению дополнительного уменьшения значения их эффективных радиусов по сравнению с ожидаемым для сферически симметричных ионов. Последовательное уменьшение величины ЭСКП для ионов Cr2+ и Mn2+ определяет уменьшение влияния несимметричности электронного строения катиона на его радиус, что и приводит к последовательному увеличению их радиусов.
Наряду с магнитными, оптическими и термодинамическими свойствами, ТКП позволяет объяснить специфику стереохимического строения комплексов, характеризующихся как “правильными”, так и искаженными структурами. Например, для координационного числа 6, возможно образование комплексов как с “правильным” октаэдрическим строением (все шесть лигандов расположены на одинаковых расстояниях от иона металла), так и тетрагонально искаженных, характеризующихся разным расстоянием 2 аксиальных (по оси z) и 4 экваториальных (в плоскости xy) лигандов от иона металла. Предельным случаем тетрагонального искажения октаэдрического комплекса, в котором аксиальные лиганды удалены от центрального иона металла на бесконечно большое расстояние, является образование плоскоквадратной структуры.
Причиной тетрагонального искажения октаэдрических комплексов является неравномерное распределение электронов по t2g и eg орбиталям иона металла. Комплексы с равномерным распределением электронов по t2g и eg орбиталям – (t2g)3(eg)0, (t2g)3(eg)2, (t2g)6(eg)2, (t2g)6(eg)0, (t2g)6(eg)4 – характеризуются сферически симметричным характером распределения электронной плотности и образуют правильные октаэдрические структуры. Если на орбиталях eg типа, направленных непосредственно в сторону лигандов, находится 1 или 3 электрона - (t2g)3(eg)1, (t2g)6(eg)1, (t2g)6(eg)3 - то аксиальные и экваториальные лиганды испытывают разное отталкивание и, как следствие этого, будут иметь разную длину связи металл-лиганд. Неравномерное распределение электронов по t2g орбиталям - (t2g)1(eg)0, (t2g)2(eg)0, (t2g)4(eg)0, (t2g)4(eg)2, (t2g)5(eg)0, (t2g)5(eg)2 - также будет приводить к искажению комплекса. Однако, поскольку t2g орбитали направлены между лигандами, то эффект искажения октаэдрической структуры комплекса в этом случае значительно слабее.
Тетрагональное искажение октаэдрических комплексов являются отражением общего эффекта Яна-Теллера – вырожденное электронное состояние нелинейной молекулы неустойчиво; для стабилизации такая система должна подвергнуться искажению, снимающему вырождение. В согласии с эффектом Яна-Теллера, терагональное искажение приводит к расщеплению дважды вырожденных eg и трижды вырожденных t2g орбиталей (схема 1.)
Пример 7. Какие из следующих комплексов имеют правильное октаэдрическое строение, слабое и сильное тетрагональное искажение: а) [Mn(H2O)6]2+, [Cr(H2O)6]2+, [V(H2O)6]2+, [Ti(H2O)6]2+; б) [Mn(CN)6]4-, [Cr(CN)6]4-, [V(CN)6]4-, [Ti(CN)6]4-?
Решение. а) аквакомплексы двухзарядных катионов ранних d-элементов являются высокоспиновыми комплексами и характеризуются следующими электронными конфигурациями ионов металлов: [Mn(H2O)6]2+ (t2g)3(eg)2, [Cr(H2O)6]2+ (t2g)3(eg)1, [V(H2O)6]2+ (t2g)3(eg)0, [Ti(H2O)6]2+ (t2g)2(eg)0. Сферически симметричное распределение электронов в результате равномерного распределения электронов по t2g и eg орбиталям определяет правильное октаэдрическое строение комплексов [Mn(H2O)6]2+ и [V(H2O)6]2+; неравномерный характер распределения электронов по t2g орбиталям приводит к слабому искажению [Ti(H2O)6]2+, а неравномерное распределение электронов по eg орбиталям – к сильному тетрагональному искажению [Cr(H2O)6]2+;
б) цианидные комплексы двухзарядных катионов ранних d-элементов являются низкоспиновыми комплексами и характеризуются следующими электронными конфигурациями ионов металлов: [Mn(CN)6]4- (t2g)5(eg)0, [Cr(CN)6]4- (t2g)4(eg)0, [V(CN)6]4- (t2g)3(eg)0, [Ti(CN)6]4- (t2g)2(eg)0. Равномерное распределение электронов по t2g орбиталям определяет правильное октаэдрическое строение комплексов [V(CN)6]4-; все остальные комплексы характеризуются слабым искажением в результате неравномерного заселения электронами t2g орбиталей.
У пражнения:
пражнения:
Расположите и обоснуйте расположение следующих комплексов в порядке увеличения параметра : а) [CrF6]3-, [Cr(CN)6]3-, [Cr((NH3)6]3+, [Cr(NCS)6]3-, [Cr(SCN)6]3-; б) [Fe(CN)6]4-, [Ru(CN)6]4-, [Os(CN)6]4-; в) VCl4, [СoCl4]2-; г) [NiCl4]2-, [PdCl4]2-, [PtCl4]2-.
Опишите электронное строение, определите спиновую мультиплетность и охарактеризуйте магнитные свойства для следующих комплексов: [MnCl6]4-, [Mn(CN)6]4-, [FeBr6]3-, [RuBr6]3-, [OsBr6]4-, [Fe(CN)6]4-, [CoCl4]2-, [Co(H2O)6]2+, [Co(NO2)]3-, [NiBr4]2-, [PdCl4]2-, [Pt(NH3)4]2+.
Определите в каждой из пар следующих комплексов – какие комплексы имеют характерную окраску, а какие бесцветны: а) [CuCl4]2- и [ZnCl4]2-; б) [Co(CN)6]3- и [Co(NH3)6]3+; в) [AuCl4]- и [AuCl2]-.
Определить максимум полосы поглощения комплекса [TiF6]3-, если параметр для данного комплекса составляет 2.108 Эв. Какой области спектра видимого света соответствуют поглощаемые комплексом кванты?
Как и почему изменяются окислительно-восстановительные свойства комплексов кобальта: а) [Co(H2O)6]2+ и [Cо(H2O)6]3+; б) [Co(CN)6]4- и [Cо(CN)6]3-?
Почему, несмотря на устойчивость октаэдрических комплексов Pt(IV) и плоскоквадратных комплексов Pt(II) с галогенидными лигандами, комплексы Pt(III) как октадрического, так и плоскоквадратного строения крайне неустойчивы?
Почему в ряду двухзарядных катионов поздних d-элементов с октаэдрическим окружением молекулами воды изменение радиуса с ростом заряда ядра происходит не монотонно: Mn2+ (83 пм) > Fe2+ (78 пм) > Co2+ (75 пм) > Ni2+ (69 пм) Cu2+ (73 пм) < Zn2+ (74 пм)?
Какие из следующих комплексов имеют правильное октаэдрическое строение, слабое и сильное тетрагональное искажение: [Cu(NH3)6]2+, [Co(H2O)6]2+, [Fe(CN)6]4-, [MnCl6]4-, [V(H2O)6]3+, [RhCl6]3-, [IrBr6]4-, [Re(NO2)6]4-, [HfF6]2-?
Почему хлоридный комплекс Ni(II) имеет тетраэдрическое строение, а хлоридные комплексы Pd(II) и Pt(II) – плоскоквадратное? С какими лигандами комплексы Ni(II) будут иметь плоскоквадратное строение?
