
- •1. Основные термодинамические понятия (система, фаза, параметр, состояние, процесс, энергия, теплота, работа, внутренняя энергия).
- •2. I закон термодинамики, его формулировки, выражение в интегральной и дифференциальной форме.
- •3. Закон Гесса. Термохимические уравнения и их особенности. I и II следствия из закона Гесса. Стандартная энтальпия образования и энтальпия сгорания.
- •4. II закон термодинамики, его формулировки и математическая форма записи.
- •5. Расчет изменения энтропии для химической реакции и использование этой величины для определения направленности процессов в изолированных системах.
- •6. Термодинамические функции Гиббса и Гельмгольца. Способы расчета d°g и использование этой функции для определения направленности процессов в открытых системах.
- •7. Химическое равновесие. Основные его признаки. Смещение химического равновесия по принципу Ле Шателье.
- •Принцип Ле-Шателье
- •8. Химическая кинетика. Скорость химической реакции и факторы, от которых она зависит.
- •10. Влияние температуры на скорость реакции. Правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации.
- •11. Влияние катализатора на скорость реакции. Гомогенный, гетерогенный и ферментативный катализ.
- •12. Электропроводность растворов. Удельная электропроводность и факторы, от которых она зависит.
- •13. Молярная электропроводность, зависимость ее от концентрации.
- •14. Подвижность ионов. Закон Кольрауша. Расчет степени и константы диссоциации.
- •15. Электродный потенциал. Формула Нернста.
- •16. Гальванические элементы: химические, концентрационные. Расчет эдс.
- •17. Электроды сравнения (водородный, хлорсеребряный, каломельный).
- •18. Индикаторные электроды (водородный, хингидронный, стеклянный).
- •19. Адсорбция на границе раздела: твердое тело газ (жидкость). Уравнение и теория Ленгмюра. Уравнение Фрейндлиха.
- •20. Адсорбция на границе раздела жидкость газ, жидкость жидкость. Уравнение Гиббса, его анализ.
- •21. Классификация дисперсных систем.
- •22. Методы получения коллоидных растворов. Методы их очистки (диализ, электродиализ). Искусственная почка.
- •24.Устойчивость коллоидных систем: кинетическая и агрегативная. Коагуляция и факторы ее вызывающие. Правило Шульце-Гарди. Коллоидная защита.
- •25. Коллигативные свойства растворов:
4. II закон термодинамики, его формулировки и математическая форма записи.
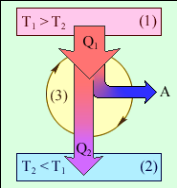
Формулировки II закона термодинамики:
Теплота самопроизвольно переходит от более нагретого тела к менее нагретому.
Вся теплота от нагретого тела (S1) не может перейти в работу (А), часть теплоты (Q2) уходит в окружающую среду.
3.
![]() ,
,
где S – энтропия. Энтропия характеризует беспорядок в системе.
Q – теплота,
Т – температура.
В
изолированных системах:
![]() .
.
------------------------------------------------------------------------------------------------------------------
5. Расчет изменения энтропии для химической реакции и использование этой величины для определения направленности процессов в изолированных системах.
Изменение энтропии в химических реакциях можно рассчитать по формуле:
![]()
В
изолированной системе энтропия
самопроизвольно возрастает, то есть
![]() .
.
Таким образом, изменение энтропии является критерием направленности процессов в изолированных системах:
![]() –реакция идет
самопроизвольно;
–реакция идет
самопроизвольно;
![]() –реакция не идет
самопроизвольно;
–реакция не идет
самопроизвольно;
![]() –реакция находится
в состоянии равновесия.
–реакция находится
в состоянии равновесия.

6. Термодинамические функции Гиббса и Гельмгольца. Способы расчета d°g и использование этой функции для определения направленности процессов в открытых системах.
В открытых системах для определения направленности процесса применяются функция Гиббса (G) и функция Гельмгольца (F):
![]() ;
;
![]() ,
,
где Н – энтальпия, S – энтропия.
В
самопроизвольных процессах G
и F
уменьшаются, то есть ![]() и
и
![]() .
.

Расчет
![]()
1.
![]() ;
;
2.![]()
![]() -
изменение энергии
Гиббса реакции.
-
изменение энергии
Гиббса реакции.
![]() -
энергия Гиббса
образования 1 моль вещества.
-
энергия Гиббса
образования 1 моль вещества.
3.![]() ,
,
где R = 8,31 Дж/моль К,
Т – температура,
Кр – константа равновесия реакции.
Применение
![]() для
определения направленности процессов
в открытых системах.
для
определения направленности процессов
в открытых системах.
![]() –реакция идет
самопроизвольно;
–реакция идет
самопроизвольно;
![]() –реакция не идет
самопроизвольно;
–реакция не идет
самопроизвольно;
![]() –реакция находится
в состоянии равновесия.
–реакция находится
в состоянии равновесия.
7. Химическое равновесие. Основные его признаки. Смещение химического равновесия по принципу Ле Шателье.
Большинство химических реакций являются обратимыми, то есть одновременно протекают и в прямом и в обратном направлениях.
Например, обратимой является реакция синтеза аммиака:
3H2
+ N2
![]() 2NH3.
2NH3.
При химическом равновесии скорость прямой реакции равна скорости обратной реакции.
Принцип Ле-Шателье
Если на систему оказать внешнее воздействие, то химическое равновесие сместится так, чтобы уменьшить внешнее воздействие.
Влияние температуры.
Повышение температуры смещает равновесие в сторону эндотермической реакции, понижение температуры смещает равновесие в сторону экзотермической реакции.
3H2
+ N2
![]() 2NH3+Q
2NH3+Q
←
повышение температуры
Влияние давления.
Повышение давления смещает равновесие в сторону реакции с образованием меньшего количества молей газообразных веществ, повышение давления смещает равновесие в сторону реакции с образованием большего количества молей газообразных веществ.
3H2
(газ) + N2
(газ)![]() 2NH3(газ)
2NH3(газ)
4 моль 2 моль
→
повышение давления
