
- •Закон сохранения массы.
- •Закон постоянства состава
- •1) Состав оксидов азота (в процентах по массе) выражается следующими числами:
- •Закон эквивалентов
- •Закон Авогадро
- •Стандартная энтальпия образования (стандартная теплота образования)
- •Температурная зависимость теплового эффекта (энтальпии) реакции
- •Внутренняя энергия
- •Идеальные газы
- •Внутренняя энергия вещества, тела, системы
- •Энтропия
- •Потенциал Гиббса
- •Изопроцессы
- •Следствия из закона Гесса
- •Скорость химической реакции
- •Правило Вант-Гоффа
- •Закон действующих масс в химической термодинамике
- •Влияние давления
- •Концентрация растворов
- •Массовая доля (также называют процентной концентрацией)
- •Нормальная концентрация (мольная концентрация эквивалента)
- •Второй закон Рауля
- •Криоскопия
- •Растворы электролитов и неэлектролитов
- •Значения pH в растворах различной кислотности
- •Закон разбавления Оствальда
- •Гидролиз органических веществ
- •Теории кислот и оснований
- •Эволюция представлений о кислотно-основных взаимодействиях
- •Теория электролитической диссоциации Аррениуса-Оствальда
- •Протонная теория Брёнстеда-Лоури
- •Электронная теория Льюиса
- •Общая теория Усановича
- •Окисление
- •Восстановление
- •Виды окислительно-восстановительных реакций
- •Окисление, восстановление
- •Электролиз
- •Гальванические элементы
- •Электрические аккумуляторы
- •Топливные элементы
- •Коррозия металлов
- •Химическая коррозия
- •Виды коррозии
- •Борьба с коррозией
- •Система холодного цинкования
- •Газотермическое напыление
- •Цинкование
Изопроцессы
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 28 января 2010; проверки требуют 33 правки.
Изопроцессы — термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление, объём или температура — остаются неизменными. Так, неизменному давлению соответствует изобарный процесс, объёму — изохорный, температуре — изотермический, энтропии — изоэнтропийный (например, обратимый адиабатический процесс). Линии, изображающие данные процессы на какой-либо термодинамической диаграмме, называются изобара, изохора, изотерма и адиабатасоответственно. Изопроцессы являются частными случаями политропного процесса.
Изобарный процесс
Основная статья: Изобарный процесс
![]()
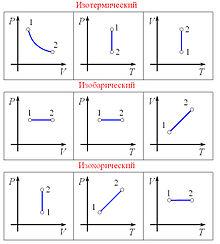
Графики изопроцессов в различных системах координат
Изобарный процесс (др.-греч. ισος, isos — «одинаковый» + βαρος, baros — «вес») — процесс изменения состояния термодинамической системы при постоянном давлении (P = const)
![]()
Зависимость объёма газа от температуры при неизменном давлении была экспериментально исследована в 1802 году Жозефом Луи Гей-Люссаком.Закон Гей-Люссака: При постоянном давлении и неизменных значениях массы газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const.
Изохорный процесс
Изохорный процесс (от греч. хора — занимаемое место) — процесс изменения состояния термодинамической системы при постоянном обьеме (V =const). Для идеальных газов изохорический процесс описывается законом Шарля: для данной массы газа при постоянном объеме, давление прямо пропорционально температуре:
![]()
Линия, изображающая изохорный процесс на диаграмме, называется изохорой.
ещё стоит указать что поданная к газу энергия расходуется на изменение внутренней энергии то есть Q = 3* ν*R*T/2=3*V*ΔP, где R — универсальная газовая постоянная, ν количество молей в газе, T температура в Кельвинах, V объём газа, ΔP приращение изменения давления. а линию, изображающая изохорный процесс на диаграмме, в осях Р(Т), стоит продлить и пунктиром соединить с началом координат, так как может возникнуть недопонимание.
Изотермический процесс
Изотермический процесс (от греч. «термос» — тёплый, горячий) — процесс изменения состояния термодинамической системы при постоянной температуре (T = const)(PV = const). Изотермический процесс описывается законом Бойля — Мариотта:
При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.
Изоэнтропийный процесс
Изоэнтропийный процесс — процесс изменения состояния термодинамической системы при постоянной энтропии (S = const). Изоэнтропийным является, например, обратимый адиабатический процесс: в таком процессе не происходит теплообмена с окружающей средой. Идеальный газ в таком процессе описывается следующим уравнением:
pVγ = const
где γ — показатель адиабаты, определяемый типом газа.
Закон Гесса
Закон Гесса — основной закон термохимии, который формулируется следующим образом:
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращениев одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Например, окисление глюкозы в организме осуществляется по очень сложному многостадийному механизму, однако суммарный тепловой эффект всех стадий данного процесса равен теплоте сгорания глюкозы.
![]()
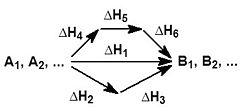
На рисунке приведено схематическое изображение некоторого обобщенного химического процесса превращения исходных веществ А1, А2… в продукты реакции В1, В2…, который может быть осуществлен различными путями в одну, две или три стадии, каждая из которых сопровождается тепловым эффектом ΔHi. Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением:
ΔH1 = ΔH2 + ΔH3 = ΔH4 + ΔH5 + ΔH6
Закон открыт русским химиком Г. И. Гессом в 1840 г.; он является частным случаем первого начала термодинамики применительно к химическим реакциям. Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты самых разнообразных химических процессов; для этого обычно используют ряд следствий из него.
