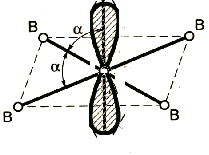
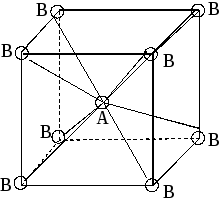
Метод Гиллеспи (раздаточный материал)
.docМетод (теория) отталкивания валентных электронных пар (ОВЭП) Сиджвика-Пауэлла. Правила Гиллеспи.
Этот метод позволяет предсказать структуру (геометрию молекул). В 1940 г его предложили Сиджвик и Пауэлл, а в 1957 г он был усовершенствован Гиллеспи и Найхамом.
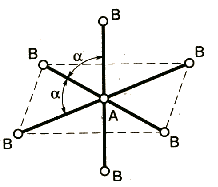
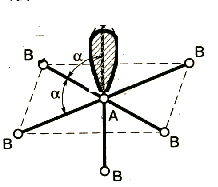
1. Расположение электронных пар вокруг центрального атома в молекуле зависит от числа таких пар: они принимают пространственное положение, сводящее к минимуму их взаимное отталкивание.
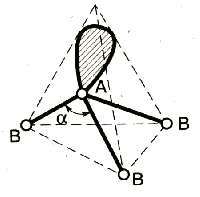
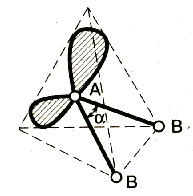
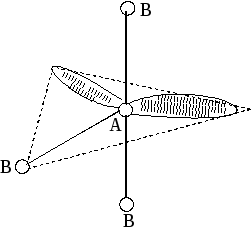
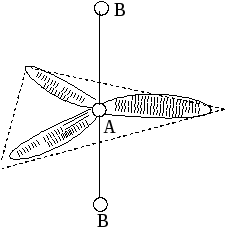
2. По степени взаимного отталкивания электронные пары располагаются в ряд: НП−НП > НП−СП > СП−СП (отталкивание убывает). НП − несвязывающая (неподеленная) электронная пара ближе расположена к ядру и облако неподеленной пары электронов занимает большее пространство, чем связывающей электронной пары (СП).
3. Электронные пары занимают такие позиции, чтобы углы между ними были максимальны, а отталкивание минимально. Поэтому из нескольких возможных структур, включающих взаимодействие под углом 90°, наиболее благоприятна структура, обладающая наименьшим числом взаимодействий под углом 90° с неподеленной парой.
4. Электронное облако двойной связи занимает большее пространство, чем облако одинарной связи.
5. Чем более электроотрицателен атом − партнер центрального атома, тем меньше пространства вблизи центрального атома требуется для электронной пары. Так как она оттянута к атому-сосоду.
Подсчитывают стерическое число (СЧ) для центрального атома в молекуле, и в зависимости от его значения − такова и геометрия.
СЧ есть сумма связывающих электронных пар (т.е. число связей) и неподеленных электронных пар:
СЧ = СП + НП.
Если у центрального атома нет неподеленных пар, то СЧ = СП.
Кратность связи не влияет на предсказанные структуры: СЧ(ВН2) = СЧ(СО2) = 2.
Если один из присоединенных атомов заменен неподеленной парой, то геометрия молекулы меняется:
|
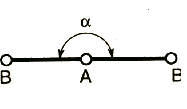
АВ3 |
АВ2Е |
|
СЧ = 3 |
СЧ = 2 + 1 |
|
А − центральный атом; В − заместители (периферические атомы); Е − неподеленная электронная пара плоская треугольная молекула угловая молекула |
|
или
|
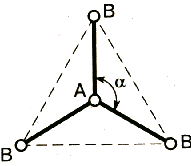
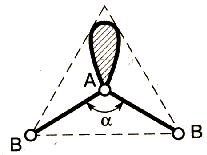
АВ4 |
АВ3Е |
АВ2Е2 |
|
СЧ (СН4) = 4 + 0 |
СЧ(:NH3) = 3 + 1 |
СЧ(Н2 |
|
тетраэдрическое строение |
тригональная пирамида |
угловая |
|
валентный угол 109,5° |
валентный угол 107,3° |
валентный угол 104,5° |
|
Тип гибридизации центрального атома А |
Стерическое число для центрального атома СЧ = СП + НП |
Состав молекулы |
Структура молекулы |
Примеры |
|
|
СЧ |
НП |
||||
|
sp или dp |
2 |
0 |
АВ2 |
линейная |
BeCl2; HgCl2; CO2 |
|
sp2, dp2 или sd2 |
3 |
0 |
АВ3 |
плоская треугольная |
BF3; SO3; NO3−; CO32−; COCl2 |
|
2 |
1 |
АВ2Е |
угловая (изогнутая) |
SnCl2; SO2; O3 |
|
|
sp3 или sd3 |
4 |
0 |
АВ4 |
тетраэдрическая |
CH4; CCl4; NH4+; PO43−; POCl3 |
|
3 |
1 |
АВ3E |
тригональная призма |
NH3; PF3; AsCl3; H3O+ |
|
|
2 |
2 |
АВ2E2 |
угловая (изогнутая) |
H2O; H2S; SF2 |
|
|
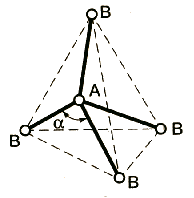
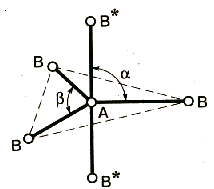
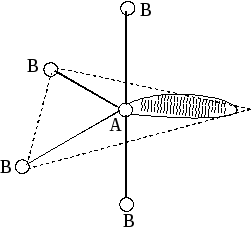
sp3d |
5 |
0 |
АВ5 |
тригональная бипирамида |
PF5 |
|
4 |
1 |
АВ4E |
искаженная тетраэдрическая |
SF4 |
|
|
3 |
2 |
АВ3E2 |
Т − образная |
ClF3 |
|
|
2 |
3 |
АВ2E3 |
линейная |
XeF2; I3−; IF3 |
|
|
sp3d2 (dxy, dyz) |
6 |
0 |
АВ6 |
октаэдрическая |
SF6; PF6−; SiF62− |
|
5 |
1 |
АВ5E |
квадратная пирамида |
IF5 |
|
|
4 |
2 |
АВ4E2 |
квадратная плоская |
XeF4; IF4− |
|
|
sp3d4
|
8 |
0 |
АВ8 |
додекаэдр |
|