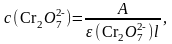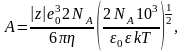- •Федеральное государственное бюджетное образовательное учреждение
- •Методические указания по оформлению и защите выпускной квалификационной работы
- •1.1 Общие требования
- •1 Обзор литературы
- •1.1 Методы определения содержания кальция (II) в водах. Измерение жесткости воды
- •1.1.1 Фотометрические методы
- •1.1.2 Титриметрические методы
- •Приложение а Валовое содержание ртути в почвах Ухтинского и Сосногорского районов
- •1.2 Рекомендации по составлению текста выпускной квалификационной работы
- •(Без пробелов)
- •1.3 Оформление таблиц
- •1.4 Оформление иллюстративного материала
- •1.5 Оформление математических и химических формул, схем и уравнений химических реакций
- •1.6 Презентация доклада
- •2 Подготовка и порядок защиты выпускной квалификационной работы
- •Определение метиланилинов в воде методом газовой хроматографии в виде галогенпроизводных
- •Приложение в Образцы кратких библиографических описаний источников информации в списках литературы
- •Приложение г Принятые сокращения названий некоторых российских и зарубежных научных журналов
- •Приложение д Физические величины, их единицы и обозначения
1.5 Оформление математических и химических формул, схем и уравнений химических реакций
При оформлении и размещении в тексте работы математических формул и химических формул веществ, схем и уравнений реакций следует придерживаться следующих рекомендаций.
1 Символы химических элементов записывают прямым шрифтом, а символы физических величин – курсивом:
m(Fe3+) = 5,0 мг; с(1/5 KMnO4) = 0,0100 моль/дм3
2 Математические уравнения и расчетные формулы набирают на компьютере с использованием редактора формул Microsoft Equation, а структурные химические формулы и уравнения химических реакций – с использованием программ ChemWord, ISIS Draw или RasWin. Их следует выделять из текста в отдельную строку. Формулы и уравнения центруют, выше и ниже каждой из них должно быть оставлена одна свободная строка. Если уравнение не умещается в одну строку, то оно должно быть перенесено на другую после знака равенства (=) или желательно после знаков плюс (+), минус (–), причем знак в начале следующей строки повторяют. При перенесении части уравнения на другую строку после умножения ставят знак () на предыдущей и следующей строке.
3 Математические формулы и уравнения, а также схемы и уравнения химических реакций (за исключением приложений) нумеруют арабскими цифрами сквозной нумерацией в последовательности, соответствующей их упоминанию в тексте, и их номера записывают в круглых скобках в крайнем правом положении на строке. Допускается их нумерация в пределах раздела с указанием номера раздела и порядкового номера объекта в нем, разделенные точкой. В каждом приложении нумерацию проводят отдельно с добавлением перед номером через точку обозначения приложения.
Ссылки на порядковые номера формул и уравнений в тексте работы дают в скобках, например, “ …в формуле (1) …” или “ …в схеме (1.1) …” или “ …расчеты были проведены по уравнению (А.1), выведенному в приложении А.”
Часто громоздкие схемы уравнений химических реакций с участием органических веществ, а также структурные формулы групп однотипных соединений целесообразно оформлять как рисунок и включать в нумерацию рисунков.
4 При написании математических формул следует применять обозначения и символы, установленные соответствующими стандартами. Стандартные символы функций в математических формулах, например, sin ; lg ; … записывают прямым шрифтом.
Недопустимо в одной формуле использовать буквенное обозначение одних величин и численные значения других величин. Наряду с буквенным обозначением величин в формуле могут быть математические коэффициенты и коэффициенты перехода от одних единиц выражения физической величины к другим.
В формулах знак умножения (∙) между символами физических величин не ставят, а ставят его только в случае замены их числовыми значениями.
Пояснения значений символов и числовых коэффициентов, входящих в формулу, следует приводить непосредственно под формулой в той же последовательности, в которой они даны в ней, с указанием единиц выражения физических величин. Формулу отделяют от пояснений запятой, первая строка пояснений должна начинаться со слова «где» без абзаца и двоеточия после него. Пояснения каждого символа дают с новой строки и разделяют между собой знаком «;», в конце ставится точка.
Пример 32
Молярную концентрацию дихромат-анионов рассчитывают по формуле:
(свободная строка)
|
(1) |
(свободная строка)
где с(Cr2O72-) – молярная концентрация дихромат-анионов, моль/дм3;
А – оптическая плотность раствора;
(Cr2O72-) – молярный коэффициент погашения, дм3/(мольсм);
l – толщина поглощающего слоя, см.
Пример 33
Коэффициент А учитывает замедление движения ионов под действием электрического поля за счет движущихся навстречу противоположно заряженных ионов:
(свободная строка)
|
(2) |
(свободная строка)
где z – относительный заряд иона;
eo= 1.60210-16 Кл – элементарный заряд;
NA = 6.0221023 моль-1 – постоянная Авогадро;
– вязкость воды, Пас;
о = 8.85410-12 Ф/м (Ф м-2кг-1с4А2) – диэлектрическая проницаемость вакуума;
– диэлектрическая проницаемость воды;
k = 1.38110-23 Дж/К (м2кгс-2K-1) – постоянная Больцмана;
Т – температура, К.
Расшифровку буквенных обозначений одних и тех же величин можно объединять. Буквенное обозначение косвенно измеряемой физической величины и ее единицы выражения можно привести в описании цели приведения формулы.
Пример 34
Изменения количества эквивалентов серной кислоты (А(n(H+)), моль) в анодном пространстве после электролиза рассчитывают по формуле:
(свободная строка)
|
(3) |
(свободная строка)
где
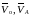 – объемы раствора гидроксида натрия,
пошедшие на титрование аликвотной части
раствора кислоты в анодном пространстве:
до и после электролиза соответственно,
см3;
– объемы раствора гидроксида натрия,
пошедшие на титрование аликвотной части
раствора кислоты в анодном пространстве:
до и после электролиза соответственно,
см3;
mA – масса раствора серной кислоты в катодном пространстве электролизера, г;
с(NaОН) – молярная концентрация гидроксида натрия в титранте, моль/дм3;
А – плотность растворов серной кислоты в анодном пространстве, г/см3;
Va – аликвотная часть раствора кислоты, взятая для анализа, см3.
5 Следует различать два понятия – схема и уравнение химической реакции.
Схема отражает качественную сторону химической реакции и в ней обычно указывают набор исходных веществ (реагенты) и через стрелку химические формулы целевых продуктов реакции, а формулы сопутствующих веществ или указывают частично, или опускают полностью. Над и под стрелкой часто указывают условия протекания реакции: температуру, природу растворителя, время и т.д.
Уравнение химической реакции предполагает указание полного набора как реагентов, так и продуктов реакции и расстановку стехиометрических коэффициентов. По физическому смыслу оно представляет собой записанный в явном виде закон сохранения количества атомов каждого химического элемента в ходе реакции. Между правой и левой частями уравнения ставится знак равно (=).
Химические формулы соединений, свойства которых обсуждаются в работе, нумеруют римскими цифрами. Возможна сквозная нумерация в последовательности, соответствующей их упоминанию в тексте, или нумерация в пределах одной схемы или уравнения, если эти схемы или уравнения представлены в тексте в виде рисунка. В первом случае ссылка на них включает номер соединения без скобок, а во втором – номер соединения дополняют номером рисунка в скобках, например,
«…соединение IV (рисунок 7)…».
Пример 35
(свободная строка)
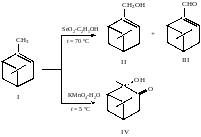
(свободная строка)
Рисунок 7 – Схема реакции окисления α-пинена
Пример 36
Уравнение реакции окисления сахарозы дихроматом калия в кислой среде
(свободная строка)
8 K2Cr2O7 + С12Н22О11 + 32 H2SO4 = 8 Cr2(SO4)3 + 12 CO2 + 8 K2SO4 + 43 H2O, (4)
(свободная строка)
или в сокращенном ионном виде
(свободная строка)
8 Cr2O72- + С12Н22О11 + 64 H+ = 16 Cr3+ + 12 CO2 + 43 H2O. (5)
(свободная строка)
Ссылки на порядковые номера химических формул, схем и уравнений реакций в тексте работы, например:
«Согласно схеме реакции, представленной на рисунке 7, в зависимости от природы окислителя и условий её протекания образуется или смесь соединений миртенола II и миртеналя III, или только 2-гидроксипинан-3-он IV » или « Согласно схеме реакции (рисунок 7)….»;
«Продукт III (рисунок 7) может быть использован…»;
« Расчет количества образовавшегося оксида углерода(IV) проводили по уравнению реакции (4)».
6 Глубину протекания химической реакции можно охарактеризовать с помощью двух показателей, которые обычно выражают в процентах – это степень превращения (конверсии) реагента X – α(X) и относительный выход целевого продукта Y – η (Y).
Степень превращения (конверсии) реагента X (α(X),%) рассчитывают по формуле:
α(X)
=
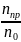 100
=
100
=
 100,
(6)
100,
(6)
где nпр, n0 – количества прореагировавшего и взятого для реакции вещества X, моль;
mпр, m0– массы прореагировавшего и взятого для реакции вещества X, г.
Говоря о выходе целевого продукта Y, следует различать теоретически возможный, равновесный и практический выходы, причем значения первых двух – рассчитывают, а практического – измеряют. Теоретически возможный выход соответствует максимально возможному количеству (массе) продукта Y, которое можно получить при условии полного и необратимого протекания реакции. Равновесный выход соответствует неполному протеканию реакции до установления химического равновесия и равен количеству (массе) продукта Y в равновесной смеси. Практический выход соответствует реально полученному в чистом виде количеству (массе) целевого продукта Y и на его значение влияют как возможная неполнота протекания реакции, так и степень извлечения данного продукта из конечной реакционной смеси.
Относительный выход целевого продукта Y (η (Y), %) рассчитывают путем сравнения равновесного или практического выхода с теоретически возможным по формуле:
η
(Y) =
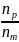 100 =
100 =
 100,
(7)
100,
(7)
где nр, nт – равновесный (практический) и теоретически возможный выходы Y, моль;
mр, mт – равновесный (практический) и теоретически возможный выходы Y, г.