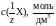- •Федеральное государственное бюджетное образовательное учреждение
- •Методические указания по оформлению и защите выпускной квалификационной работы
- •1.1 Общие требования
- •1 Обзор литературы
- •1.1 Методы определения содержания кальция (II) в водах. Измерение жесткости воды
- •1.1.1 Фотометрические методы
- •1.1.2 Титриметрические методы
- •Приложение а Валовое содержание ртути в почвах Ухтинского и Сосногорского районов
- •1.2 Рекомендации по составлению текста выпускной квалификационной работы
- •(Без пробелов)
- •1.3 Оформление таблиц
- •1.4 Оформление иллюстративного материала
- •1.5 Оформление математических и химических формул, схем и уравнений химических реакций
- •1.6 Презентация доклада
- •2 Подготовка и порядок защиты выпускной квалификационной работы
- •Определение метиланилинов в воде методом газовой хроматографии в виде галогенпроизводных
- •Приложение в Образцы кратких библиографических описаний источников информации в списках литературы
- •Приложение г Принятые сокращения названий некоторых российских и зарубежных научных журналов
- •Приложение д Физические величины, их единицы и обозначения
Приложение а Валовое содержание ртути в почвах Ухтинского и Сосногорского районов
Связь основного текста с приложениями осуществляют через ссылки, которые употребляют со словом "смотри"; его обычно сокращают и заключают вместе с шифром приложения в круглые скобки, например, (см. приложение А).
1.2 Рекомендации по составлению текста выпускной квалификационной работы
Все математические символы в тексте и в формулах записывают курсивом, а химические – прямым шрифтом. Во всех заголовках названия химических элементов и соединений записывают словами в соответствии с нормами номенклатуры. В виде исключения возможно использование традиционных тривиальных названий веществ и совмещение названия и химической формулы.
В тексте работы следует применять стандартизованные единицы физических величин, их наименования и обозначения (приложение Д). Наряду с единицами СИ при необходимости в скобках указывают единицы ранее применявшихся систем, разрешенных к применению. Применение в одном документе разных систем обозначения физических величин не допускается. В тексте перед обозначением физической величины дают ее пояснение, например, «Молярная концентрация серной кислоты в растворе – с(H2SO4)».
Буквенные обозначения единиц величин, входящих в произведение единиц величин, отделяют точкой на средней линии () без пробелов. Не допускается использование для обозначения произведения единиц величин символа ( или *).
В буквенных обозначениях отношений единиц величин в качестве знака деления используют только одну косую или горизонтальную черту. Допускается применение буквенного обозначения единицы величины в виде произведения обозначений единиц величин, возведенных в степень (положительную или отрицательную).
Между числовым значением и обозначением единицы величины ставят пробел.
Пример 6
Молярный коэффициент погашения перманганат-анионов при рН 1 и длине волны =
528 нм:
 или
или

(без пробелов)
или

(Без пробелов)
Способы выражения состава системы
Концентрация |
Доля |
||
Массовая концентрация компонента Х в растворе |
|
Молярная доля компонента |
х(Х) |
Массовая доля компонента |
(X) |
||
Молярная концентрация компонента Х в растворе |
|
Объемная доля компонента |
(Х) |
Единицы выражения доли: |
|||
Молярная концентрация эквивалентов компонента Х в растворе |
|
доля |
– |
процент |
% |
||
промилле |
‰ |
||
Моляльная концентрация компонента Х в растворе |
|
миллионная доля |
млн-1 |
При использовании понятия эквивалента компонента Х, указании его количества и молярной концентрации эквивалентов нужно обязательно конкретизировать значение фактора эквивалентности 1/z в соответствии с химической реакцией, в которой участвует вещество Х.
Пример 7
Неправильно |
Правильно |
n(1/zKMnO4) |
n(1/1KMnO4); n(1/3KMnO4); n(1/5KMnO4) |
Для выражения доли компонента Х в системе или смеси в процентах (%), промилле (‰) или в миллионных долях (млн-1) необходимо рассчитанное значение доли умножить соответственно на переводной множитель 102, 103, 106 соответственно.
Пример 8
ω(Х) = 0,001 = 0,1 % = 1 ‰ = 1000 млн-1.
При записи единиц объема и температуры следует придерживаться следующих требований:
– при точных измерениях в рамках количественного химического анализа следует применять единицы объема СИ – дм3 и см3;
– допускается использование внесистемных единиц объема – литр (л) и миллилитр (мл) при описании операций, не требующих высокой точности;
– кроме термодинамической температуры (обозначение T), допускается применять также температуру Цельсия (обозначение t), определяемую выражением t = T–Tо, где Tо = 273,15 К. Термодинамическую температуру выражают в кельвинах (К), температуру Цельсия – в градусах Цельсия (°С). Для обозначения градуса Цельсия знак находится в опции «вставка – символ».
Пример 9
Неправильно |
Правильно |
Молярная концентрация серной кислоты с(H2SO4) = 0,100 моль/л. |
Молярная концентрация серной кислоты в растворе с(H2SO4) = 0,100 моль/дм3. |
Плотность воды ρ(H2O) = 0,99707 г/мл. |
Плотность воды ρ(H2O) = 0,99707 г/см3. |
Исследование проводили при температуре Т = 298°К (Т = 25 °С) |
Исследование проводили при температуре Т = 298 К (t = 25 °С) |
Дробные числа необходимо приводить в виде десятичных дробей; при невозможности выразить числовое значение в виде десятичной дроби или из соображений удобства и наглядности допускается записывать их в виде простой дроби в одну строчку через косую черту, например, 5/32.
Числовое значение, представляющее собой дробь с косой чертой, стоящее перед обозначением единицы величины, заключают в скобки.
Пример 10
t = (1/3) ч = 20 мин
При указании значений физических величин с предельными отклонениями необходимо значение самой величины и ее предельное отклонение заключить в скобки, а обозначения единиц величины помещают за скобками.
Пример 11
m = (80,0 ± 2,5) кг
Не допускается сокращать обозначения единиц физических величин, если они употребляются без цифр, за исключением единиц физических величин в головках и боковиках таблиц и в расшифровках буквенных обозначений, входящих в формулы и рисунки.
Пример 12
Неправильно |
Правильно |
Время протекания реакции измеряли в с. Время между измерениями 10 минут.
|
Время протекания реакции измеряли в секундах. Интервал между измерениями – 10 мин. или Интервал между измерениями – 10 минут. |
Недопустимо отделять единицу физической величины от ее числового значения. Обозначения единиц величин помещают за числовыми значениями величин в одной строке с ними (без переноса на следующую строку).
Пример 13
Неправильно |
Правильно |
Молярная концентрация эквивалентов серной кислоты в растворе равна: с(1/2H2SO4) = 1 моль/дм3. |
Молярная концентрация эквивалентов серной кислоты в растворе равна: с(1/2H2SO4) = 1 моль/дм3. |
В тексте работы числовые значения единиц счета, начиная с 10, и числовые значения физических величин с обозначением единиц этих величин следует писать цифрами, а числа без обозначения единиц физических величин и единиц счета от единицы до девяти – словами.
Пример 14
Неправильно |
Правильно |
В работе проведен химический анализ 5 проб почвы, каждая из которых имела массу 1,0 г. Проведено исследование пятнадцати образцов материала. |
В работе проведен химический анализ пяти почв, навеска каждого образца 1,0 г.
Проведено исследование 15 образцов материала. |
В тексте работы, за исключением формул, таблиц и рисунков, не допускается применять:
а) математический знак минус (–) перед отрицательными значениями величин – следует писать слово «минус»;
Пример 15
Неправильно |
Правильно |
Измерения были проведены в температурном интервале от - 50 до 50 °С. |
Измерения были проведены в диапазоне температур от минус 50 до плюс 50 °С. |
б) математические знаки без числовых значений: > (больше); < (меньше), = (равно), ≥ (больше или равно), ≤ (меньше или равно), (не равно), а также знаки № (номер), % (процент).
Пример 16
Неправильно |
Правильно |
Массовая доля вещества выражена в %. |
Массовая доля вещества выражена в процентах. |
В тексте не допускается применять:
– обороты разговорной речи и профессиональный жаргон;
– произвольные словообразования;
– сокращения слов, кроме установленных правилами русской орфографии или соответствующими государственными стандартами.
Пример 17
Навеска – это масса анализируемого образца, которую измеряют взвешиванием с заданной точностью и количественно подвергают всем аналитическим процедурам.
Неправильно |
Правильно |
Навеску почвы массой 5,00 г поместили в стакан и добавили 100 см3 дистиллированной воды. |
Навеску почвы 5,00 г поместили в стакан и добавили 100 см3 дистиллированной воды. |
Пример 18
Вместимость сосуда – объем внутреннего пространства сосуда.
Емкость – сам сосуд, предназначенный для хранения твердых веществ, жидкостей, газов.
При указании вместимости сосуда приводят номинальное значение, а при указании объема жидкости в мерном сосуде (при наполнении сосуда до метки) – с указанием достоверных разрядов.
Неправильно |
Правильно |
В колбу емкостью 100 см3 внесли 2 г хлорида натрия и 30 см3 дистиллированной воды. Смесь перемешали до полного растворения соли. Объем раствора довели дистиллированной водой до метки на колбе. Объем раствора хлорида натрия 100 см3.
|
В колбу вместимостью 100 см3 внесли 2,00 г хлорида натрия и 30 см3 дистиллированной воды. Смесь перемешали до полного растворения соли. Объем раствора довели дистиллированной водой до метки на колбе. Объем раствора хлорида натрия 100,00 см3. |
Пример 19
Долю (молярную, массовую, объемную) нельзя называть концентрацией!
Неправильно |
Правильно |
Процентная концентрация серной кислоты в растворе равна 10%. |
Массовая доля серной кислоты в растворе ω(H2SO4) = 10 %. |
Концентрация раствора. Концентрированная серная кислота. |
Концентрация компонента в растворе. Концентрированный раствор серной кислоты. |
В присутствии концентрированной серной кислоты… |
В присутствии серной кислоты… или При добавлении к реакционной смеси 5 см3 концентрированного раствора серной кислоты… |
Нормальность раствора серной кислоты 0,1 н. |
Молярная концентрация эквивалентов серной кислоты в растворе с(1/2H2SO4) = 0,100 моль/дм3. |
Молярность раствора гидроксида натрия равна 0,1 М |
Молярная концентрация гидроксида натрия в растворе c(NaOH) = 0,100 моль/дм3 |
Пример 20
В тексте работы следует избегать возвратных форм глаголов при описании разного рода манипуляций автора при проведении эксперимента, а также придерживаться множественного числа и одного времени.
Неправильно |
Правильно |
Оптическая плотность растворов измерялась на… |
Оптическая плотность растворов измерена на… |
Расчеты проводились по уравнению … |
Расчеты проведены (проводили, проводят) по уравнению … |