
- •Химическая кинетика
- •Формальная кинетика
- •2. По обратимости
- •4. В зависимости от фазового состава реакционной смеси.
- •5. Кинетическая классификация на основании понятий
- •Кинетика простых необратимых реакций
- •2. Интегральные методы определения порядка реакции
- •3. Дифференциальные методы Вант-Гоффа
- •Сложные реакции
- •Принцип независимости (сосуществования) отдельных стадий
- •Типы сложных реакций.
- •Предельные случаи протекания последовательной реакции
- •Лимитирующая стадия последовательной реакции
- •Зависимость для вещества а
- •Зависимость скорости химической реакции от температуры
- •2. Определение
Предельные случаи протекания последовательной реакции
а)
![]()
![]()
б)
![]()
![]()
Лимитирующая стадия последовательной реакции
а) Скорость процесса - функция скоростей всех стадий реакции
б) В случае резкого различия скоростей последовательных стадий
скорость реакции в целом определяется скоростью наиболее медленной стадии – лимитирующей (скорость-определяющей).
Характер
зависимостей
![]()
Вещество А
Зависимость для вещества а
- падает по экспоненте
Вещество В
2. Время достижения максимальной концентрации вещества :
а) ,
б) , где
в) , если , то с
т.е., чем больше при данном тем скорее достигается максимальная концентрация промежуточного вещества B
3. Максимальный выход вещества :
а)
но
,
тогда
![]()
Далее
Окончательно
4. Анализ уравнения
а) ,
![]()
б)
![]()
т.о.
чем больше
![]() ,
тем выше ордината максимума
,
тем выше ордината максимума
Вещество С
5. S-образная форма кривой продукта реакции
, т.е.
6. Индукционный период - время разгона реакции
Принцип лимитирующей стадии химического процесса
1. Предельные случаи протекания последовательной реакции
а)
б)
Лимитирующая стадия последовательной реакции
а) Скорость процесса - функция скоростей всех стадий реакции
б) В случае резкого различия скоростей последовательных стадий
скорость реакции в целом определяется скоростью наиболее медленной стадии – лимитирующей (скорость-определяющей).
Метод стационарных (квазистационарных) концентраций
Суть метода
Метод предложен немецким ученым Боденштейном и развит Н.Н.Семеновым.
Метод применим к последовательным реакциям, если промежуточные продукты являются частицами с высокой реакционной способностью (атомы, радикалы, валентно-ненасыщенные молекулы).
В таких процессах по прошествии некоторого времени от начала реакции устанавливается такой характер течения процесса, когда скорость образования промежуточных активных частиц оказывается примерно равной скорости их расходования
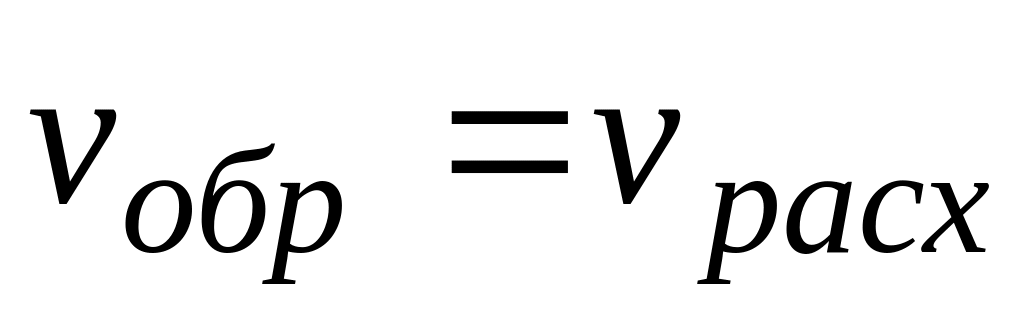 .
Тогда концентрация этих активных частиц
поддерживается практически неизменной
на протяжении всего процесса (
.
Тогда концентрация этих активных частиц
поддерживается практически неизменной
на протяжении всего процесса (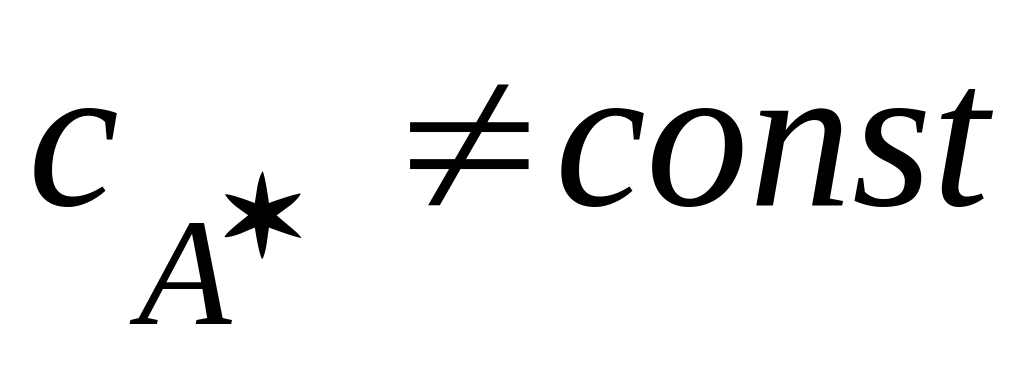 ),
а устанавливаюшийся при этом режим
протекания реакции наз. стационарным.
Отсюда и название метода.
),
а устанавливаюшийся при этом режим
протекания реакции наз. стационарным.
Отсюда и название метода.
В стационарном режиме скорость изменения концентрации активных промежуточных частиц, очевидно, равна нулю:
![]()
Метод, предложенный Боденштейном, дает возможность существенно упростить кинетический анализ сложных реакций.
a) В результирующие кинетические уравнения для скорости реакции часто входят концентрации
активных промежуточных веществ, экспериментальное нахождение концентраций которых весьма
непросто
в связи с малым временем жизни этих
частиц (![]() ).
).
б) Метод стационарных концентраций позволяет используя простые алгебраические уравнения выразить концентрации активных промежуточных веществ через концентрации устойчивых реагентов (исходных веществ или продуктов реакции), что позволяет составлять кинетические уравнения, не содержащие концентраций активных промежуточных частиц.
в) Применение метода будет рассмотрено в дальнейшем.
