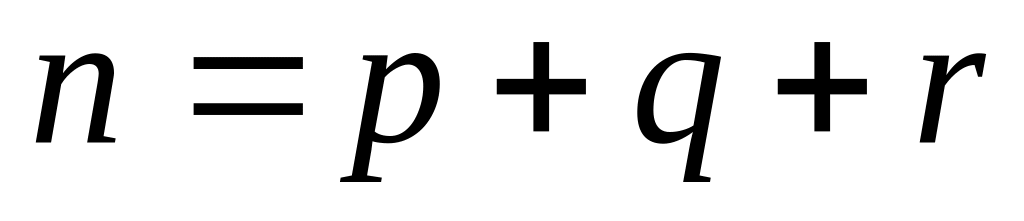- •Химическая кинетика
- •Формальная кинетика
- •2. По обратимости
- •4. В зависимости от фазового состава реакционной смеси.
- •5. Кинетическая классификация на основании понятий
- •Кинетика простых необратимых реакций
- •2. Интегральные методы определения порядка реакции
- •3. Дифференциальные методы Вант-Гоффа
- •Сложные реакции
- •Принцип независимости (сосуществования) отдельных стадий
- •Типы сложных реакций.
- •Предельные случаи протекания последовательной реакции
- •Лимитирующая стадия последовательной реакции
- •Зависимость для вещества а
- •Зависимость скорости химической реакции от температуры
- •2. Определение
2. По обратимости
а)
Обратимые (двусторонние):
![]() ,
,
![]() .
.
б)
Необратимые (односторонние):
![]() ,
,
![]() .
.
3. По механизму протекания реакции: простые (одностадийные) и
сложные (многостадийные с участием промежуточных частиц).
4. В зависимости от фазового состава реакционной смеси.
а)
Гомогенные
(![]() и гетерогенные
и гетерогенные
![]()
![]()
б)
Гомофазные
и гетерофазные
![]()
5. Кинетическая классификация на основании понятий
а)
порядка
реакции
![]() .
.
б)
молекулярности
![]() .
.
Кинетика простых необратимых реакций
Различают два способа осуществления химического процесса: в стационарных условиях и в потоке. В первом случае реакция проводится в замкнутой системе, когда все реагирующие вещества от начала и до окончания реакции остаются в пределах рассматриваемой системы. В этом случае отсутствует материальный обмен с окружающей средой.
В случае реакций в потоке исходные вещества непрерывно поступают в реактор, а продукты уводятся из сферы реакции. Такие системы получили название открытых систем.
Ниже мы рассмотрим кинетику формально простых гомогенных газофазных реакций в замкнутых системах.
Необратимые реакции Iго порядка
 ,
,
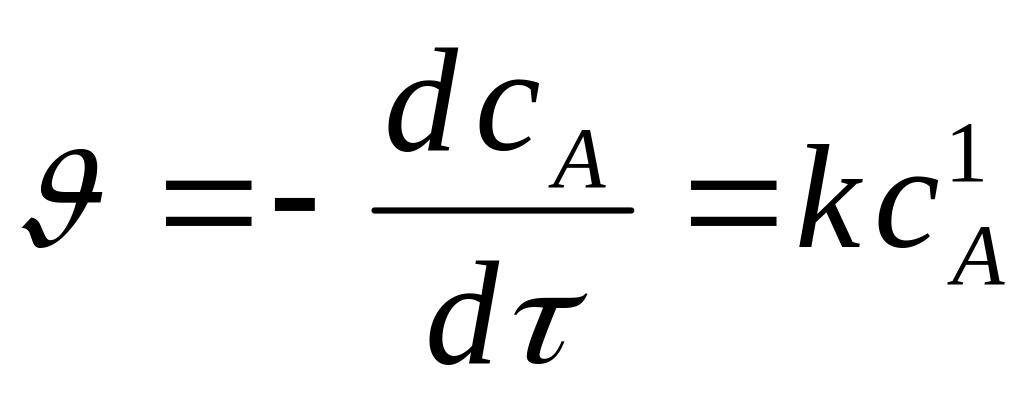
Вывод уравнения
 ,
размерность
,
размерность

Анализ уравнения.
а)
зависимость
![]()
аналитическая зависимость
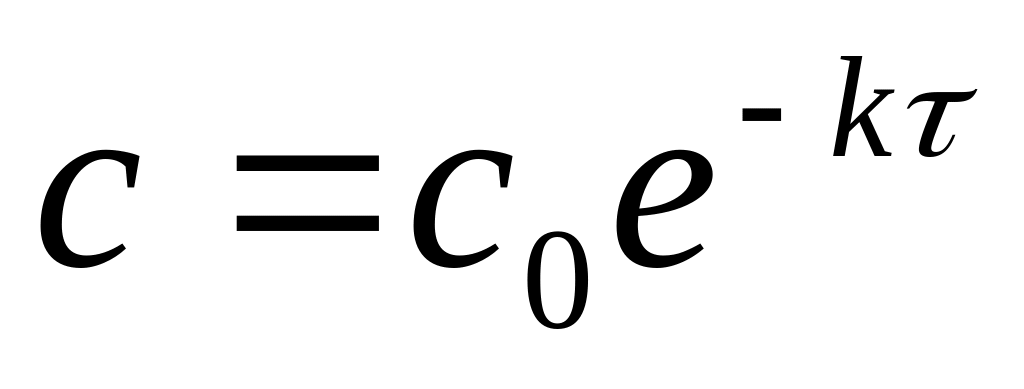 ,
,

график :
 ,
кинетическая кривая
,
кинетическая кривая
б)
графическая линейная зависимость
![]() ,
,
![]()
в)
период полупревращения
![]()
Среднее время жизни реагирующей частицы
 .
.
а)
![]() ,
,
![]()
![]() уменьшение
числа молекул в промежутке от
уменьшение
числа молекул в промежутке от
![]() до
до
![]() и, таким образом,
и, таким образом,
![]() равно числу молекул, «доживших» до
момента времени
и распавшихся в последующий б/малый
промежуток времени
равно числу молекул, «доживших» до
момента времени
и распавшихся в последующий б/малый
промежуток времени
![]() .
Умножая
.
Умножая
![]() на
,
найдем суммарную продолжительность
жизни этих молекул. Тогда для всех
молекул получаем
на
,
найдем суммарную продолжительность
жизни этих молекул. Тогда для всех
молекул получаем
![]() ,
где
,
где
![]()
Но
![]() ,
и тогда
,
и тогда
![]()
![]()
б)
Все молекулы прореагируют за б/большой
промежуток времени. Поэтому суммарную
продолжительность жизни всех первоначально
взятых молекул можно найти интегрируя
правую часть последнего выражения от
0 до
![]()

![]()
5.
К реакциям 1го
порядка относятся реакции разложения,
например, термический распад паров
ацетона:
![]() и процессы радиоактивного распада.
и процессы радиоактивного распада.
Необратимые
реакции 2го
порядка:
![]()
1.
Случай (а):
![]()
![]()
1) Вывод уравнения
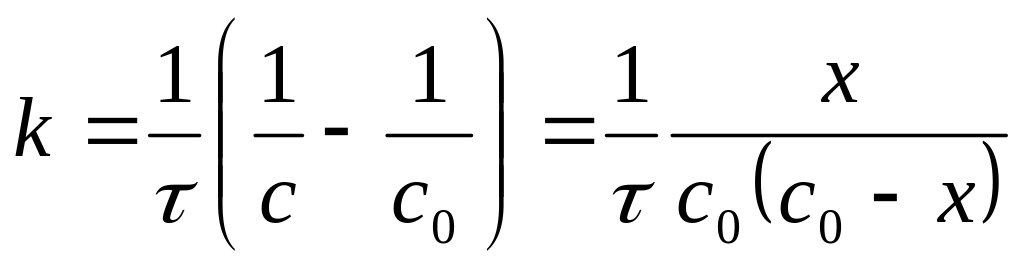 ,
,
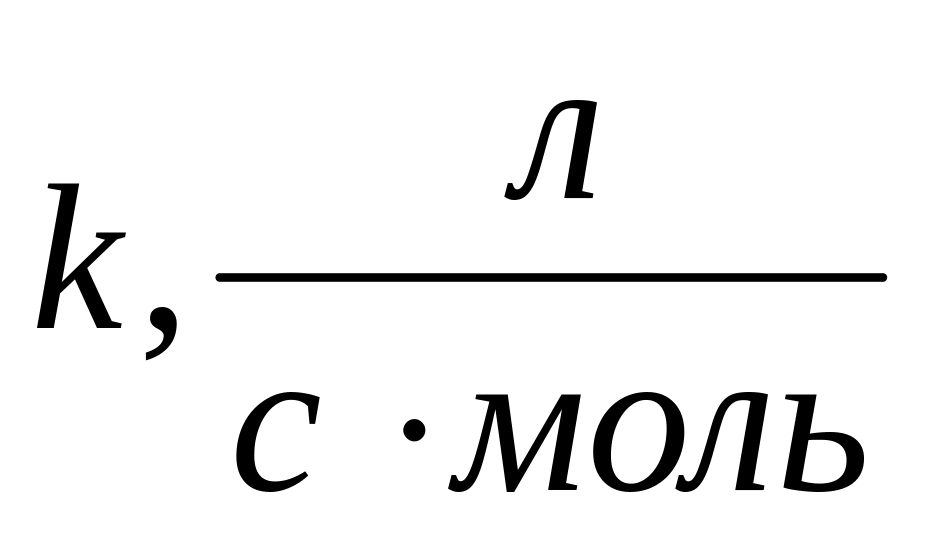
2) Зависимость :
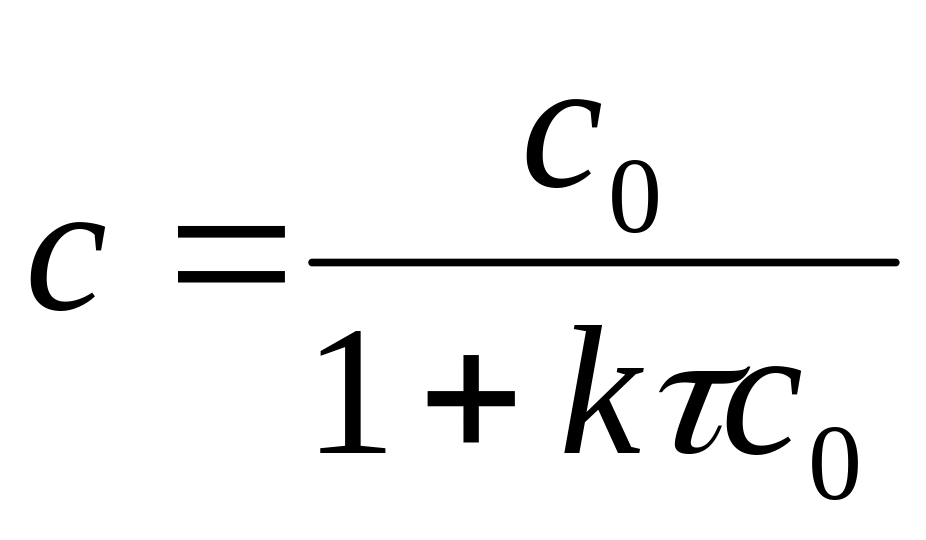

3)
Графическая линейная зависимость
![]() ,
,
![]()
4)
Период полупревращения,
![]()
5) Псевдомолекулярные реакции (гидролиз сложных эфиров),
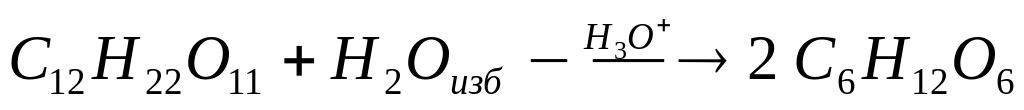
![]()
2.
Случай (б):
![]()
а)
![]() ,
где
,
где
![]() ,
,
![]()
б)
![]() ,
,
![]()
Необратимые реакции 3го порядка
1.
![]() :
:
![]()
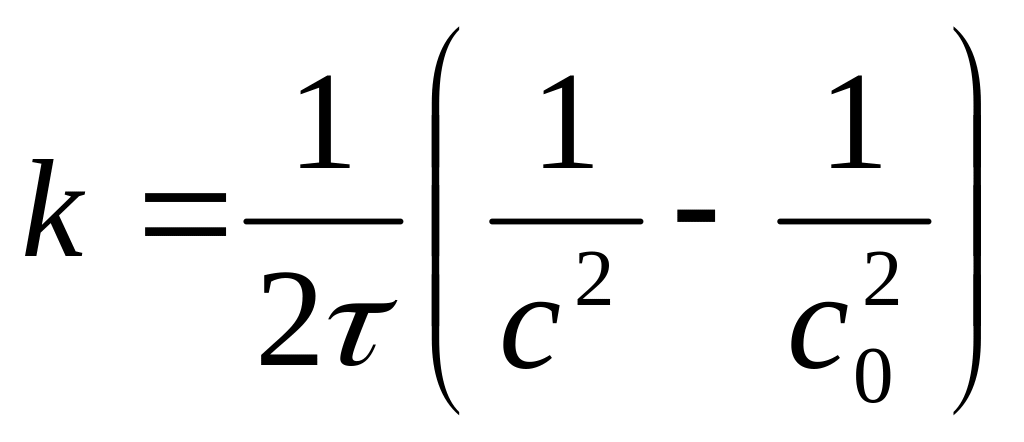 ,
,

Линейная зависимость :
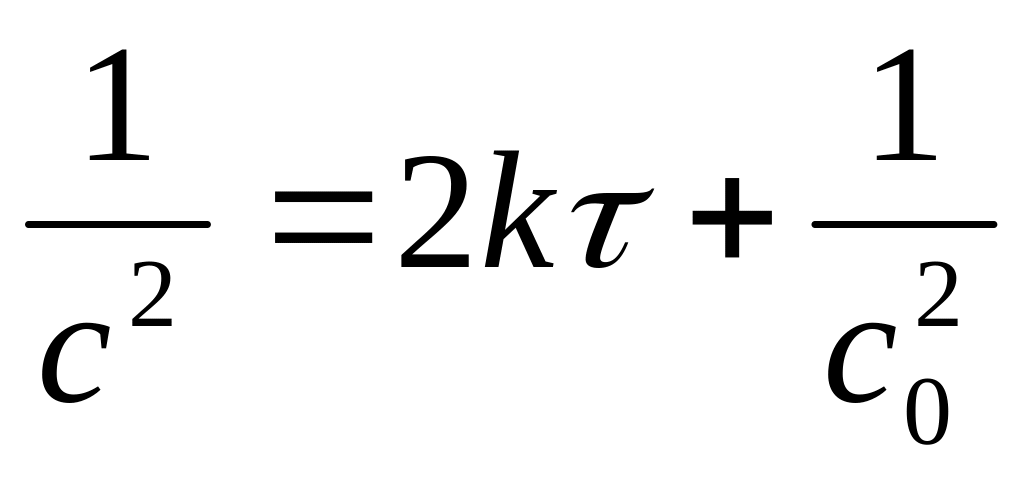 ,
,
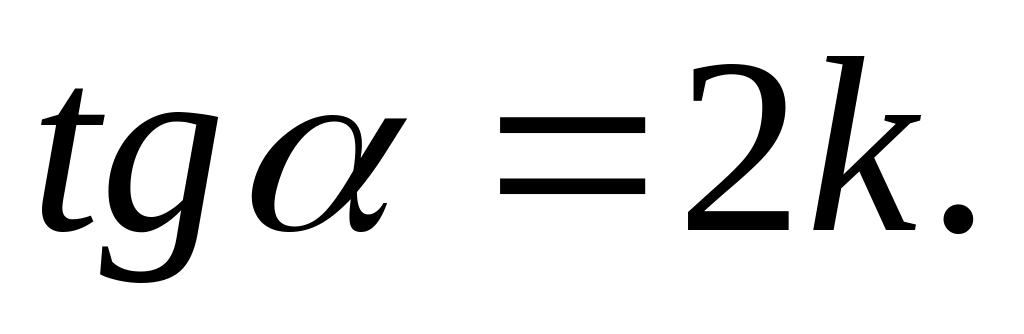
Период полупревращения,



Необратимые реакции нулевого порядка
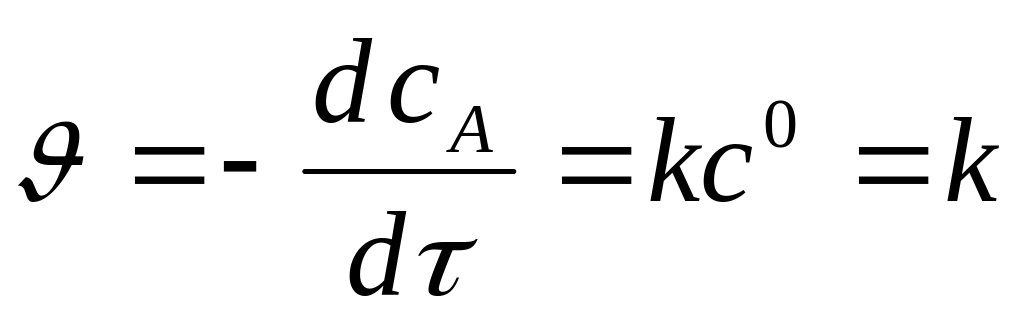
Вывод уравнения:
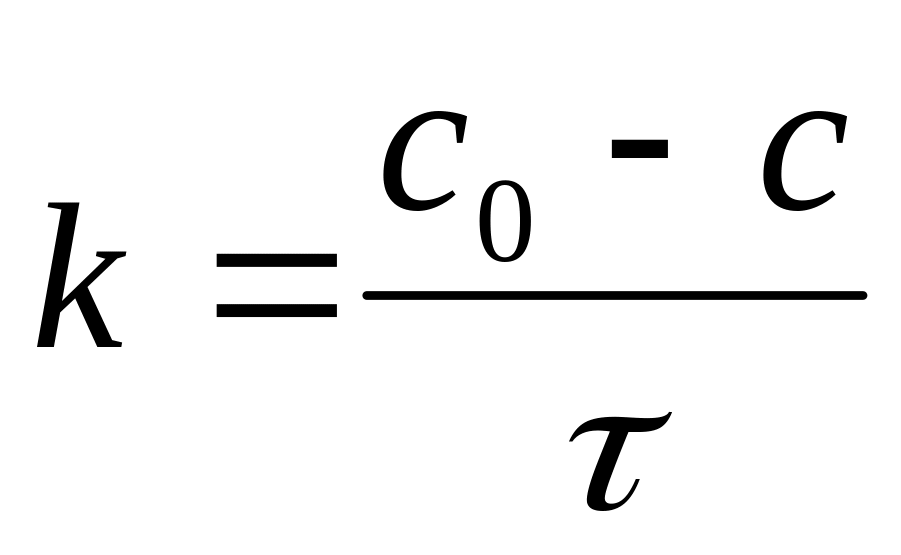 ,
,
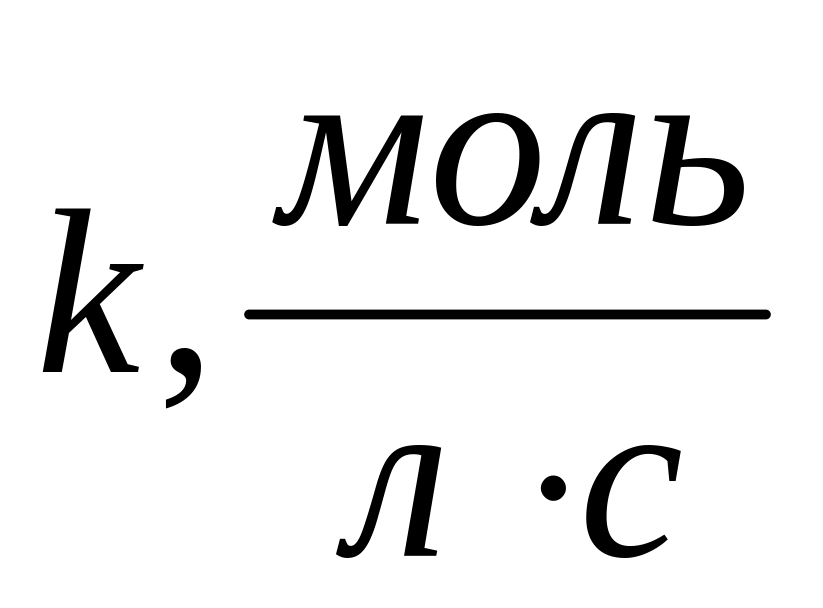
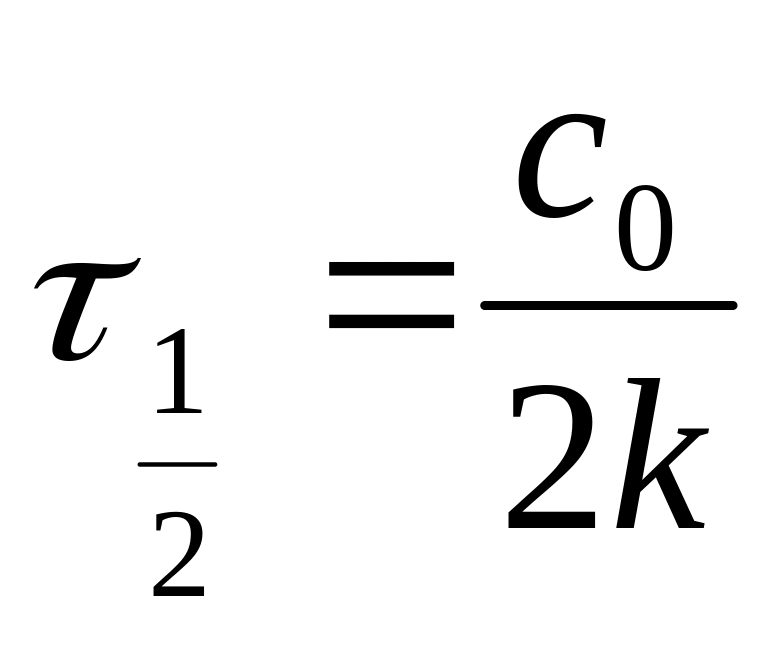
Зависимость
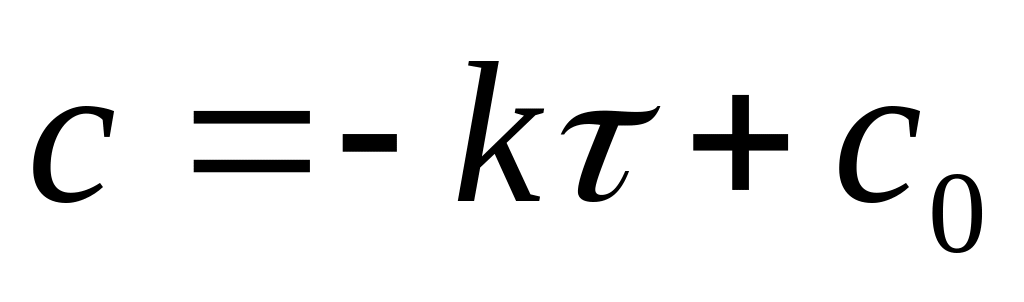 ,
график
,
график
Необратимые реакции nго порядка
1.
![]() ,
,
![]()
2.
Вывод уравнения
![]()
![]() .
.
Реакции дробного порядка
1.
Пример:
![]()
Механизм реакции:
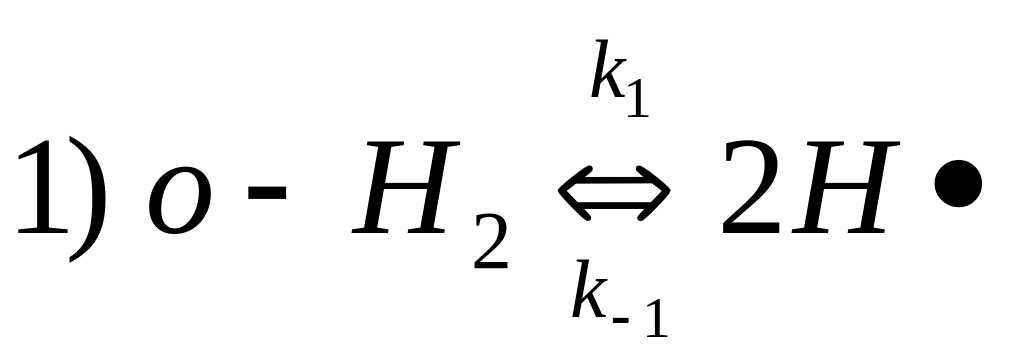
![]()
3.
Скорость реакции:
![]()
![]()
Методы измерения скоростей химических реакций
1.
Суть
метода
:
![]()
2. Химические и физико-химические аналитические методы
а) химические методы определения концентраций реагентов
прямой (непосредственный) метод,
необходимость быстрого анализа – “торможение в пробе”
(“замораживание”, удаление катализатора, разбавление),
б) физико-химические методы (спектральные, электрохимич.,
хроматографические и т.д.)
основаны на регистрации какого-либо физ-хим свойства, которое пропорционально концентрации данного реагента. И далее по калибровочному графику свойство – концент-рация, полученному заранее, определяют концентрацию
достоинство – быстрое измерение
пример - по давлению реакционной смеси
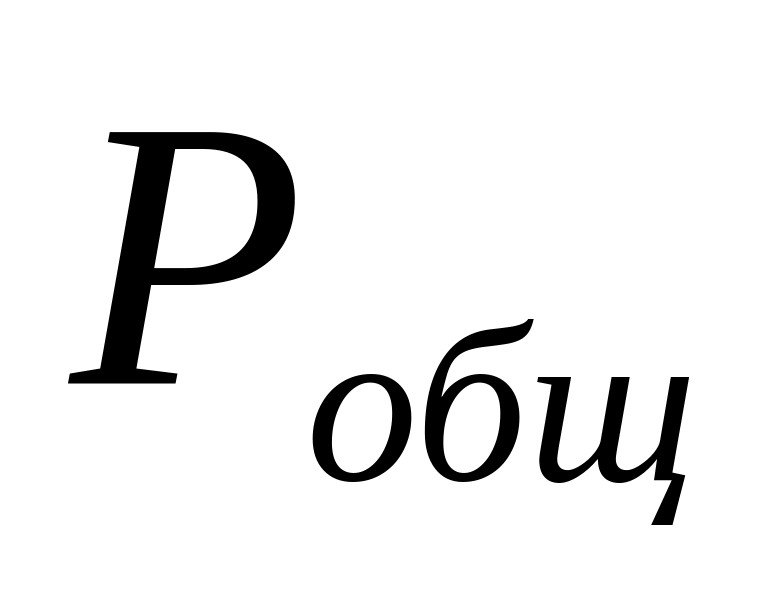
![]()
![]()
![]()
Методы определения порядка реакции
Метод изолирования Оствальда (метод избытка) – общий подход
а) суть – определение частных порядков по каждому веществу при
практическом постоянстве концентраций других реагентов
б)
![]()
определение порядка реакции по реагенту
 :
:
![]()
![]() где
где
![]()
аналогично определяют порядки по
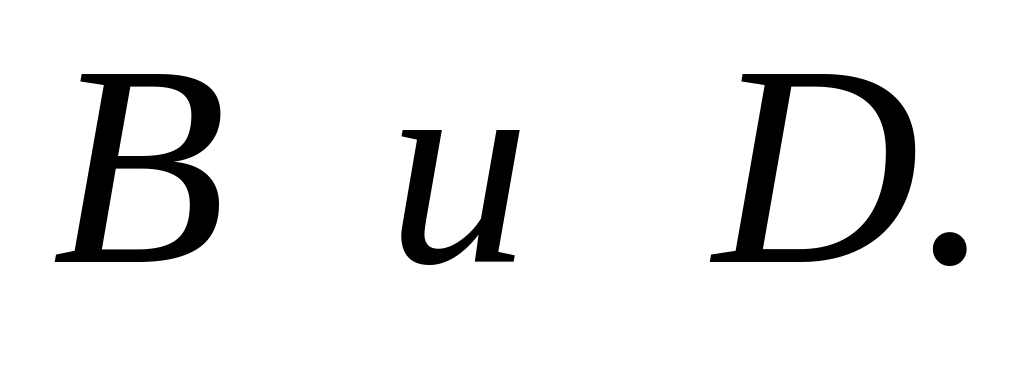
общий порядок: