
- •Основы химической кинетики. Химическое равновесие
- •Реагенты (исходные вещества) переходное состояние продукты реакции
- •Скорость химических реакций
- •Факторы, влияющие на скорость реакции
- •Зависимость скорости реакции от концентрации реагентов
- •Влияние температуры на скорость химической реакции
- •Влияние катализатора на скорость химической реакции
- •Химическое равновесие
- •Константа химического равновесия
- •Смещение химического равновесия
- •Влияние изменения температуры на смещение химического равновесия
- •Влияние изменения концентрации на смещение химического равновесия
- •Влияние изменения давления на смещение химического равновесия
- •Влияние катализатора на смещение химического равновесия
Химическое равновесие
Наряду с практически необратимыми химическими реакциями:
2KClO3 = 2KCl + 3O2 ;
BaCl2 + H2SO4 = BaSO4 + 2HCl и др.
известны многочисленные процессы, когда химическое превращение не доходит до конца, а возникает равновесная смесь всех участников реакции, входящих как в левую, так и в правую часть стехиометрического уравнения реакции. Так, при р = 1 атм и t = 25 С обратимой является система:
2NO2(г) N2O4(г)

а при t = 700-800 С - система:
CO(г) + H2O(пар) CO2(г) + H2(г)
Константа химического равновесия
Рассмотрим особенности протекания обратимых процессов на примере системы, которая в общем виде имеет вид:
aA + bB pP + qQ
при условии, что прямая () и обратная () реакции протекают в одну стадию.
Согласно
закону действия масс скорости прямой
(![]() )
и обратной (
)
и обратной (![]() )
реакций описываются следующими
кинетическими уравнениями:
)
реакций описываются следующими
кинетическими уравнениями:
![]()
![]() ,
,
где
![]() и
и
![]() - константы скорости, соответственно,
прямой и обратной реакций.
- константы скорости, соответственно,
прямой и обратной реакций.
Состояние системы, при котором = , называется динамическим равновесием.
Это равновесие является динамическим (подвижным) поскольку в системе протекает двусторонняя реакция - в прямом (A и B - реагенты, P и Q - продукты) и в обратном (A и B - продукты, P и Q - реагенты) направлениях.
В равновесной системе концентрации всех участников процесса при данных условиях не изменяются, так как в ней постоянно и с одинаковой скоростью протекают прямая и обратная реакции.
Рис. 5. 4. Зависимость
скорости реакции от времени.
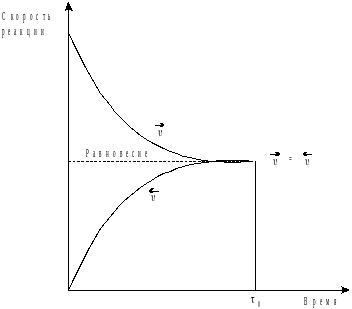
Выведем количественную характеристику химического равновесия.
В состоянии равновесия
= , т.е.
[A]a[B]b = [P]p[Q]q ,
где символами [ ] обозначены молярные концентрации реагентов в момент равновесия, называемые равновесными концентрациями.
Константа
скорости данной реакции при фиксированной
температуре постоянна, поэтому будет
постоянным и отношение
![]() ,
называемое константой
химического равновесия.
,
называемое константой
химического равновесия.
Таким образом, получим:
![]()
где Kc - константа химического равновесия, выраженная через равновесные концентрации участников реакции.
Например, для обратимых систем,
2NO2(г) N2O4(г)
CO(г) + H2O(пар) CO2(г) + H2(г)
выражения констант равновесия имеет вид:
![]() и
и ![]()
Если в процессе химического превращения участвуют две или несколько фаз, то в выражении для константы равновесия следует учитывать только те из них, в которых происходят изменения концентраций реагентов. Например, выражения констант равновесия для систем:
CaCO3(т) CaO(т) + CO2(г)
3Fe(т) + 4H2O(пар) Fe3O4(т) + 4H2(г)
Кс
= [CO2] и 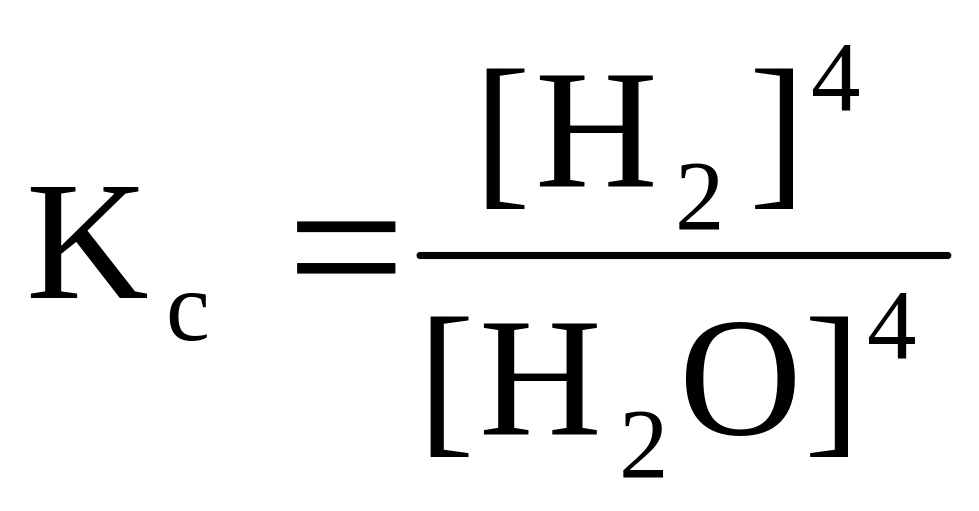 ,
т.е. концентрации
твердого вещества не входят в выражение
константы равновесия.
,
т.е. концентрации
твердого вещества не входят в выражение
константы равновесия.
Смещение химического равновесия
Состояние химического равновесия может продолжаться сколь угодно долго при неизменных условиях. Иногда в практике бывает необходимо сместить равновесие в ту или иную сторону. Этого добиваются изменением условий проведения реакции - температуры, давления, концентрации. Такое изменение равновесных концентраций участников обратимой реакции называется смещением или сдвигом равновесия.
Смещение химического равновесия с изменением условий подчиняется правилу, сформулированному в 1884 году французским физиком А. Ле Шателье (принцип Ле Шателье):

если на систему, находящуюся в состоянии химического равновесия, оказать какое-либо воздействие, т.е. изменить температуру, давление или концентрации реагентов, то равновесие сместится в направлении реакции, противодействующей оказываемому воздействию.
Если далее условия не изменять, то система снова придет в новое состояние равновесия, характеризующееся другими значениями равновесных концентраций участников реакции.
