- •Основы химической кинетики. Химическое равновесие
- •Реагенты (исходные вещества) переходное состояние продукты реакции
- •Скорость химических реакций
- •Факторы, влияющие на скорость реакции
- •Зависимость скорости реакции от концентрации реагентов
- •Влияние температуры на скорость химической реакции
- •Влияние катализатора на скорость химической реакции
- •Химическое равновесие
- •Константа химического равновесия
- •Смещение химического равновесия
- •Влияние изменения температуры на смещение химического равновесия
- •Влияние изменения концентрации на смещение химического равновесия
- •Влияние изменения давления на смещение химического равновесия
- •Влияние катализатора на смещение химического равновесия
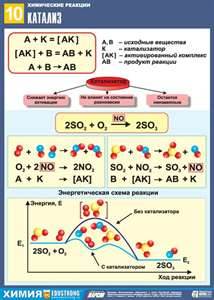
Влияние катализатора на скорость химической реакции
Катализатор - это вещество, которое или резко меняет скорость реакции, или вызывает последнюю, если она не идет, но принципиально возможна, т.е. G < 0.
Сам катализатор (Kat) принимает участие в промежуточных процессах, но регенерируется в конце реакции, т.е. стехиометрически в реакции не участвует. В большинстве случаев катализаторы увеличивают скорость реакции.
Например, самопроизвольное разложение пероксида водорода:
2H2O2 = 2H2O + O2
происходит медленно, но добавление незначительного количества диоксида марганца (MnO2) ускоряет реакцию почти до взрыва. Смесь алюминия и паров иода при комнатных температурах не обнаруживает заметных признаков взаимодействия, но достаточно капли воды, чтобы вызвать бурную реакцию:
Существуют катализаторы, оказывающие противоположный эффект, т.е. замедляющие скорость реакций - ингибиторы.
Они замедляют нежелательные процессы, например, коррозию. Катализаторы отличаются избирательностью (селективностью) действия.
Например, в зависимости от вида катализатора и условий проведения реакции из этилового спирта можно получить до 40 видов различных продуктов.
Огромное практическое значение катализаторов обусловлено возможностью быстро, без затраты энергии получать в больших количествах самые разнообразные вещества. Химические производства, использующие катализаторы, перерабатывают самое дешевое сырье, которое дает природа: природные газы, воздух, руды, нефть, уголь и др., преобразуя их в синтетический каучук и другие полимеры, высококачественные бензины, аммиак, азотную и серную кислоты, минеральные удобрения, органические растворители, красители и многие другие ценные продукты.
Явление селективного ускорения химических реакций под действием катализаторов называется катализом (от греч. katalysis -возбуждение). Различают гомогенный и гетерогенный катализ. При гомогенном катализе реагенты и катализатор образуют одну фазу. Например, присутствие оксида азота (II) сильно ускоряет реакцию:
2SO2 +O2 = 2SO3
в нитрозном способе получения серной кислоты.
В случае гетерогенного катализа реагенты и катализатор образуют несколько фаз.
Этот вид катализа происходит на границе раздела фаз - обычно на поверхности раздела между твердой и жидкой или твердой и газовой фазами.
Например, синтез аммиака из азота и водорода удалось осуществить с помощью катализатора, представляющего собой смесь металлического железа с добавками оксида калия и алюминия.
N2
+ 3H2
![]() 2NH3
2NH3
Крекинг нефти осуществляется на катализаторах, напоминающих обычную глину.
Гидрирование растительного масла протекает на никелевом катализаторе (никель на кизельгуре).
Влияние
катализатора на снижение барьера
активации.
Ек
- снижение энергии активации прямой и
обратной реакций в присутствии
катализатора.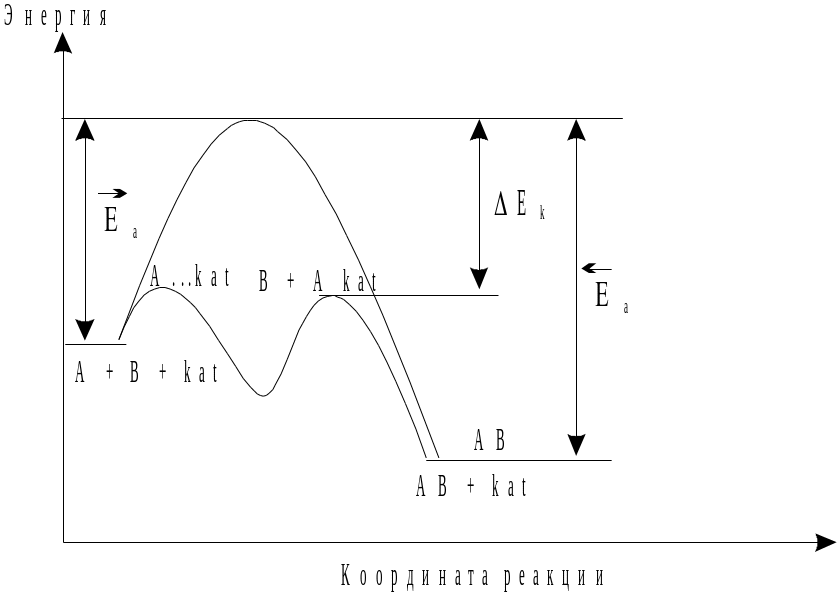
![]() и
и
![]() - энергии активации прямой и обратной
реакций без катализатора.
- энергии активации прямой и обратной
реакций без катализатора.