
- •Основы химической кинетики. Химическое равновесие
- •Реагенты (исходные вещества) переходное состояние продукты реакции
- •Скорость химических реакций
- •Факторы, влияющие на скорость реакции
- •Зависимость скорости реакции от концентрации реагентов
- •Влияние температуры на скорость химической реакции
- •Влияние катализатора на скорость химической реакции
- •Химическое равновесие
- •Константа химического равновесия
- •Смещение химического равновесия
- •Влияние изменения температуры на смещение химического равновесия
- •Влияние изменения концентрации на смещение химического равновесия
- •Влияние изменения давления на смещение химического равновесия
- •Влияние катализатора на смещение химического равновесия
Факторы, влияющие на скорость реакции
Скорость реакции зависит от многих причин.
На нее влияют: а) природа реагентов и б) условия проведения процесса: концентрация реагентов, давление (для реакций с участием газов), температура, катализатор, примеси и их концентрации, среда (для реакций в растворах), форма реакционного сосуда (в цепных реакциях), интенсивность света (в фотохимических реакциях), мощность дозы излучения (в радиационно-химических процессах) и др.
Основными факторами, которые приходится учитывать во всех процессах, являются концентрации (давления) реагентов, температура и действие катализатора.
Зависимость скорости реакции от концентрации реагентов
Как правило, увеличение концентрации или давления (для реакций с участием газов) реагентов приводит к повышению скорости реакции. Количественно зависимость скорости реакции от концентрации реагентов определяется законом действующих масс (З.Д.М.):
Скорость простой гомогенной реакции, протекающей в одну стадию при постоянной температуре, прямо пропорциональна произведению молярных концентраций реагентов в степенях, равных стехиометрическим коэффициентам.
Этот закон был сформулирован норвежскими исследователями К.М. Гульдбергом и М.П. Вааге в 1864-1867 г.г. и независимо от них - русским ученым Н.Н. Бекетовым в 1865 г.
|
|
|
Бекетов Николай Николаевич
Русский химик. Один из основоположников физической химии. Выдвинул (1865) ряд теоретических положений о зависимости направления реакций от состояния реагентов и внешних условий |
Вааге Петер Норвежский физикохимик и минералог. Основные научные работы относятся к химической кинетике и термодинамике |
Гульдберг Като Максимилиан
Норвежский физикохимик и математик. Совместно с П.Вааге открыл (1864–1867) закон действующих масс и исследовал условия равновесия |
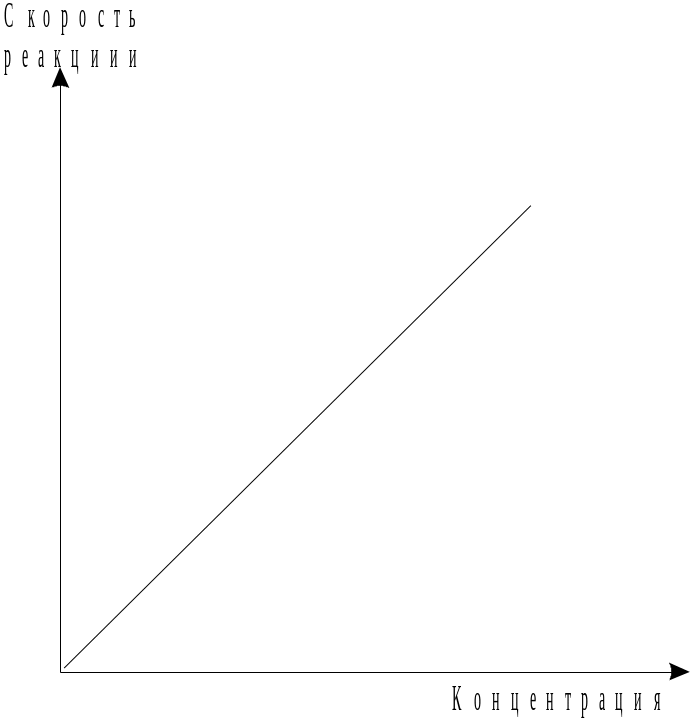
Графически зависимость скорости простой реакции, протекающей в одну стадию, от концентрации показана на рис.
Рис.
5. 2. Зависимость скорости простой реакции
от концентрации.
aA + bB = pP,
скорость реакции выражается уравнением:
![]() ,
,
где k - константа скорости реакции.
k - важная справочная величина, зависящая от природы реагентов и температуры, но не зависящая от концентрации.
При с(A) = с(B) = 1моль/л или (с(A))a(c(B))b = 1(моль/л) k равна скорости химической реакции.
По физическому смыслу константа скорости реакции является мерой реакционной способности реагентов при данной температуре.
Следует отметить, что З.Д.М. в полной мере применим лишь только к простейшим гомофазным реакциям. Если реакция протекает в несколько стадий, З.Д.М. справедлив для каждой из них, а скорость сложных химических процессов определяется скоростью наиболее медленно протекающей реакции, которая является лимитирующей стадией всего процесса.



