
- •Глава 1. Строение атома. Периодическая система и Периодический закон д.И.Менделеева.
- •1.1. Модель атома по Резерфорду. Постулаты Бора.
- •1.2. Корпускулярно-волновые свойства микромира.
- •Квантовые числа
- •1.3. Электронные оболочки атомов.
- •1.4. Периодическая система элементов д.И.Менделеева.
- •1.5. Периодичность свойств элементов
- •Глава 2. Химическая связь.
- •2.1. Общие положения.
- •2.2. Метод валентных связей
- •2.3. Метод молекулярных орбиталей
- •Глава 3. Основы химической термодинамики.
- •3.1. Основные определения.
- •3.2. Первый закон (начало) термодинамики. Энтальпия системы.
- •3.3. Закон Гесса
- •3.4.Второй закон (начало) термодинамики
- •3.5. Свободная энергия Гиббса
- •3.6. Химический потенциал
- •Глава 4. Основы кинетики. Химическое равновесие.
- •4.1. Скорость химической реакции.
- •4.2. Факторы, влияющие на скорость химической реакции
- •4.3. Химическое равновесие.
- •Глава 4. Основы кинетики. Химическое равновесие.
- •4.1. Скорость химической реакции.
- •4.2. Факторы, влияющие на скорость химической реакции
- •4.3. Химическое равновесие.
- •Глава 5. Растворы.
- •5.1. Общая характеристика и классификация растворов.
- •5.2. Растворение как физико-химический процесс
- •5.3. Растворимость
- •5.4. Способы выражения концентрации растворов
- •5.5.Коллигативные свойства растворов.
- •I закон Рауля
- •II закон Рауля
- •Осмос. Осмотическое давление.
- •5.6. Растворы электролитов. Электролитическая диссоциация.
- •Степень электролитической диссоциации
- •5.7. Основы теории растворов сильных электролитов
- •5.8. Электролитическая диссоциация воды.
- •5.9. Амфотерные гидроксиды.
- •5.10. Протолитические реакции.
- •5.11. Произведение растворимости.
- •Глава 6. Электрохимия металлов
- •Зависимость электродного потенциала от концентрации веществ выражается уравнением Нернста:
- •6.2.1. Катодные процессы
- •6.2.2. Анодные процессы При рассмотрении анодных процессов следует различать электролиз с инертным анодом и электролиз с активным анодом, т.Е. Материал которого может окисляться.
- •6.2.3. Законы электролиза
- •6.3. Коррозия металлов
- •6.3.1. Пассивное состояние металлов
- •6.3.2. Классификация методов защиты от коррозии
3.3. Закон Гесса
В 1836 г. русский академик Герман Иванович Гесс опытным путем установил основной закон термохимии.
Тепловой эффект химической реакции зависит только от начального и конечного состояния системы и не зависит от пути перехода системы из начального состояния в конечное.
Проиллюстрируем закон на примерах.
1)Тепловой эффект реакции зависит от начального и конечного состояния системы.
Н2 + ½ О2 = Н2О(газ), ∆Н1=-241,8 кДж/моль
Н2 + ½ О2 = Н2О(ж), ∆Н2=-285,8 кДж/моль
∆Н1 ≠ ∆Н2
2)Тепловой эффект реакции не зависит от пути её протекания.
С + О2 = СО2, ∆Н=-393,5 кДж/моль
С + ½ О2 = СО, ∆Н1=-110,5 кДж/моль
СО + ½ О2 = СО2, ∆Н2=-283,0 кДж/моль
∆Н = ∆Н1 + ∆Н2
Следствия из закона Гесса:
1. Тепловой эффект прямой реакции равен тепловому эффекту обратной реакции, взятому с обратным знаком.
2.Если в результате ряда последовательных реакций система переходит в состояние, полностью совпадающее с исходным, то сумма тепловых эффектов этого ряда реакций равна нулю.
А → В ∆Н1
В → С ∆Н2
С → А ∆Н3
∆Н1 + ∆Н2 + ∆Н3 = 0.
3.Тепловой эффект реакции равен разности между суммой стандартных энтальпий образования продуктов реакции и суммой стандартных энтальпий образования исходных веществ с учетом коэффициентов реакции.
aA + bB = cC + dD, ∆Н
∆Н = (c∆Н0298(C) +d∆Н0298(D)) – (a∆Н0298(A) - b∆Н0298(B)).
По этой формуле можно рассчитывать тепловые эффекты любых реакций.
Задача 1. Вычислить теплоту сгорания этилового спирта.
Решение. Уравнение реакции горения этилового спирта имеет вид:
С2Н5ОН(ж) + 3 О2 = 2 СО2 + 3 Н2О(газ), ∆Н=?
∆Н = (2 ∆Н0298(СО2) + ∆Н0298(Н2О(газ))) - ∆Н0298(С2Н5ОН(ж));
∆Н = 2(-393,51) + 3(-241,84) – (-277,63) = -1234,91 кДж/моль.
3.4.Второй закон (начало) термодинамики
Ограниченность первого начала термодинамики заключается в том, что оно не определяет направления обмена тепловой энергией между телами. Первое начало не запрещает переход тепла от менее нагретого тела к более нагретому. Суть второго начала состоит в том, что оно определяет направление самопроизвольного протекания процессов, в том числе и химических реакций.
Самопроизвольным называется процесс, который протекает самостоятельно без воздействия внешних факторов. Например, если соединить два сосуда — заполненный газом и пустой, то газ самопроизвольно заполнит весь объем. Взаимодействие металлического натрия с водой при н.у. также происходит самопроизвольно. Обратные процессы можно осуществить, оказав внешнее воздействие. Для исследователя необходимо иметь критерий, с помощью которого можно было бы предсказать направление самопроизвольного протекания процесса.
Существует еще одна функция состояния, которая с учетом первого начала термодинамики позволяет предсказать направление протекания процесса в изолированных системах. Такой функцией состояния является энтропия (S).
Интерпретировать энтропию можно как с точки зрения макроскопического состояния системы, так и с точки зрения микроскопического.
Определение энтропии с позиций классической термодинамики.
Если рассматривать систему в целом, то в обратимом процессе, протекающем при постоянной температуре, изменение энтропии будет равно:
∆S = Qобр/Т
Для необратимого процесса это равенство превращается в неравенство:
∆S > Qнеобр/Т
Поскольку энтропия является функцией состояния, то ее изменение не зависит от пути перехода системы из одного состояния в другое, а определяется только значениями энтропии системы в исходном и конечном состояниях:
∆S = ∑∆S0298(конечн.прод.) - ∑∆S0298(исходн.вещ-в).
Размерность энтропии [S] = Дж/моль·К.
Существует много формулировок второго начала термодинамики. Приведем одну из них.
В изолированной системе самопроизвольно протекают только те
процессы, которые сопровождаются увеличением энтропии.
В самопроизвольном процессе ∆S> 0;
в равновесном процессе ∆S = 0;
в не самопроизвольном процессе ∆S< 0.
Статистическая интерпретация понятия энтропии
Больцман вывел соотношение, связывающее абсолютную энтропию с числом микроскопических состояний системы, соответствующих данному макроскопическому состоянию (или термодинамической вероятностью):
S = k· lnW, (3.4)
где k = R/NА = 1,38· 10-23 Дж К-1 - постоянная Больцмана,
W — число микроскопических состояний системы.
Макроскопическое состояние включает в себя множество микроскопических состояний. Их число для различных систем может подсчитываться по-разному. По Больцману макроскопическое состояние определяется количеством частиц на каждом энергетическом уровне. Частицы имеют свой номер, а полная энергия системы постоянна. Микроскопические состояния отличаются друг от друга распределением частиц по уровням энергий. Например, система из трех молекул, которые располагаются на трёх энергетических уровнях, а полная энергия системы равна пяти условным единицам, описывается двумя макроскопическими состояниями:

Каждому из них соответствуют по три микроскопических состояния (W1=3, W2=3):
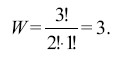
В термодинамике мы имеем дело с системами, состоящими из огромного числа частиц, с множеством макросостояний с различными W.
Из формулировки второго начала термодинамики следует, что в изолированной системе при самопроизвольном процессе энтропия возрастает. Система будет самопроизвольно стремиться к макросостоянию с максимальным W. Отсюда энтропию можно рассматривать как меру хаоса системы.
Значение энтропии для простых веществ не равно нулю. С повышением температуры энтропия всегда возрастает. Возрастает она в процессах плавления, испарения, сублимации и уменьшается в процессах конденсации и кристаллизации. Энтропия возрастает при увеличении числа молекул газообразных веществ и понижается при их уменьшении.
При абсолютной температуре T = 0 К чистые химические вещества образуют идеальные кристаллы, и их состояние можно описать только одним способом (W = 1), а логарифм единицы равен нулю. Согласно выражению (3.4.), и энтропия при этой температуре равна нулю. Пользуясь этим, можно сформулировать третье начало термодинамики как:
Энтропия веществ при абсолютном нуле равна нулю.
Таким образом, энтропия является единственной функцией состояния, для которой можно рассчитать абсолютное значение.
