
- •Блок-схема раздела
- •«Химическая термодинамика»
- •3.1. Теоретическая часть
- •3.2. Общие положения
- •3.3. Экспериментальная часть
- •3.3.1. Методика выполнения экспериментов по измерению теплового эффекта реакции нейтрализации соляной кислоты
- •I. Стеклянный сосуд – калориметр для измерения теплового эффекта:
- •II. Прибор с электронным термометром:
- •Масса соли в молях рассчитывается по уравнению реакции
- •Задание по вариантам
- •Опыт 3.3.2. Калибровка калориметра по данным
- •Опыт 3.3.3. Определение водного эквивалента калориметра
- •Опыт 3.3.4. Определение теплоты разложения перекиси водорода
- •Опыт 3.3.5. Оценка энтропии растворения соли
3.2. Общие положения
3.2.1. Измерение тепловых эффектов. Для измерения тепловых эффектов используют калориметры. Теплоту, выделяемую или поглощаемую в калориметре, вычисляют по формуле
![]() (3.15)
(3.15)
где c1, c2 – удельные теплоемкости веществ, Дж/г·К; m1, m2 – массы веществ, г; k – постоянная калориметра, Дж/К; T2 ,T1 – конечная и начальная температуры.
На рис. 3.2 представлен калориметр для измерения теплового эффекта. Прослойка воздуха между реакционным сосудом и термо-статом служит изоляцией от окружающей атмосферы.
3.2.2. Измерение температуры. Измерение температуры в про-цессе химической реакции осуществляется с помощью термометров. Относительное изменение температуры с точностью до 0,001 градуса можно определить с помощью термометра Бекмана. Подготовку термометра к измерению осуществляет лаборант. При измерении теплового эффекта экзотермических реакций, например, реакции нейтрализации, где температура в реакционном сосуде повышается, уровень ртути в термометре Бекмана должен находиться в нижней части шкалы, а для эндотермических реакций (при изучении теплоты растворения солей NaCl, KBr, KI) – в верхней части шкалы.
В некоторых опытах для измерения температуры используется обычный термометр с точностью до 0,1 градуса.
3.3. Экспериментальная часть
3.3.1. Методика выполнения экспериментов по измерению теплового эффекта реакции нейтрализации соляной кислоты
Выполнение опыта осуществляется с использованием электронного термометра и калориметра (рис.3.2).
I
II
1
2
3
4
5
3”
1”
4”
2”
5”
6”
Рис. 3.2. Схема электронного термометра:
I. Стеклянный сосуд – калориметр для измерения теплового эффекта:
1 – мешалка; 2 – электронный термометр; 3 – боковой патрубок; 4 – широкая пробирка – реакционный сосуд; 5 – стеклянный сосуд с большим диаметром, закрытый плексигласовой крышкой.
II. Прибор с электронным термометром:
1”– термодатчик; 2”– контроллер; 3” – гнездо для подключения термодатчика; 4”– жидкокристаллическое табло (ЖК); 5”– кнопка включения (0 – выключено, 1 – включено); 6”– гнездо для подключения сетевого шнура (220 В)
Штекер модуля термодатчика (1) подключается к контроллеру (2) в гнездо (3). Сетевой шнур включается в гнездо (6) и подклю-чается к розетке. Прибор готов к работе.
В реакционный сосуд калориметра заливается 50 мл раствора щелочи (концентрацию указывает преподаватель), после этого термодатчик помещают в реакционный сосуд калориметра и кнопкой (5) включают прибор, переводя её в положение (1), при этом на ЖК дисплее появляется индикация, в первой строке высвечивается время – секунды, во второй температура – градусы Цельсия.
На первом этапе проводят измерения через каждые 30 с, всего 1-16 измерений в течение 6-8 минут.
Второй этап. По истечении этого времени в калориметр, через боковой отвод с помощью воронки заливается раствор соляной кислоты НСl (объем и концентрацию указывает преподаватель согласно варианту из табл.3.1). После введения соляной кислоты в калориметр и перемешивания, в течение 2-3 мин., через каждые 10 с записывают показания температуры на ЖК табло. Всего производят 12–18 измерений.
Т а б л и ц а 3.1
Вариант |
Щелочь (NaOH) |
Кислота (HCl) |
||
|
Объем |
с, моль/л |
Объем |
с, моль/л |
1 |
50 |
0,04 |
10 |
0,2 |
2 |
50 |
0,04 |
9 |
0,2 |
3 |
50 |
0,04 |
8 |
0,2 |
4 |
50 |
0,04 |
7 |
0,2 |
Третий этап. Запись температуры начинают производить снова через 30 с в течение 6-8 мин (12-16 измерений).
В конце работы необходимо выключить прибор кнопкой (5), переводя её в положение «0». Индикация на ЖК дисплее пропадает примерно через 3-4 с.
После этого разбирают калориметр: промывают реакционный сосуд и термодатчик.
Для расчета теплоты реакции нейтрализации постоянную калориметра берут:
- при работе с термометром Бекмана k = 50 Дж/К;
- при работе с электронным термометром k = 25 Дж/К.
Для точного определения разности температур в результате химического превращения строят на миллиметровой бумаге график зависимости температуры от времени. На оси абсцисс откладывают время, на оси ординат – температуру (рис. 3.3).
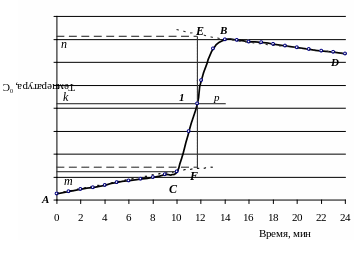
Рис. 3.3. График зависимости температуры от времени
Из графика находят изменение температуры t. Для этого точки В и С проектируют на ось ординат, находят середину отрезка mn и проводят линию kp. Через точку l проводят вертикаль. Экстраполируют линейные участки АС и BD (пунктирные линии на рисунке) до пересечения с вертикалью в точках Е и F. Отрезок EF соответствует изменению температуры в калориметрическом опыте t с учетом поправки на теплообмен.
3.3.2. Расчет
теплового эффекта реакции нейтрализации.
У преподавателя
узнайте постоянную калориметра – k.
Для расчета Qнейтр.
по формуле (3.16), считается, что сNaCl
= 4,103 Дж/г·К,
![]() = = 4,185 Дж/г·К.
= = 4,185 Дж/г·К.
Qнейтр.
= (
·![]() + сNaCl·mHCl
+ k)ΔT.
(3.16)
+ сNaCl·mHCl
+ k)ΔT.
(3.16)
