- •Санкт-Петербургский государственный университет Химический факультет Кафедра электрохимии Методические указания по практической работе
- •Санкт-Петербург
- •Вольтамперометрия с линейной разверткой потенциала.
- •Экспериментальная часть Лабораторная работа "Исследование электрохимического поведения обратимой и необратимой редокс-систем методом циклическая вольтамперометрии с линейной разверткой потенциала".
- •Литература по теме

Санкт-Петербургский государственный университет Химический факультет Кафедра электрохимии Методические указания по практической работе
"Циклическая вольтамперометрия с линейной
разверткой потенциала".
Санкт-Петербург
2003
Вольтамперометрия с линейной разверткой потенциала.
Т
Рис.1
Схематичное представление линейной
развертки потенциала.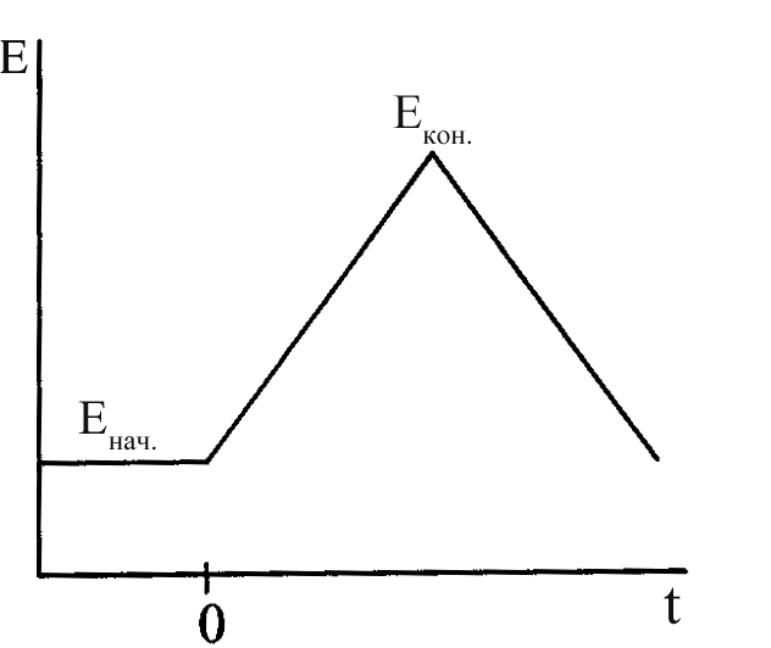
Начальный потенциал обычно выбирается таким, чтобы компоненты изучаемой редокс-системы не окислялись или не восстанавливались на электроде. Протекающий на рабочем электроде ток регистрируется в зависимости от линейно изменяющегося потенциала, и результирующая вольтамперная кривая имеет вид пика, высота которого и положение по шкале потенциалов являются характеристичными параметрами.
По
аппаратурному оформлению вольтамперометрия
с линейной
разверткой потенциала похожа на
классические варианты вольтамперометрии,
отличие лишь в скоростях развертки
потенциала. Например, для снятия обычных
стационарных или квази-стационарных
вольтамперных кривых на металлических
электродах,, находящихся в растворах
электролитов, используется медленная
развертка потенциала: обычно 0,5-2 мВ/с,
а в случае циклической вольтамперометрии
скорости развертки на порядок выше.
Использование многократных повторяющихся
циклов линейной развертки потенциала
между заданными значениями начального
и конечного потенциала
рабочего электрода и
регистрацией прямого и обратного хода
кривой в одном цикле измерений используется
в разновидности этого метода - циклической
вольтамперометрии. Общий
вид циклической вольтамперной кривой
для случая обратимого протекания
электрохимического
процесса при наличии диффузионных
ограничений по п
Рис.
2
Циклическая
вольтамперограмма.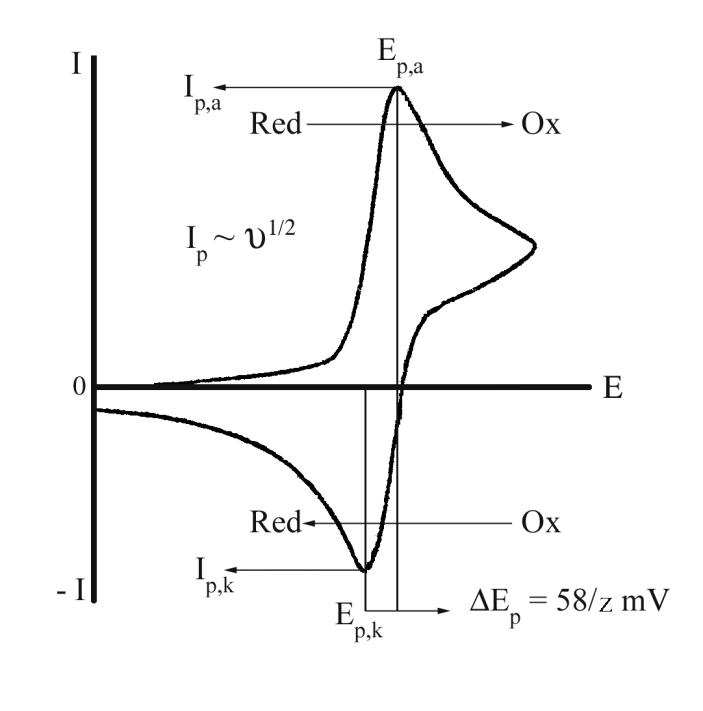
Теория вольтамперометрии с линейной разверткой потенциала была предложена для обратимых процессов в условиях линейной полубесконечной диффузии Шевчиком и Рэндлсом независимо друг от друга. Далее их выводы были подтверждены и расширены другими исследователями, а также распространены на необратимые и другие более сложные процессы. Строгий вывод уравнений вольтамперных кривых для случая линейной развертки потенциала представляет собой трудную задачу, аналитического решения не было получено, поэтому были использованы математические приемы численного и графического решения. Остановимся лишь на основных моментах математического описания таких процессов.
Примем , что изменение потенциала во времени в методе ЦВА происходит по линейному закону:
E = Eнач. + t (1)
где Енач. начальный потенциал, скорость развертки потенциала.
Для случая процесса электровосстановления вида:
Ox +ze= Red (2)
в условиях, когда на электроде присутствует только окисленная форма вещества Ох справедливы следующие начальные условия:
СOx (, t) СoOx
СOx (x, 0) = СoOx
СRed (, t) 0
СRed (x, 0) = 0
Уравнения нестационарной диффузии для окисленной и восстановленной формы имеют вид:
![]() (3)
(3)
![]() (4)
(4)
Граничные условия для решения уравнений 2-го закона Фика для нестационарной диффузии Ox и Red компонентов могут быть определены следующим образом:
Первое граничное условие получают из уравнения Нернста для обратимой системы на поверхности электрода:
![]() (5)
(5)
Второе – из условия, что потоки диффузии окисленной и восстановленной форм у поверхности электрода при t>0 равны по величине, противоположны по знаку и определяют величину тока
![]() (6)
(6)
Эта задача была решена с использованием преобразования Лапласа. Для кривой ток-потенциал получено выражение в следующем виде:
![]() (7)
(7)
З
Рис.
3 Пояснения
в тексте.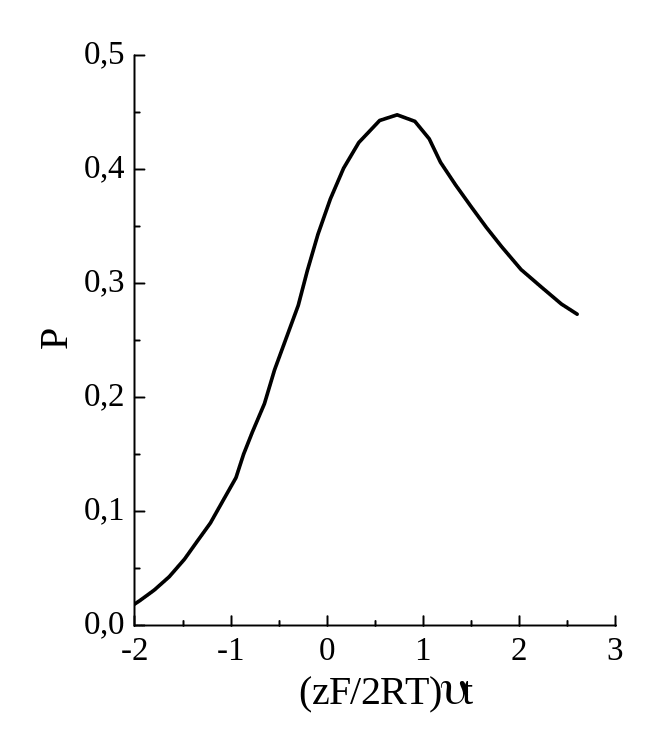
Максимальное
значение функции
![]() равно 0,4463. Вольтамперограммы I - E
повторяют вид этой функции, и максимальный
ток описывается уравнением:
равно 0,4463. Вольтамперограммы I - E
повторяют вид этой функции, и максимальный
ток описывается уравнением:
![]() (8)
(8)
или при численном выражении основных констант
![]() (9)
(9)
Потенциал пика обратимого электродного процесса Еp,k связан с формальным потенциалом системы Е0 соотношением:
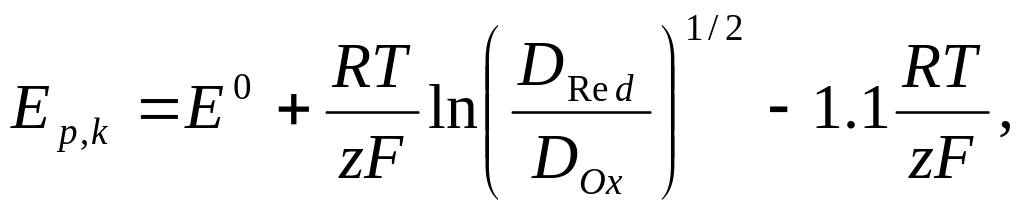 (10)
(10)
а для случая анодного процесса
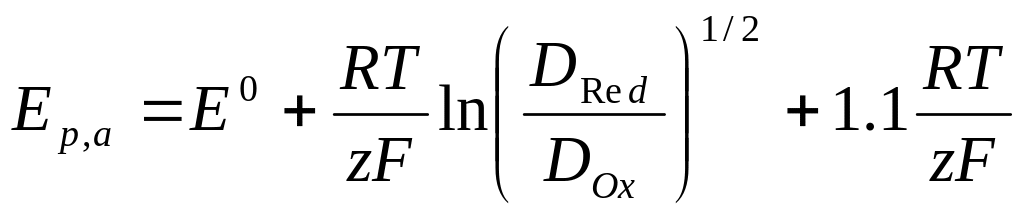 (11)
(11)
Поскольку, как известно из полярографии , величина потенциала полуволны дается выражением:
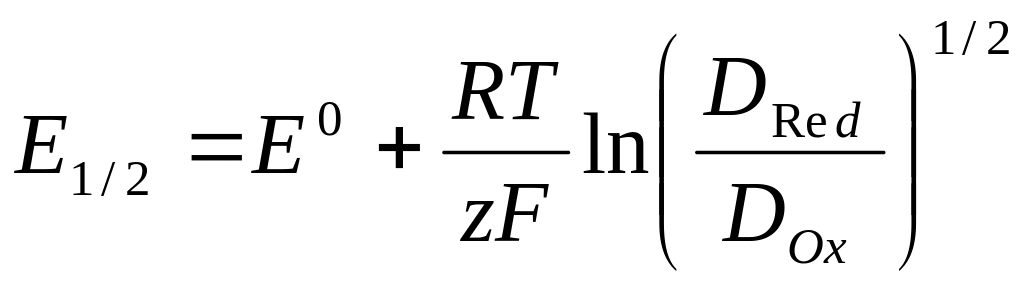 (12)
(12)
то из уравнений 10-11 получаем:
![]() (13)
(13)
![]() (14)
(14)
Соответственно, разность потенциалов катодного и анодного процессов для обратимого процесса будет равна
![]() (15)
(15)
Иногда
используют другой удобный критерий для
анализа степени обратимости
процесса: величина
![]() также
должна быть равна 0.056/z
для обратимого процесса. Как видно из
уравнения (8), ток пика должен
быть пропорционален концентрации
восстанавливающегося вещества
и квадратному корню из скорости развертки
потенциала. Линейное соотношение
между током пика и концентрацией вещества
можно использовать
для электроаналитических определений.
Положение пика по шкале
потенциалов характеризует природу
реагирующего вещества и не зависит
от его концентрации, в то время как
высота пика позволяет судить о концентрации
вещества. Чувствительность определений
возрастает пропорционально
корню квадратному из скорости развертки
потенциала, ,
и числу
электронов, участвующих в электродной
реакции в степени 3/2.
также
должна быть равна 0.056/z
для обратимого процесса. Как видно из
уравнения (8), ток пика должен
быть пропорционален концентрации
восстанавливающегося вещества
и квадратному корню из скорости развертки
потенциала. Линейное соотношение
между током пика и концентрацией вещества
можно использовать
для электроаналитических определений.
Положение пика по шкале
потенциалов характеризует природу
реагирующего вещества и не зависит
от его концентрации, в то время как
высота пика позволяет судить о концентрации
вещества. Чувствительность определений
возрастает пропорционально
корню квадратному из скорости развертки
потенциала, ,
и числу
электронов, участвующих в электродной
реакции в степени 3/2.
Нижний предел обнаружения в случае прямого определения методом ЦВА будет зависеть от соотношения между фарадеевским и емкостным токами. Ток заряжения будет описываться уравнением
![]() (16)
(16)
где С - удельная емкость двойного электрического слоя, то есть емкостной ток растет пропорционально скорости развертки и при увеличении скорости развертки доля его в общем регистрируемом токе будет возрастать, а доля полезного сигнала фарадеевского тока будет, соответственно, падать. Сравнивая величины фарадеевской и емкостной составляющей тока для обратимой реакции на электроде получим:
![]() (17)
(17)
т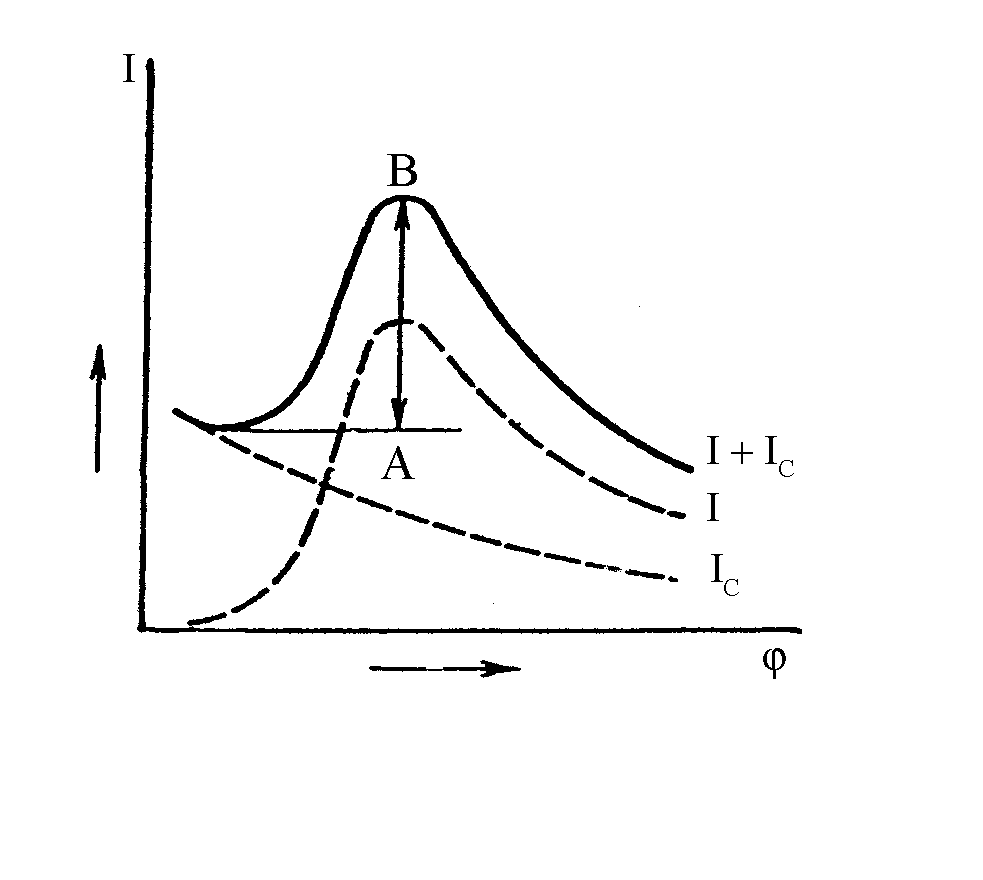 .е.
влияние емкостной составляющей возрастает
с уменьшением концентрации
и числа участвующих в электрохимической
стадии электронов. Дополнительные
осложнения вызывает зависимость емкости
ДЭС от потенциала,
что приводит к изменению емкостного
тока при развертке потенциала
и уменьшению высоты измеряемого пика.
.е.
влияние емкостной составляющей возрастает
с уменьшением концентрации
и числа участвующих в электрохимической
стадии электронов. Дополнительные
осложнения вызывает зависимость емкости
ДЭС от потенциала,
что приводит к изменению емкостного
тока при развертке потенциала
и уменьшению высоты измеряемого пика.
О
Рис.
4 Пояснения
в тексте.
Для случая необратимого протекания реакции (2) изменение концентрации вещества у поверхности электрода также будет описываться уравнениями второго закона Фика, которые уже решаются для других граничных условий, а именно, диффузионный ток на поверхности электрода при х=0 и t > 0 связан со скоростью процесса переноса заряда соотношением:
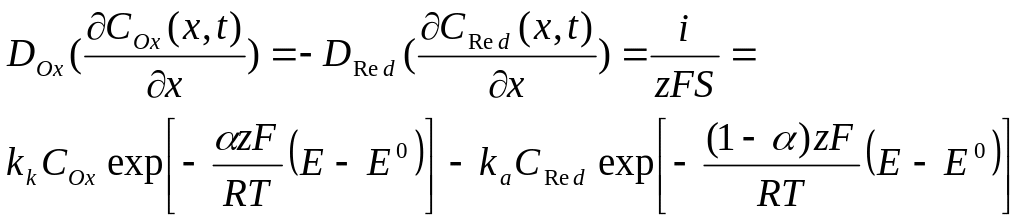 (18)
(18)
Для полностью необратимого процесса конечное решение системы уравнений приводит к следующему виду уравнения для вольтамперной кривой:
![]() (19)
(19)
где - коэффициент переноса заряда, z - число электронов, участвующих в скорость определяющей стадии переноса заряда. Графически, вид функции Р от t по форме совпадает для случая обратимых и необратимых систем, а ее максимум наблюдается при 0,4958. Таким образом, для пикового тока получается выражение:
![]() (20)
(20)
или с учетом основных констант в числовом выражении:
![]() (21)
(21)
Потенциал пика не зависит от концентрации реагирующего вещества, но является сложной функцией параметров электрохимической стадии ks, , z и скорости развертки . Для потенциала пика получено выражение
 (22)
(22)
а для разности Ep,k - Ep,a получается некоторая величина, являющаяся функцией ks и . Для данной скорости развертки чем меньше ks, тем больше разность потенциалов между пиками. При данной величине гетерогенной константы скорости ks разность между потенциалами катодного и анодного пиков увеличивается с увеличением скорости развертки потенциала. При z = zα =1 соотношение токов пиков Jp,необр /Jp,обр= 1,11 α1/2.
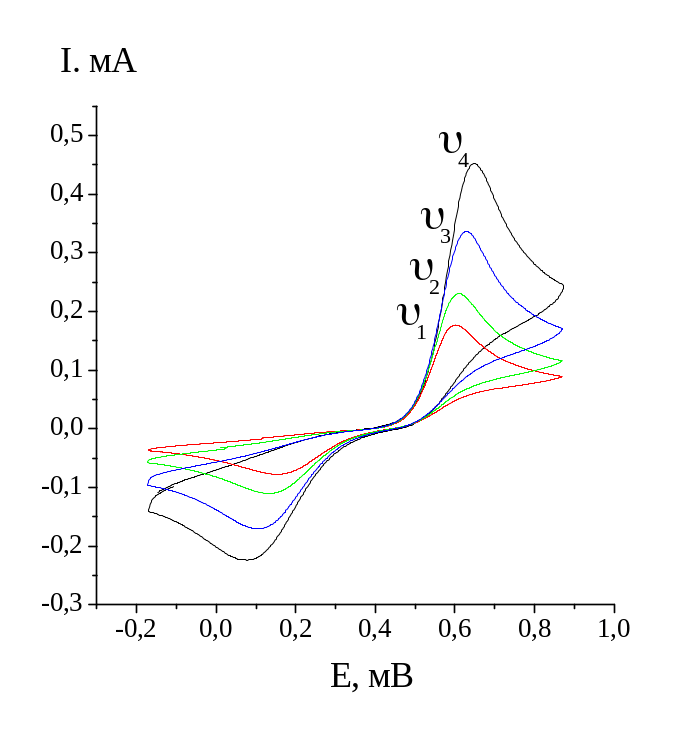
На рис.5 это показано схематически для разных скоростей развертки потенциала.
Рис.
5 Зависимость
вольтамперометрического отклика
системы хинон-гидрохинон для различных
скоростей развертки.