
- •Основные законы химии
- •Моль. Молярная масса
- •Относительная атомная и молекулярная массы
- •Газовые законы
- •1. Закон о суммарном давлении смеси газов: давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений газов, составляющих смесь
- •Закон эквивалентов
- •Периодический закон и периодическая система химических элементов д. И. Менделеева
- •Строение атома
- •Модели Томсона и Резерфорда
- •Закон Мозли
- •Электронная оболочка атомов по Бору
- •Представления квантовой механики
- •Современная модель состояния электрона в атоме
- •Строение электронных оболочек атомов
- •Способы записи электронных конфигураций атомов и ионов
- •Периодический закон и периодическая система элементов д.И. Менделеева в свете учения о строении атомов
- •Свойства атомов. Их периодичность
- •Химическая связь и строение молекул
- •Ковалентная связь
- •Метод валентных связей
- •Сигма () и пи ()-связи
- •Донорно-акцепторная связь
- •Свойства ковалентной связи
- •Полярные и неполярные молекулы
- •Относительная электроотрицательность атомов
- •Ионная связь
- •Гибридизация атомных орбиталей
- •Гибридизация орбиталей и пространственная конфигурация молекул
- •Металлическая связь
- •Водородная связь
- •Типы кристаллических решеток
- •Валентность
- •Степень окисления
- •Комплексные соединения (комплементарность) Структура комплексных соединений
- •Хелаты и внутрикомплексные соединения
- •Реакции образования комплексных соединений
- •Номенклатура комплексных соединений
- •Пространственное строение и изомерия комплексных соединений
- •Диссоциация комплексных соединений в растворах. Константа нестойкости. Константа устойчивости
- •Связь в комплексных ионах
- •Реакции с участием комплексных соединений
- •1) Реакции обмена
- •2) Окислительно-восстановительные реакции
- •Элементы химической термодинамики Основные понятия
- •Внутренняя энергия. Первый закон термодинамики. Энтальпия
- •Закон Гесса. Следствия из него
- •Второй закон термодинамики. Энтропия
- •Термодинамические потенциалы
- •14 Типы реакций, различающиеся возможностьюи условиями протекания в зависимости от характера изменения ∆н и ∆s
- •Химическая кинетика Основные понятия
- •Скорость химической реакции
- •Зависимость скорости реакции от концентрации реагентов
- •Влияние температуры на скорость реакции
- •Дисперсные системы
- •Классификация дисперсных систем
- •Классификация дисперсных систем
- •Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •Количественные характеристики дисперсных систем
- •Устойчивость дисперсных систем
- •Применение
- •Растворы Растворы в природе. Теории растворов
- •Механизм процесса растворения
- •Тепловые эффекты при растворении
- •Ненасыщенные, насыщенные и пересыщенные растворы
- •Растворимость различных веществ в воде
- •Выражение количественного состава растворов
- •Разбавленные растворы неэлектролитов и их свойства
- •Эбуллиоскопическая и криоскопическая константы
- •Растворы электролитов и их свойства
- •Диссоциация воды. Водородный показатель
- •Гидролиз солей
- •Буферные растворы
- •Водородный показатель (рН) растворов
- •Свойства кислотно-основных индикаторов
- •Применение
- •Окислительно-восстановительные реакции
- •Распространенные окислители и их продукты
- •Важнейшие восстановители и окислители
- •Методы составления уравнений окислительно-восстановительных реакций
- •Влияние среды на протекание окислительно-восстановительных реакций
- •Эквивалентные массы окислителя и восстановителя
- •Классификация окислительно-восстановительных реакций
- •4) Особые случаи овр:
- •Электрохимические системы Общая характеристика
- •Электродный потенциал. Измерение электродных потенциалов
- •Ряд стандартных электродных потенциалов (напряжений). Уравнение Нернста
- •Ряд напряжений металлов
- •Гальванические элементы, их электродвижущая сила
- •Аккумуляторы
- •Характеристики аккумулятора Эдисона и свинцового аккумулятора
- •Топливные элементы
- •Электролиз
- •Законы электролиза
- •Применение электролиза
- •Высокомолекулярные соединения (вмс) или полимеры
- •Физические свойства
- •Классификация
- •Полимеризационные полимеры
- •Поликонденсационные полимеры
- •Применение
- •Олигомеры
Степень окисления
Трудности
определения валентности в сложных
молекулах привели исследователей к
необходимости ввести понятие о степени
окисления – величине формальной, но
легко рассчитываемой. Степенью
окисления
принято
называть условный заряд атома в молекуле,
который возникает за счет смещения
электронной плотности от менее к более
электроотрицательному атому. Степень
окисления может иметь отрицательное,
положительное и нулевое значения,
которые обычно выражают арабскими
цифрами со знаком «+» или «-» и ставят
над символом элемента. Например,

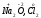
Отрицательную степень окисления имеют атомы, которые приняли электроны от других атомов, т.е. в их сторону смещено связующее электронное облако. Отрицательную степень окисления (-1) имеет атом фтора во всех своих соединениях.
Положительную степень окисления имеют атомы, отдающие свои электроны другим атомам, т.е. связующее электронное облако оттянуто от них. К таковым относятся металлы в соединениях. Степень окисления щелочных металлов равна (+1), а щелочноземельных – (+2).
Нулевую степень окисления имеют атомы в молекулах простых веществ, например водорода, хлора, азота, т.к. в этом случае связующее электронное облако в равной мере принадлежит обоим атомам. Если вещество находится в атомарном состоянии, то степень окисления его атомов также равна нулю.
В большинстве соединений атомы водорода имеют степень окисления (+1), только в гидридах металлов, например, NaH, CaH2, она равна (-1). Кислород в большинстве соединений имеет степень окисления (-2), но в соединении с фтором (F2O) она равна (+2), в пероксидах – (-1). Пользуясь этими сведениями можно вычислить степень окисления атомов в сложных соединениях, учитывая, что алгебраическая сумма степеней окисления атомов в соединении всегда равна нулю, а в сложном ионе – заряду иона.
Лекция 4
Комплексные соединения (комплементарность) Структура комплексных соединений
Наиболее лаконичное определение комплексных (координационных) соединений (КС), хотя и не охватывающее всего их многообразия, следующее – это соединения высшего порядка, образованные из соединений низшего порядка за счет возникновения донорно-акцепторных связей и способные к самостоятельному существованию. Ионы многих элементов (Cu2+, Ag+, Zn2+, Co2+, Cr3+ и др.) способны присоединять к себе другие молекулы, образуя сложные комплексные ионы. Например: CrCl3×6NH3; CrCl3×5NH3; CrCl3×4NH3; CrCl3×3NH3; CoCl3×6NH3 и т.д. Как объяснить их существование? Экспериментальные данные, полученные после растворения каждого вещества и добавления раствора AgNO3, показывают, что большая часть Cl--ионов в этих растворах не осаждается. Так число Cl—ионов осаждаемых в виде AgCl составляет в молекулах: CrCl3×6NH3 - 3; CrCl3×5NH3 – 2; CrCl3×4NH3 – 1. Другие данные также свидетельствуют о различных типах связей. Например, понижение температуры замерзания водного раствора CrCl3×6NH3 указывает на то, что из 1 моля CrCl3×6NH3 в растворе образуются 4 моля частиц и что раствор является хорошим проводником. С другой стороны, понижение температуры замерзания CrCl3×3NH3 указывает на то, что из 1 моля CrCl3×3NH3 в растворе образуется также 1 моль частиц; кроме того, полученный раствор совсем не проводит электрического тока.
Рассмотрим более подробно комплексное соединение CoCl3×6NH3. В 1893 г. в Цюрихе А. Вернером была разработана координационная теория, описывающая строение этих соединений. В соответствии с этой теорией шесть молекул аммиака (лиганды) располагаются (координируются) около положительно заряженного иона Со3+ (комплексообразователя). Лиганд – это ион (или молекула), имеющий атом с неподеленной электронной парой. Молекулы аммиака связаны с ионом кобальта посредством донорно-акцепторной связи, т.е. они предоставляют для химической связи неподеленные (свободные) электронные пары, а ион кобальта – вакантную орбиталь. В комплексном соединении [Co(NH3)6]Cl3, согласно теории Вернера комплексообразователь и лиганды образуют внутреннюю координационную сферу. Остальные ионы, не размещенные во внутренней сфере, находятся на более далеком расстоянии от центрального иона и составляют внешнюю координационную сферу, то есть
[Co(NH3)6] Cl3
________________ _______
внутренняя сфера внешняя сфера
Внутренняя сфера комплекса в значительной степени сохраняет стабильность при растворении. Ее границы показывают квадратными скобками. Ионы, находящиеся во внешней сфере, в растворах легко отщепляются. Поэтому говорят, что во внутренней сфере ионы связаны неионогенно, а во внешней – ионогенно
[Co(NH3)6]Cl3 ↔ [Co(NH3)6] 3+ +3Cl–
комплексный ион
Комплексный ион - сложный ион, который состоит из атома элемента в определенном валентном состоянии связанный с одной или несколькими молекулами или ионами.
Комплексообразователь (ко) – это атом или заряженный ион, способный координировать (окружать) вокруг себя другие частицы. Комплексообразователем может быть:
а) окисленный атом или положительно заряженные ионы d-, р-, f-элементы (Cu2+,Hg2+, Fe2+, Co3+, Ni2+, Pt4+), очень редко s-элементы (Be2+);
б) нейтральный атом p-, d-, f- элемента, благородные газы (Ne, Kr ….);
в) отрицательно заряженные ионы (O2-, S2-, J-, Br-…).
В качестве лигандов (аддендов) могут выступать:
а) нейтральные полярные молекулы: H2O, NH3, CO, спирт ;
б) отрицательно заряженные ионы: F-, Cl-, Br-, CN-, NO2-, NO3-, CNS-, S2O32-, OH- ;
в) любые молекулы органические и неорганические способные к поляризации.
Чаще всего комплексообразователь является заряженной частицей. Заряд комплексообразователя численно равен алгебраической сумме зарядов лигандов и ионов внешней сферы. Заряд комплексного иона равен алгебраической сумме зарядов составляющих его простых ионов.
Входящие в состав комплекса электронейтральные молекулы (NH3, H2O, C2H4, CO и др.) не влияют на величину его заряда. Поэтому при определении заряда комплексных ионов их можно не учитывать.
Нейтральные молекулы или анионы, находящиеся во внутренней сфере комплексного соединения, могут быть последовательно замещены другими молекулами или анионами. Например, путем замещения молекул аммиака в комплексной соли [Co(NH3)6]Cl3 ионами NO2- получают следующие соединения: [Co(NH3)5(NO2)]Cl2, [Co(NH3)3(NO2)3], K2[Co(NH3)(NO2)5], K3[Co(NO2)6].
Число лигандов, окружающих центральный ион, называется координационным числом (кч), которое принимает значения от 2 до 12. Чаще всего координационное число принимает значения 2, 4, 6. Как правило, координационное число равно удвоенной валентности комплексообразователя. Например, координационное число равное 6 встречается в комплексных соединениях Cr3+, Co3+, Fe3+; координационное число равное 4 – в комплексах Cu2+, Zn2+, Pd2+, Pt2+; координационное число равное 2 – в комплексах Ag+, Cu+. Приведенные координационные числа соответствуют максимальному насыщению координационной сферы и относятся к координационно-насыщенным соединениям. Не всегда в растворах соблюдаются условия, необходимые для этого, и тогда образуются координационно-ненасыщенные комплексы с меньшими координационными числами. Например, в комплексных соединениях Pt4+ координационное число равно 6. Координационное число не является неизменной величиной для комплексообразователя и зависит от следующих факторов:
1) природы комплексообразователя;
2) заряда комплексообразователя;
3) природы лиганда;
4) концентрации и температуры;
5) от размера или от радиуса комплексообразователя и лиганда. Чем больше отношение rко/rл, тем больше координационное число.
Расположение элемента комплексообразователя в периодической системе обнаруживает некоторую закономерность. Например, комплексообразователь находящийся во II периоде на внешнем уровне имеет 4 орбитали и его координационное число равно 4. У элементов III периода помимо s- и p-орбиталей могут вовлекаться и d-орбитали. Координационное число возрастает до 6. У элементов следующих периодов вовлекается большее число d-орбиталей и координационное число возрастает до 7, 8, 9. Например, H2[Ta+5F7] координационное число равно 7. Если вовлекаются f-орбитали, то координационное число возрастает до 12.
