
- •Основные законы химии
- •Моль. Молярная масса
- •Относительная атомная и молекулярная массы
- •Газовые законы
- •1. Закон о суммарном давлении смеси газов: давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений газов, составляющих смесь
- •Закон эквивалентов
- •Периодический закон и периодическая система химических элементов д. И. Менделеева
- •Строение атома
- •Модели Томсона и Резерфорда
- •Закон Мозли
- •Электронная оболочка атомов по Бору
- •Представления квантовой механики
- •Современная модель состояния электрона в атоме
- •Строение электронных оболочек атомов
- •Способы записи электронных конфигураций атомов и ионов
- •Периодический закон и периодическая система элементов д.И. Менделеева в свете учения о строении атомов
- •Свойства атомов. Их периодичность
- •Химическая связь и строение молекул
- •Ковалентная связь
- •Метод валентных связей
- •Сигма () и пи ()-связи
- •Донорно-акцепторная связь
- •Свойства ковалентной связи
- •Полярные и неполярные молекулы
- •Относительная электроотрицательность атомов
- •Ионная связь
- •Гибридизация атомных орбиталей
- •Гибридизация орбиталей и пространственная конфигурация молекул
- •Металлическая связь
- •Водородная связь
- •Типы кристаллических решеток
- •Валентность
- •Степень окисления
- •Комплексные соединения (комплементарность) Структура комплексных соединений
- •Хелаты и внутрикомплексные соединения
- •Реакции образования комплексных соединений
- •Номенклатура комплексных соединений
- •Пространственное строение и изомерия комплексных соединений
- •Диссоциация комплексных соединений в растворах. Константа нестойкости. Константа устойчивости
- •Связь в комплексных ионах
- •Реакции с участием комплексных соединений
- •1) Реакции обмена
- •2) Окислительно-восстановительные реакции
- •Элементы химической термодинамики Основные понятия
- •Внутренняя энергия. Первый закон термодинамики. Энтальпия
- •Закон Гесса. Следствия из него
- •Второй закон термодинамики. Энтропия
- •Термодинамические потенциалы
- •14 Типы реакций, различающиеся возможностьюи условиями протекания в зависимости от характера изменения ∆н и ∆s
- •Химическая кинетика Основные понятия
- •Скорость химической реакции
- •Зависимость скорости реакции от концентрации реагентов
- •Влияние температуры на скорость реакции
- •Дисперсные системы
- •Классификация дисперсных систем
- •Классификация дисперсных систем
- •Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •Количественные характеристики дисперсных систем
- •Устойчивость дисперсных систем
- •Применение
- •Растворы Растворы в природе. Теории растворов
- •Механизм процесса растворения
- •Тепловые эффекты при растворении
- •Ненасыщенные, насыщенные и пересыщенные растворы
- •Растворимость различных веществ в воде
- •Выражение количественного состава растворов
- •Разбавленные растворы неэлектролитов и их свойства
- •Эбуллиоскопическая и криоскопическая константы
- •Растворы электролитов и их свойства
- •Диссоциация воды. Водородный показатель
- •Гидролиз солей
- •Буферные растворы
- •Водородный показатель (рН) растворов
- •Свойства кислотно-основных индикаторов
- •Применение
- •Окислительно-восстановительные реакции
- •Распространенные окислители и их продукты
- •Важнейшие восстановители и окислители
- •Методы составления уравнений окислительно-восстановительных реакций
- •Влияние среды на протекание окислительно-восстановительных реакций
- •Эквивалентные массы окислителя и восстановителя
- •Классификация окислительно-восстановительных реакций
- •4) Особые случаи овр:
- •Электрохимические системы Общая характеристика
- •Электродный потенциал. Измерение электродных потенциалов
- •Ряд стандартных электродных потенциалов (напряжений). Уравнение Нернста
- •Ряд напряжений металлов
- •Гальванические элементы, их электродвижущая сила
- •Аккумуляторы
- •Характеристики аккумулятора Эдисона и свинцового аккумулятора
- •Топливные элементы
- •Электролиз
- •Законы электролиза
- •Применение электролиза
- •Высокомолекулярные соединения (вмс) или полимеры
- •Физические свойства
- •Классификация
- •Полимеризационные полимеры
- •Поликонденсационные полимеры
- •Применение
- •Олигомеры
Метод валентных связей
Представления о механизме образования химической связи на примере молекулы водорода распространяются и на другие молекулы. Теория химической связи, созданная на этой основе, получила название метода валентных связей (МВС). Основные положения:
1) ковалентная связь образуется в результате перекрывания двух электронных облаков с противоположно направленными спинами, причем образованное общее электронное облако принадлежит двум атомам;
2) ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака. Степень перекрывания электронных облаков зависит от их размеров и плотности;
3) образование молекулы сопровождается сжатием электронных облаков и уменьшением размеров молекулы по сравнению с размерами атомов;
4) в образовании связи принимают участие s- и p-электроны внешнего энергетического уровня и d-электроны предвнешнего энергетического уровня.
Сигма () и пи ()-связи
В молекуле хлора каждый его атом имеет завершенный внешний уровень из восьми электронов s2 p6 , причем два из них (электронная пара) в одинаковой степени принадлежит обоим атомам. Перекрывание электронных облаков при образовании молекулы показано на рисунке
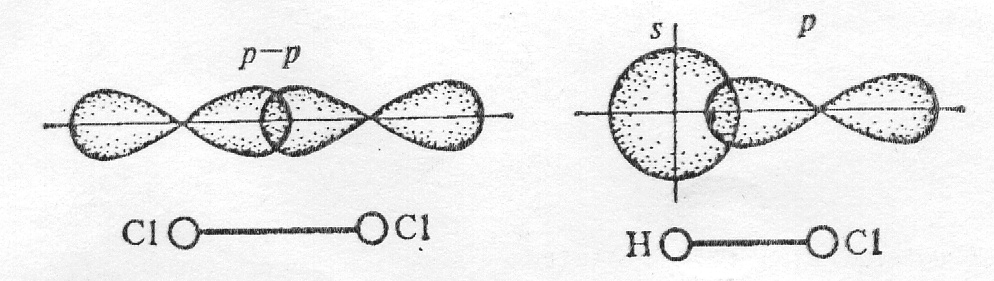
а б
Схема образования химической связи в молекулах хлора Cl2 (а) и хлороводорода HCl (б)
Химическая связь, для которой линия, соединяющая атомные ядра, является осью симметрии связывающего электронного облака, называется сигма (σ)-связью. Она возникает при «лобовом» перекрывании атомных орбиталей. Связи при перекрывании s-s-орбиталей в молекуле Н2; р-р-орбиталей в молекуле Cl2 и s-p-орбиталей в молекуле НСl являются сигма связями. Возможно «боковое» перекрывание атомных орбиталей. При перекрывании р-электронных облаков, ориентированных перпендикулярно оси связи, т.е. по оси у- и z-осям, образуются две области перекрывания, расположенные по обе стороны от этой оси. Такая ковалентная связь называется пи ()-связью. Перекрывание электронных облаков при образовании π-связи меньше. Кроме того, области перекрывания лежат дальше от ядер, чем при образовании σ-связи. Вследствие этих причин π-связь обладает меньшей прочностью по сравнению с σ-связью. Поэтому энергия двойной связи меньше удвоенной энергии одинарной связи, которая всегда является σ-связью. Кроме того, σ-связь имеет осевую, цилиндрическую симметрию и представляет собой тело вращения вокруг линии, соединяющей атомные ядра. π-Связь, наоборот, не обладает цилиндрической симметрией.
Одинарная связь всегда является чистой или гибридной σ-связью. Двойная же связь состоит из одной σ- и одной π-связей, расположенных перпендикулярно друг относительно друга. σ-Связь прочнее π-связи. В соединениях с кратными связями обязательно присутствует одна σ-связь и одна или две π-связи.
Донорно-акцепторная связь
Возможен и другой механизм образования ковалентной связи – донорно-акцепторный. В этом случае химическая связь возникает за счет двухэлектронного облака одного атома и свободной орбитали другого атома. Рассмотрим в качестве примера механизм образования иона аммония (NH4+). В молекуле аммиака атом азота имеет неподеленную пару электронов (двухэлектронное облако)
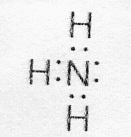
У иона водорода свободна (не запонена) 1s-орбиталь, что можно обозначить как Н+ (здесь квадрат означает ячейку). При образовании иона аммония двухэлектронное облако азота становится общим для атомов азота и водорода, то есть оно превращается в молекулярное электронное облако. А значит, возникает четвертая ковалентная связь. Процесс образования иона аммония можно представить схемой

Заряд иона водорода становится общим (он делокализован, т.е. рассредоточен между всеми атомами), а двухэлектронное облако (неподеленная электронная пара), принадлежащая азоту, становится общей с Н+. В схемах изображение ячейки часто опускается.
Атом, предоставляющий неподеленную электронную пару, называется донором, а атом, принимающий ее (то есть предоставляющий свободную орбиталь), называется акцептором.
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора) называется донорно-акцепторным. Образованная таким путем ковалентная связь называется донорно-акцепторной или координационной связью.
Однако это не особый вид связи, а лишь иной механизм (способ) образования ковалентной связи. По свойствам четвертная связь N-H в ионе аммония ничем не отличается от остальных трех.
Большей частью донорами являются молекулы, содержащие атомы N, O, F, Cl связанные в ней с атомами других элементов. Акцептором может быть частица, обладающая вакантными электронными уровнями, например, атомы d-элементов, обладающие незаполненными d-подуровнями.
