
Ферменты.
Ферментология – раздел биохимии изучающий теоретически и практические вопросы связанные с ферментами.
Ферменты – это высокоспециализированные белки способные повышать скорость реакции в живых организмах. Ферменты = биологические катализаторы.
Свое название ферменты получили от процессов дрожжевого брожения. В настоящее время энзимы-ферменты это синимы. Первые работы в области ферментологии в 1814 год Кирхгоф провер первую ферментативную реакцию расщепления крахмала до глюкозы из проросших злаков. 1897 Брюхнер впервые провел дрожжевое брожение бесклеточных экстрактов. 1926 Самнер впервые получил фермент уреазу в кристаллическом чистом состоянии. 1966 Меррифинд впервые осуществил искусственный синтез фермента РНК-аза.
Структура ферментов.
Все ферменты – белки, как правило глобулярные относятся как к простым так и к сложным. Белковая часть фермента может состоять из одной ППЦ – мономерные белки – ферменты (пепсин). Ряд ферментов является олигомерными включают в свой состав несколько протомеров или субъединиц. Протомеры объединяясь в олигомерную структуру соединяется самопроизвольно непрочными нековалентными связями. В процессе объединение (кооперации) происходят структурные изменения отдельных протомеров в результате чего активность фермента заметно возрастает. Отделенеие (диссциация) протомеров и их объединение в олигомерный белок является регуляторным механизмов активности ферментов.
Субъединицы (протомеры) в олигомерах могут быть одиканоковыми, могут отличатся по одной, трем структурам (конформация). В случае отличия возникает множественные формы одного и того же фермента – изоферменты.
Изоферменты катализируют одну и ту же реакцию, но отличаются по набору субъединиц, физико-химическим свойствам, электрофоретической подвижностью, по сродству к субстратам, активаторам, ингибиторам. Пример: лактат-дегидро-геназа (ЛДГ) – фермент окисляющий молочную кислоту в пировиноградную этот фермент тетрамер состоит из четырех протомеров двух типов. Первый Н – из сердечной мышцы, второй М – из скелетной мускулатуры. Поэтому возможно 5 сочетаний этих протомеров: Н4, Н3М, Н2М2, Н1М3, М4.
Биологическая роль изоферментов.
Изоферметы обеспечивают протекание химических реакций в соответствии с условиями в разных органах.
ЛДГ1 – обладает высоким сродством к кислороду поэтому он активен в тканях органов с высокой скоростью окислительных реакций (эритроциты, миокард). ЛДГ5 – активен в присутствии высокой концентрации лактата (наиболее активен в печени)
Поскольку изоферменты органоспецифичны – это используется для диагностики заболеваний различных уровней.
Изоферменты имеют способность изменять свою активность с возрастом.
У плода при недостатке кислорода преобладает ЛДГ3, а с увеличением возраста, увеличением кислорода возрастает доля ЛДГ2.
Если фермент является сложным белком то он состоит из белковой и небелковой части. Белковая часть является высокомолекулярной, термолябильной частью фермента и называется апоферментом. Он имеет своеобразную структуру и определяет специфичность белковых ферментов. Небелковая часть фермента – ко-фактор (ко-фермент). Ко-фактором чаще всего являются ионы металлов которые могут прочно связыватся с апо-ферментом например: Zn-карбоангидраза, Сu-цитохромоксидаза. Ко-ферменты чаще всего являются органическими веществами мене прочно связываемые с апоферментом. Ко-ферментами являетются нуклеатиды, НАД, ФАД.
Ко-фермент – низкомолекулярная, термостабильная часть фермента его роль заключается в том, что он определяет пространственную укладку (конфирмацию) апофермента, и определяет его активность. Ко-факторы могут переносить электроны, функциональные группы, участвуют в образовании дополнительных связей между ферментом и субстратом.
В функцианальном отношении в ферменте принято выделять два важных участка:
1. Активный центр
2. Аллостерический участок
- ОН группы серина
- SH – цистеина
- NH2 лизина (NH3)
- γ-СООН глютаминовой кислоты
В АЦ различают 2 зоны – связывания с субстратом и каталитическая.
Зона связывания обычно имеет жесткую структуру к которой комплиментрно присоединяется субстраты реакций. Пример: трипсин расщепляет белки в участках богатых аминокислотой лизином.
Каталитическая зона - это участок активного центра непосредственно воздействующий на субстрат и осуществляющий каталитическую функцию. Это зона более подвижна, допускает изменение функциональных групп.
В ряде ферментов чаще олигомерных, кроме активного центра есть аллостерический участок – участок молекулы фермента удаленный от активного центра взаимодействующий с субстратом и дополнительными веществами (регуляторами, эффекторами). В аллостеричесих ферментах в одной субъединице находится АЦ а в другой АУ. Аллостерические ферменты могут изменять свою активность следующим образом: эффектор (активатор, ингибитор) действует на аллостерическую субъединицу и изменяет ее структуру. Изменение конформации аллостерической субъединицы по принципу кооперативных изменений меняет структуру каталитической единицы.
Механизм действия ферментов.
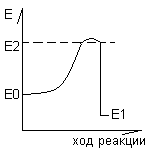
Не смещают каталитическое равновесие
Не расходуются в процессе реакции
Катализирую только термодинамически реальные реакции. Такими реакциями являются те в которых сходный энергетический запас молекул больше чем финальный.
Разница между Е этого порога и исходным есть энергия активации. Скорость ферментативных реакций определяется энергией активации и другими факторами.
Константа скорости химической реакции определяется по уравнению:
К=P*Z*e- (Ea/RT)
К - константа скорости
Р – пространственный стерический коэффициент
Z – число взаимодействующих молекул
Еа – энергия активации
R – газовая постоянная
Т – универсальная температура
е – основание натуральных логарифмов
В этом уравнении z, е, RT – постоянные величины. Р и Еа переменные. Причем между скоростью реакции (К) и давлением зависимость прямая. К и Еа – обратная и степенная зависимость. Чем ниже Еа тем выше скорость реакции.
Механизм действия ферментов сводится к увеличению ферментами стерического коэффициента и уменьшению энергии активации.
Энергия активации.
Разложение Н2О2 без ферментов и катализаторов – 18 г/ккал на моль, если используется давление и температура то 12 000 ккал/моль. Если используется каталаза, то Еа=2 000 калл/моль.
Уменьшение Еа происходит в результате образования промежуточных фермент-субстратных комплексов. F+S <=> FS-комплекс → F + продукты реакции. Впервые возможность образование ферментных комплексов была доказана Михаэлисом, Ментеном. В последствии многие комплексы были выделены благодаря высокой избирательности ферментов при взаимодействии с субстратом: тория ключа и замка Фишера. Согласно теории фермент взаимодействует с субстратом абсолютно соответствуют друг другу (комплементарно) как ключ и замок. Теория объясняла специфичность ферментов, но не раскрывала механизмы воздействия на субстрат и поэтому возникла теории индуцированного соответствия фермента и субстрата. Теория Кошланда (резиновой перчатки) ее суть активный центр фермента сформирован и содержит все функциональные группы еще до взаимодействия с субстратом. Однако эти функциональные группы находятся в неактивном состоянии. В момент присоединения с субстратом субстрат индуцирует изменения положения, структуру радикальных групп в активном центре фермента и активный центр под действием субстрата переходит в активное состояние и в свою очередь начинает воздействовать на субстрат т.е. происходит взаимодействие АЦ фермента и субстрата. В результате субстрат переходит в нестабильное неустойчивое состояние, в результате чего уменьшается энергия активации.
Взаимодействие фермента и субстрата различно это реакции нуклеофильного замещения, эелектрофильного замещения, дегидратация субстрата. Возможно ковалентное взаимодействие, а в основном происходит геометрическая переориентация функциональных групп активного центра. Второй показатель – ферменты увеличивающие стерический коэффициент.
Стерический коэффициент – вводится для реакции в которых участвуют крупные молекулы имеющие пространственную структуру. Стерический коэффициент – показывает долю удачных столкновений активных молекул.

Ферменты увеличивают стерический коэффициент так как они изменяют молекулы субстрата в фермент субстратном комплексе и комплиментарность возрастает.
2) До взаимодействия с ферментом молекулы располагаются хаотично, а после упорядочиваются.
Номенклатура ферментов.
Ферменты имеют несколько типов названий:
Тривиальные (трипсин, пепсин)
Рабочее номенклатура в этом названии присутсвует окончание –аза которое прибавляется:
к названию субстрата (сахараза, амилаза),
к виду связи на которую действует фермент (пептидаза, гликозидаза),
к типу реакции, процесса (синтетаза, гидролаза).
У каждого фермента есть классификационное название в котором отражается тип реакции вид субстрата и кофермента например: ЛДГ – лактат-НАД+-окидоредуктаза.
Классификация ферментов.
1961 год согласно классификации расположен в определенном классе, подклассе, подподклассе и имеет порядковый номер. Поэтому каждый фермент имеет цифровой шифт первая цифра – класс, вторая – подкласс, третья – подподкласс, четвертая – порядковый номер (ЛДГ: 1,1,1,27). Все ферменты классифицируются на 6 классов.
Оксидоредуктазы
Трансферразы
Гидролазы
Лиазы
Изомеразы
Синтетазы (лигазы)
Оксидоредуктазы.
Ферменты катализирующие окислительно-востановительные процессы. Общий фид реакции: Аок + Ввос = Авост+Вок. Наиболее важный подкласс:
1. Дегидрогиназы, катализирует реакции путем отщепления водорода от окисляемого вещества они бывают аэробные (переносят водород на кислород) и анаэробные (переносят водород не на кислород, а на какое-то другое вещество).
2. Оксигеназы ферменты катализирующие окисление путем присоединение кислорода к окисляемому веществу. Если присоединяется один атом кислорода – монооксигеназы, если два – диоксигеназы.
3. Пероксидазы ферменты катализирующие окисление веществ при участии пероксидов.
Трансферразы.
Ферменты осуществляющие межмолекулярный перенос функциональных групп с одного вещества на другое АВ + С = А + ВС. Подклассы выделяют в зависимости от вида переносимых групп: аминотрансферразы, метилтрансферразы, сульфатрансферразы, ацилтрансферразы – переносят остатки жирных кислот, фосфотрансферразы – переносят остатки фосфорных кислот.
Гидролазы.
Катализирует разрыв химической связи с присоединением воды по месту разрыва то есть реакции гидролиза. АВ + НОН = АН + ВОН. Подклассы выделяют от вида разрываемых связей: пептидазы (пептин), гликозидазы - гликозидные связи (амилаза), эстеразы – сложноэфирные связи (липаза).
Лиазы.
Катализируют разрыв химической связи без присоединения воды по месту разрыва при этом в субстратах образуются двойные связи. АВ = А + В. Подклассы зависят от того между какими атомами разрывается связь и какие вещества образуются: альдолазы – разрывает связь медлу двумя атомами водорода например фруктоза 1,6-ди-фосфатальдолаза разрезает фруктозу и две триозы. К лиазам относят ферменты декарбоксилазы – они вырезают углекислый газ. Дегидротазы – вырезают молекулы воды.
Изомеразы.
Катализируют взаимопревращения различных изомеров. Фосфогексоизимераза переводит фруктозу в глюкозу, подклассы – мутазы (фосфоглюуомутаза переводит глюкозу 1 фосфат), эпимеразы переводят рибозу в ксилулозу, таутомеразы
Синтетазы (лигазы).
Это ферменты катализирующие реакции синтеза новых веществ за счет энергии АТФ, А+В+АТФ = АВ. Глютаминсинтетаза соединяется (глю+NH3+АТФ = глютамин).
