
- •1. Химическая природа и строение ферментов
- •1.1. Химическая природа ферментов
- •1.2. Активный центр ферментов
- •1.3. Изоферменты
- •2. Основные свойства ферментов
- •2.1.Отличие от неорганических катализаторов
- •2.2 Субстратная специфичность действия ферментов
- •Термолабильность ферментов
- •Зависимость активности ферментов от рН-среды
- •2.5. Активность ферментов
- •3. Механизм действия ферментов.
- •4. Основы кинетики ферментативного катализа
- •5. Факторы, определяющие активность ферментов. Активаторы и ингибиторы ферментов.
- •6. Классификация и номенклатура ферментов
- •Примеры реакций катализируемых ферментами различных классов:
- •Количественная оценка активности ферментов
2. Основные свойства ферментов
2.1.Отличие от неорганических катализаторов
От неорганических катализаторов ферменты отличаются рядом характерных особенностей:
Ферменты чрезвычайно эффективны и проявляют в 108 – 1020 раз более высокую каталитическую активность в условиях умеренной температуры (температура тела), нормального давления и в области близких к нейтральным значениям рН среды.
Ферменты отличаются высокой специфичностью действия в отношении как химической природы субстрата, так и типа реакции, т.е. каждый фермент катализирует в основном только определенную химическую реакцию. Для каждого фермента характерны специфическая последовательность расположения аминокислотных остатков и пространственная конформация.
Ферменты термолабильны и неустойчивы по отношению к кислотам и щелочам.
Активность ферментов в клетках строго контролируется: воздействуя на фермент, можно регулировать скорость соответствующей реакции
Ферменты не вызывают в отличие от неорганических катализаторов каких-либо побочных реакций.
2.2 Субстратная специфичность действия ферментов
Субстратная специфичность – это способность каждого фермента взаимодействовать лишь с одним или несколькими определёнными субстратами.
Различают:
абсолютную субстратную специфичность;
групповую субстратную специфичность;
стереоспецифичность.
Активный центр ферментов, обладающих абсолютной субстратной специфичностью, комплементарен только одному субстрату. Таких ферментов в живых организмах мало. Например, уреаза, катализирует гидролиз мочевины до диоксида углерода и аммиака:
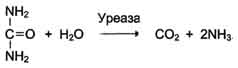
Примерами ферментов, характеризующихся абсолютной специфичностью, также являются аргиназа, катализирующая реакцию расщепления аргинина до мочевины и орнитина, и лактатдегидрогеназа, катализирующая превращение лактата в пируват.
Относительная субстратная специфичность характерна для многих ферментов, например, для ферментов класса гидролаз: протеаз, эстераз, фосфатаз. Так, фермент панкреатическая липаза катализирует гидролиз жиров в двенадцатиперстной кишке человека, катализируя превращение любой молекулы жира (триацилглицерола) до молекулы моноацилглицерола и двух молекул высших жирных кислот:
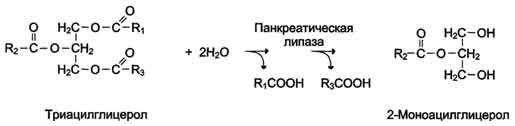
Большинство протеолитических ферментов, осуществляющих гидролиз белков, имеет групповую субстратную специфичность, гидролизуя пептидные связи, образованные разными аминокислотами.
При наличии у субстрата нескольких стереоизомеров фермент проявляет абсолютную стереоспецифичность к одному из них. В организме человека наблюдают специфичность ферментов к следующим стереоизомерам.
Стереоспецифичность к D-сахарам. Большинство моносахаридов и продуктов их обмена в организме человека и других млекопитающих относят к D-стереоизомерам. Ферменты, осуществляющие их метаболизм, имеют специфичность к D-, а не к L-сахарам.
Стереоспецифичность к L-аминокислотам. Белки человека состоят из аминокислот L-ряда. Большинство ферментов, обеспечивающих превращение аминокислот, имеет стереоспецифичность к L-аминокислотам.
Стереоспецифичносгь к α- и β-гликозидным связям. Фермент амилаза действует только на α- гликозидные связи, что позволяет гидролизовать крахмал и гликоген (полимеры глюкозы), остатки глюкозы в которых соединены α-гликозидными связями. Целлюлоза - также полимер глюкозы, однако остатки глюкозы в нём связаны β-гликозидными связями. В результате отсутствия у человека ферментов, специфичных к β-гликозидной связи, целлюлоза не гидролизуется в кишечнике человека и не может служить источником глюкозы.
В 1890 г . Эмиль Фишер предложил модель «ключ-замок» для иллюстрации специфичности действия ферментов. Модель была основана на предположении, что специфичность ферментов определяется точным соответствием формы молекул фермента и субстрата. Фермент соединяется с субстратом с образованием короткоживущего фермент-субстратного комплекса.

Рис.3 . Модель взаимодействия фермента и субстрата по типу «ключ-замок»
Однако, эта модель не объясняла явления стабилизации переходного состояния, которое наблюдается на практике.
Д. Кошланд в 1958 г. предложил модификацию модели «ключ-замок» - модель индуцированного соответствия. Ферменты, в основном, гибкие молекулы, поэтому активный центр фермента может изменить конформацию после связывания субстрата. Боковые группы аминокислот активного центра принимают такое положение, которое позволяет ферменту выполнить свою каталитическую функцию. В некоторых случаях молекула субстрата также меняет конформацию после связывания в активном центре.
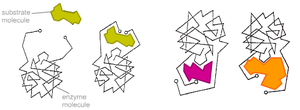
Рис. 4. Модель взаимодействия фермента и субстрата по типу индуцированного соответствия. («Неправильные субстраты» — слишком большие или слишком маленькие — не подходят к активному центру).
В отличие от модели «ключ-замок», модель индуцированного соответствия объясняет не только специфичность ферментов, но и стабилизацию переходного состояния.
