
- •1.Физиологическая роль углеводов
- •2. Пищевые источники и потребность организма в углеводах. Переваривание углеводов в желудочно-кишечном тракте. Судьба всосавшихся моносахаридов.
- •4. Гликоген как резервный полисахарид. Глюкостатическая функция печени.
- •5. Глюкоза в крови. Регуляция уровня глюкозы в крови. Роль адреналина, глюкагона, инсулина, тиреоидных гормонов.
- •7) Клиническое значение определения концентрации глюкозы в моче
- •8) Изучение углеводного обмена методом однократной сахарной нагрузки.
- •10) Механизм внутриклеточного окисления глюкозы. Дихотомическое анаэробное окисление углеводов (гликолиз).
- •Суммарное уравнение анаэробного гликолиза.
- •11)Гомеостаз молочной кислоты
- •2. Продукция лактата
- •3. Утилизация лактата
- •4. Молочнокислый ацидоз
- •12) Энергетический эффект распада углеводов и триглицеридов
- •14) Гликолиз
- •21. Регуляция содержания глюкозы в крови в абсорбтивном и постабсорбтивном периодах, при длительном голодании, в период голодания и в период покоя.
- •22.Апотомический путь окисления глюкозы(пентозофосфатный шунт).Окислительный этап.Неокислительный этап.Биологическое значение процесса
- •23. Дефект глюкозо-6-фосфат дегидрогеназы в эритроцитах
- •24.Метаболизм фруктозы.Нарушение метаболизма.Недостаточность фруктокиназы.
- •25.Метаболизм галактозы.Нарушение метаболизма галактозы(дефекты галактокиназы, галактазо-1-фосфатуридилтрансферазы)
- •32. Эйкозаноиды (простагландины, простациклины, тромбоксаны, лейкотриены), био роль, представители.
- •1. Структура и номенклатура простагландинов и тромбоксанов
- •2. Циклооксигеназный путь: синтез простагландинов и тромбоксанов
- •33. Фосфатиды-глицериды. Классификация, структура, био роль.
- •34. Фосфатиды-неглицериды. Классификация, сфингозин-фосфатиды. Био роль.
- •35. Переваривание экзогенных липидов в жкт. Липолитические ферменты: желудочная липаза, панкреатическая липаза, фосфофолипазы, особенности их каталитической активности.
- •41) Сущность b-окисления, химизм реакций, характеристика ферментов.
- •42) Общий энергетический эффект полного окисления. Взаимосвязь окисления жк с процессами тканевого дыхания.
- •43) Особенности окисления ненасыщенных жк. Энергетический эффект окисления.
- •44) Цикл Рэндла.
- •45) Катаболизм фосфолипидов – глицеридов.
- •Вопрос 54
- •Кетонурия
- •51.Представление о биосинтезе холестерина (хс). Роль оксиметилглутарил-КоА-редуктазы в биосинтезе хс. Регуляция процесса биосинтеза хс.
- •53. Кетогенез: химизм реакции. Кетоновые тела (ацетоуксусная кислота, β-оксимасляная кислота, ацетон) и их биологическая роль. Кетолиз (окисление кетоновых тел в тканях).
- •Вопрос 55,56 транспорт жиров из кишечника хиломикронами
- •60)Классификация липопротеинемии по Фридрексону( у кого есть скинте)
- •Вопрос 61 биологические мембраны
- •I. Роль мембран в метаболизме и их разнообразие
- •1. Структура и свойства липидов мембран
- •2. Трансмембранная асимметрия липидов
- •3. Жидкостностъ мембран
- •4. Функции мембранных липидов
Вопрос 55,56 транспорт жиров из кишечника хиломикронами
Липиды в водной среде (а значит, и в крови) нерастворимы, поэтому для транспорта липидов кровью в организме образуются комплексы липидов с белками - липопротеины.
А. Общая характеристика липопротеинов
Все типы липопротеинов имеют сходное строение - гидрофобное ядро и гидрофильный слой на поверхности (рис. 8-18). Гидрофильный слой образован белками, которые называют апопротеинами, и амфифильными молекулами липидов
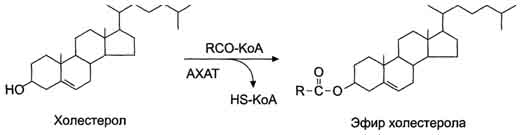
Рис. 8-17. Реакция этерификации холестерола в клетках слизистой оболочки тонкой кишки. АХАТ - ацилхолестерол-ацилтрансфераза.
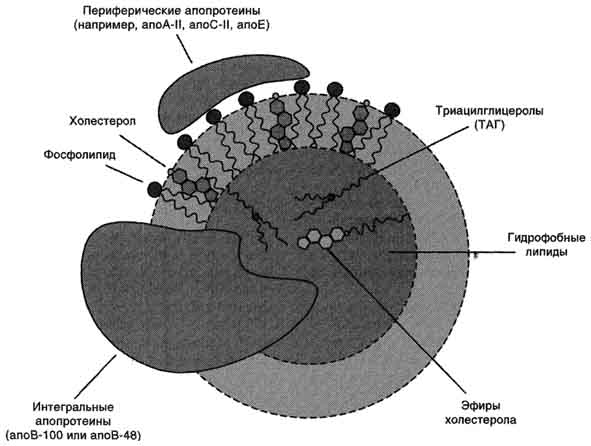
Рис. 8-18. Липопротеины плазмы крови.
387
- фосфолипидами и холестеролом. Гидрофильные группы этих молекул обращены к водной фазе, а гидрофобные части - к гидрофобному ядру липопротеина, в котором находятся транспортируемые липиды. Некоторые апопротеины интегральные и не могут быть отделены от липопротеина, а другие могут свободно переноситься от одного типа липопротеина к другому. Апопротеины выполняют несколько функций:
формируют структуру липопротеинов;
взаимодействуют с рецепторами на поверхности клеток и таким образом определяют, какими тканями будет захватываться данный тип липопротеинов;
служат ферментами или активаторами ферментов, действующих на липопротеины.
В организме синтезируются следующие типы липопротеинов (см. ниже табл. 8-5): хиломикроны (ХМ), липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП).
Каждый из типов ЛП образуется в разных тканях и транспортирует определённые липиды. Например, ХМ транспортируют экзогенные (пищевые жиры) из кишечника в ткани, поэтому триацилглицеролы составляют до 85% массы этих частиц.
ЛП хорошо растворимы в крови, не коалесцируют, так как имеют небольшой размер и отрицательный заряд на поверхности. Некоторые ЛП легко проходят через стенки капилляров кровеносных сосудов и доставляют липиды к клеткам.
Большой размер ХМ не позволяет им проникать через стенки капилляров, поэтому из клеток кишечника они сначала попадают в лимфатическую систему и потом через главный грудной проток вливаются в кровь вместе с лимфой.
Методы исследования. Состав ЛП крови можно исследовать разными методами (рис. 8-19). Метод ультрацентрифугирования позволяет разделить ЛП, используя их различие в плотности, которая зависит от соотношения количества липидов и белков в частице. Так как жир имеет меньшую, чем вода, плотность, то ХМ, содержащие более 85% жиров, располагаются на поверхности сыворотки крови, а ЛПВП, содержащие наибольшее количество белков, имеют самую большую плотность и при центрифугировании располагаются в нижней части центрифужной пробирки. Так как ЛП впервые были выделены из сыворотки крови методом ультрацентрифугирования, то в названии указывают плотность частиц. Однако метод ультрацентрифугирования непригоден для широкого использования, поэтому в клинических лабораториях обычно применяют метод электрофореза. Скорость движения частиц при электрофорезе зависит от их заряда и размера. Заряд, в свою очередь, зависит от количества белков на поверхности ЛП (табл. 8-5). При электрофорезе в геле все типы ЛП движутся к положительному полюсу; ближе к старту располагаются ХМ, а ЛПВП, имеющие наибольшее количество белков и наименьший размер, удаляются от старта дальше других частиц.
Состав ЛП крови значительно изменяется в течение суток. В абсорбтивный период (особенно при употреблении жирной пищи) в крови появляются ХМ. Богатая углеводами пища способствует образованию ЛПОНП, так как эти ЛП транспортируют жиры, синтезированные в печени из углеводов. В постабсорбтивный период и при голодании в крови присутствуют только ЛПНП и ЛПВП, основная функция которых заключается в транспорте холестерола.
Б. Образование хиломикронов
Жиры, образовавшиеся в результате ресинтеза в клетках слизистой оболочки кишечника, упаковываются в ХМ. Основной апопротеин в составе ХМ - белок апоВ-48. Этот белок закодирован в том же гене, что и белок ЛПОНП - В-100 (табл. 8-5), который синтезируется в печени. В кишечнике в результате посттранскрипционных превращений "считывается" последовательность мРНК, которая кодирует только 48% от длины белка В-100, поэтому этот белок называется апоВ-48. Белок апоВ-48 синтезируется в шероховатом ЭР и там же гликозилируется. Затем в аппарате Гольджи происходит формирование ХМ, называемых "незрелыми". По механизму экзоцитоза они выделяются в хилус, образующийся в лимфатической системе кишечных ворсинок, и через главный грудной лимфатический проток попадают в кровь. В лимфе и крови с ЛПВП на ХМ переносятся
Таблица 8-5. Липопротеины - транспортные формы липидов
Типы липопротеинов |
Хиломикроны (ХМ) |
ЛПОНП |
ЛППП |
ЛПНП |
ЛПВП |
Состав, % |
|
|
|
|
|
Белки |
2 |
10 |
11 |
22 |
50 |
ФЛ |
3 |
18 |
23 |
21 |
27 |
ХС |
2 |
7 |
8 |
8 |
4 |
ЭХС |
3 |
10 |
30 |
42 |
16 |
ТАГ |
85 |
55 |
26 |
7 |
3 |
Функции |
Транспорт липидов из клеток кишечника(экзогенных липидов) |
Транспорт липидов, синтезируемых в печени (эндогенных липидов) |
Промежуточная форма превращения ЛПОНП в ЛПНП под действием фермента ЛП-липазы |
Транспорт холестерола в ткани |
Удаление избытка холестерола из клеток и других липопротеинов. Донор апопротеинов А, С-П |
Место образования |
Эпителий тонкого кишечника |
Клетки печени |
Кровь |
Кровь (из ЛПОНП и ЛППП) |
Клетки печени - ЛПВП-пред-шественники |
Плотность, г/мл |
0,92-0,98 |
0,96-1,00 |
|
1,00-1,06 |
1,06-1,21 |
Диаметр частиц, нМ |
Больше 120 |
30-100 |
|
21-100 |
7-15 |
Основные аполипопротеины |
В-48 С-П Е |
В-100 С-П Е |
В-100 Е |
В-100 |
A-I С-II Е |
Примечания: ФЛ - фосфолипиды; ХС - холестерол; ЭХС - эфиры холестерола; ТАГ - триацилглицеролы. Функции апопротеинов
В-48 - основной белок ХМ;
В-100 - основной белок ЛПОНП, ЛПНП, ЛППП, взаимодействует с рецепторами ЛПНП;
С-II - активатор ЛП-липазы, переносится с ЛПВП на ХМ и ЛПОНП в крови;
Е - взаимодействует с рецепторами ЛПНП;
A-I - активатор фермента лецитингхолестеролацилтрансферазы (ЛХАТ).
апопротеины Е (апоЕ) и С-П (апоС-П); ХМ превращаются в "зрелые". ХМ имеют довольно большой размер, поэтому после приёма жирной пищи они придают плазме крови опалесцирующий, похожий на молоко, вид. ХМ транспортируют жир к различным тканям, где он утилизируется, поэтому концентрация ХМ в крови постепенно снижается, и плазма опять становится прозрачной. ХМ исчезают из крови в течение нескольких часов.
При редком наследственном заболевании - дефекте гена апопротейна В - нарушается синтез белков апоВ-100 в печени и апоВ-48 в кишечнике. В результате в клетках слизистой оболочки кишечника не формируются ХМ, а в печени - ЛПОНП. В клетках этих органов накапливаются капельки жира. Такое заболевание называется абеталипопротеинемия, так как второе название ЛПОНП - пре-β-липопротеины.
389

Рис. 8-19. Разделение липопротеинов сыворотки крови. А - метод ультрацентрифугирования. Б - метод электрофореза в полиакриламидном геле через 2 ч после еды.
В. Использование экзогенных жиров тканями
Действие липопротеинлипазы на ХМ. В крови триацилглицеролы, входящие в состав зрелых ХМ, гидролизуются ферментом липопротеин-липазой, или ЛП-липазой (рис. 8-20). ЛП-липа-за связана с гепарансульфатом (гетерополисаха-ридом), находящимся на поверхности эндотелиальных клеток, выстилающих стенки капилляров кровеносных сосудов. ЛП-липаза гидролизует молекулы жиров до глицерола и 3 молекул жирных кислот. На поверхности ХМ различают 2 фактора, необходимых для активности ЛП-липазы - апоС-П и фосфолипиды. АпоС-П активирует этот фермент, а фосфолипиды участвуют в, связывании фермента с поверхностью ХМ.
ЛП-липаза синтезируется в клетках многих тканей: жировой, мышечной, в лёгких, селезёнке, клетках лактирующей молочной железы. Изоферменты ЛП-липазы в разных тканях отличаются по значению Кm: ЛП-липаза жировой ткани имеет в 10 раз более высокое значение Кm, чем, например, ЛП-липаза сердца, поэтому гидролиз жиров ХМ в жировой ткани происходит в абсорбтивный период. Жирные кислоты поступают в адипоциты и используются для синтеза жиров. В постабсорбтивном состоянии, когда количество жиров в крови снижается, ЛП-липаза сердечной мышцы продолжает гидролизовать жиры в составе ЛПОНП, которые присутствуют в крови в небольшом количестве, и жирные кислоты используются этой тканью как источники энергии, даже при низкой концентрации жиров в крови. ЛП-липазы нет в печени, но на поверхности клеток этого органа имеется другой фермент - печёночная липаза, не действующая на зрелые ХМ, но гидролизующая жиры в ЛППП, которые образуются из ЛПОНП.
Судьба жирных кислот, глицерола и остаточных хиломикронов. В результате действия ЛП-липазы на жиры ХМ образуются жирные кислоты и глицерол. Основная масса жирных кислот проникает в ткани (рис. 8-20). В жировой ткани в абсорбтивный период жирные кислоты депонируются в виде триацилглицеролов, в сердечной мышце и работающих скелетных мышцах используются как источник энергии. Другой продукт гидролиза жиров, глицерол, растворим в крови, транспортируется в печень, где в абсорбтивный период может быть использован для синтеза жиров.

Рис. 8-20. Путь экзогенных жиров и хиломикронов. *ЛПЛ - липопротеинлипаза, ЖК - жирные кислоты.
В результате действия ЛП-липазы на ХМ количество жиров в них снижается на 90%, уменьшаются размеры частиц, апопротеин С-П переносится обратно на ЛПВП. Образовавшиеся частицы называются остаточными ХМ. Они содержат в себе фосфолипиды, холестерол, жирорастворимые витамины и апопротеины В-48 и Е. Остаточные ХМ захватываются гепатоцитами, которые имеют рецепторы, взаимодействующие с этими апопротеинами. Путём эндоцитоза остаточные ХМ попадают внутрь клеток, и ферментами лизосом белки и липиды гидролизуются, а затем утилизируются. Жирорастворимые витамины и экзогенный холестерол используются в печени или транспортируются в другие ткани.
Гиперхиломикронемия, гипертриглицеролемия. После приёма пищи, содержащей жиры, развивается физиологическая гипертриглицеролемия и, соответственно, гиперхиломикронемия, которая может продолжаться до нескольких часов.
Скорость удаления ХМ из кровотока зависит от:
активности ЛП-липазы;
присутствия ЛПВП, поставляющих апопротеины С-II и Е для ХМ;
активности переноса апоС-II и апоЕ на ХМ.
Генетические дефекты любого из белков, участвующих в метаболизме ХМ, приводят к развитию семейной гиперхиломикронемии - гиперлипопротеинемии типа I. У таких больных в постабсорбтивном периоде концентрация триацилглицеролов повышена (более 200 мг/дл), плазма крови по виду напоминает молоко и при оставлении на холоде (+4 °С) в ней всплывают белые жирные хлопья, что характерно для гипертриглицеролемии и гиперхиломикронемии.
В тяжёлых случаях при этом заболевании происходит отложение триацилглицеролов в коже и сухожилиях в виде ксантом, у пациентов рано нарушается память, появляются боли в животе из-за сужения просвета сосудов и уменьшения кровотока, нарушается функция поджелудочной железы, что часто бывает причиной смерти больных. Если концентрация триацилглицеролов в крови превышает 4000 мг/дл, то липиды откладываются в сетчатке глаза, однако это не всегда влияет на зрительную функцию. При лечении гиперхиломикронемий необходимо прежде всего
снизить потребление жиров с пищей, так как ХМ транспортируют экзогенные жиры.
57) Транспортные формы липидов крови. Липопротеиды — это транспортная форма липидов в крови, водорастворимость этих комплексов обеспечивает активное включение липидов плазмы в процессы метаболизма. Все липопротеиды содержат в себе одновременно триглицериды, фосфолипиды и холестерин. Липопротеины очень низкой плотности также главным образом содержат триглицериды, но эндогенного происхождения и являются их транспортной формой в крови. Липопротеины низкой плотности в своем составе в норме содержат до 45% холестерина, что преобладает над другими типами липидов в данном классе липопротеидов, поэтому данные липопротеины рассматривают как транспортную форму холестерина в крови. Липопротеины высокой плотности содержат больше всего фосфолипидов и являются их транспортной формой. В крови здорового человека, взятой натощак, содержатся только липопротеиды высокой, низкой и очень низкой плотности. Хиломикроны в ней отсутствуют. Они появляются только при нарушениях липидного обмена. В ряде патологических состояний в крови может обнаруживаться пятый класс липопротеинов — липопротеиды промежуточной плотности. Обычно они представляют собой промежуточные продукты превращения липопротеинов очень низкой и низкой плотности. Синтезируются липопротеиды высокой и очень низкой плотности в печени, а низкой — в плазме крови из липопротеидов очень низкой плотности. Все классы липопротеидов в большей или меньшей мере содержат холестерин. Но наиболее атерогенными из них являются ЛПНП и ЛППП. Единственный неатерогенный класс липопротеидов — это липопротеиды высокой плотности. Более того, они активно участвуют в выведении холестерина из клеток путем этерификации его, что облегчает доставку холестерина в печень, откуда он в составе желчи выводится в кишечник и удаляется из организма. Все другие классы, наоборот, транспортируют холестерин в клетки. Кроме того, липопротеиды высокой плотности являются транспортной формой фосфолипидов в крови. Фосфолипиды способствуют поддержанию холестерина во взвешенном состоянии, препятствуя его выпадению из кровяного русла. 58)Транспорт ХС по кровеносному руслу, роль ЛПОНП, ЛПНП, ЛПВП, ЛХАТ, роль в метаболизме ХС. Роль холестерина в развитии атеросклероза. Из организма человека ежедневно выводится около 1 г холестерола. Приблизительно половина этого количества входит в состав желчи и экскретируется с фекалиями. С мочой в сутки у человека выделяется около 1 мг холестерина. Со слущивающимся эпителием кожи теряется до 100 мг/сут. Четкого представления о нормальном уровне ХС в плазме нет. До недавнего времени нормальное содержание общего ХС плазмы крови составляло 4,0-6,5 ммоль/л, однако в настоящее время уровень ОХС > 5 ммоль/л считается повышенным. После однократного приёма жирной пищи уровень ХС в крови не повышается, однако если пищу с высоким содержанием насыщенных жиров употреблять регулярно и длительно, то это, несомненно, приведет к повышению содержания ХС тканях и в крови. Избыточный холестерин начинает накапливаться в клеточных мембранах и в сосудистой стенке. Тотальное накопление холестерина в организме называется «холестеринозом». Атеросклероз – это всего лишь одно из частных проявлений холестриноза. 90% холестерина накапливается в тканях организма и лишь 10% – в сосудистой стенке. Примечательно то, что мозговая ткань содержит около 30% всего тканевого холестерина. Старение клеточных мембран обусловлено в основном накоплением в них холестерина. Проницаемость всех клеточных мембран снижается. Снижается их чувствительность к гормонам и биологически активным веществам. Накопление холестерина в мембране эритроцита ухудшает процесс переноса кислорода и забора углекислого газа из тканей. Накопление холестерина в лимфоцитах приводит к снижению иммунитета и т.д. В плазме холестерин входит в состав сложных жировых соединений – липопротеинов и в небольшом количестве в свободном (неэтерифицированном) виде. Нарушения липидного обмена считаются одним из наиболее важных факторов развития атеросклероза. К атерогенным нарушениям липидного обмена относятся: Повышение уровня общего холестерина крови. Повышение уровня триглицеридов и липопротеинов низкой плотности (ЛНП) Снижение уровня липопротеинов высокой плотности (ЛВП). Связь повышенного уровня холестерина и атеросклероза: с одной стороны увеличение содержания холестерина в плазме крови считается фактором риска атеросклероза, с другой стороны атеросклероз часто развивается у людей с нормальным уровнем холестерина. Высокий уровень холестерина является лишь одним из многочисленных факторов риска атеросклероза (ожирение, курение, диабет, гипертония). Наличие этих факторов у людей с нормальным уровнем холестерина потенцирует негативное влияние свободного холестерина на стенки сосудов и тем самым приводит к образованию атеросклероза при более низких концентрациях холестерина в крови. Холестерин как «ремонтный» материал скапливается в местах микроповреждений сосудов и блокирует эти повреждения, выполняя гомогенную лекарственную роль. Именно поэтому атеросклероз наблюдается у людей с нормальным уровнем холестерина. У людей с повышенным уровнем проблема появляется быстрее. 59)Методы разделения липопротеидов на отдельные фракции. Электрофорез на бумаге, ультроцентрифугирование в плотных средах. Электрофорез Подготовка прибора: в камере необходимо поддерживать определенную влажность воздуха, чтобы предохранить фильтровальную бумагу от высыхания. Для этого прибор закрывают крышкой. Буферный раствор в разных отделах камеры должен иметь одинаковый уровень, чтобы избежать переливания жидкости через ленту. Подготовка бумаги: полосы фильтровальной бумаги смачивают раствором свежего буфера. Избыток буфера удаляют, отжимая полосы между лентами фильтровальной бумаги, и помещают их в электрофоретическую камеру. Бумажная лента может быть расположена горизонтально (горизонтальный электрофорез) или под углом (вертикальный электрофорез). При горизонтальном электрофорезе бумажная лента должна быть хорошо натянута. Нанесение сыворотки: на край ленты наносят по 5—10 мкл негемолизированной сыворотки в виде поперечной полосы, отступив на 0,5 см от краев. Проведение электрофореза: камеру закрывают крышкой и проводят электрофорез сыворотки в течение 6—24 ч при напряжении от 3 до 8 В на 1 см пути тока. Продолжительность электрофореза устанавливают в зависимости от силы и напряжения тока, вида буферного раствора, рН, длины, ширины и толщины бумажных полос. Обработка бумажных полос: выключают ток, вынимают ленты, сушат в сушильном шкафу в течение 10 мин при температуре 105 °С и красят, погружая в раствор красителя на 20 мин. Краситель сливают и ленты несколько раз промывают 20 г/л раствором уксусной кислоты до устранения фона (окрашенные участки бумаги, свободные от белка). Ленты вновь просушивают на воздухе. Расчет: измерение проводят на денситометре или на фотометре после элюирования. Результаты выражают в процентах. При ультрацентрифугировании различные фракции седиментируют с различной скоростью и образуют отдельные полосы, которые можно выделить. Во избежание перемешивания осажденных компонентов солевой раствор должен содержать инертный и хорошо растворимый материал (например, сахарозу), плотность которого постепенно увеличивается сверху вниз, формируя градиент плотности. При седиментации сквозь такие градиенты сахарозы различные компоненты клетки собираются в отдельные полосы, которые можно выделить. Скорость седиментации каждого из компонентов определяется его размерами и формой и обычно выражается с помощью коэффициента седиментации, обозначаемого S. Скорость вращения до 80000 об/мин, так что на разделяемые частицы действуют силы, превосходящие силу тяготения более чем в 500000 раз. Под действием столь больших сил даже сравнительно небольшие макромолекулы, такие, как тРНК или простейшие ферменты, разделяются и распределяются в строгом соответствии со своими размерами. Измерение коэффициента седиментации макромолекулярных комплексов обычно используют для определения их общей массы и количества входящих в их состав субъединиц. Ультрацентрифуга разделяет клеточные компоненты не только по массе, но и по плавучей плотности. В этом случае образец седиментирует в крутом градиенте, образованном высококонцентрированным раствором сахарозы или хлористого цезия. Компоненты клеток опускаются по градиенту до тех пор, пока не достигнут участка, плотность раствора в котором равна собственной плотности компонентов.
