
3. Химическая связь.
Примеры решения типовых задач
Пример 1.
Задание 3.1. Для двух, указанных по варианту молекул с позиций метода валентных связей показать образование молекул и ответить на следующие вопросы:
3.1.1 Каков тип гибридизации центрального атома в молекуле и валентный угол между связями?
3.1.2
Сколько
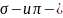 связей
содержит молекула?
связей
содержит молекула?
3.1.3. Определить полярность связей и полярность молекулы в целом.
3.1.4. Какова пространственная структура молекулы?
Для ответа на вопросы задания рассмотрим молекулу CdI2.
3.1.1.Сначала определяем тип гибридизации центрального атома. Для этого выписываем валентные элекроны центрального атома 48Cd.
5 s
s

4d
Затем электроны переводим в возбужденное состояние

5s
5p
4d
Отмечаем, что у Cd имеются две внешние орбитали: s и р. Представим s- и р-орбитали на рис. 2.1.

Рис.2.1
Далее «проводим» валентные электроны 53I. Так как I – p- элемент, то на рис. 2.1 к электронам Cd подрисовываем гантелеобразные p- орбитали йода,получаем схему молекулы CdI2 (рис. 2.2)
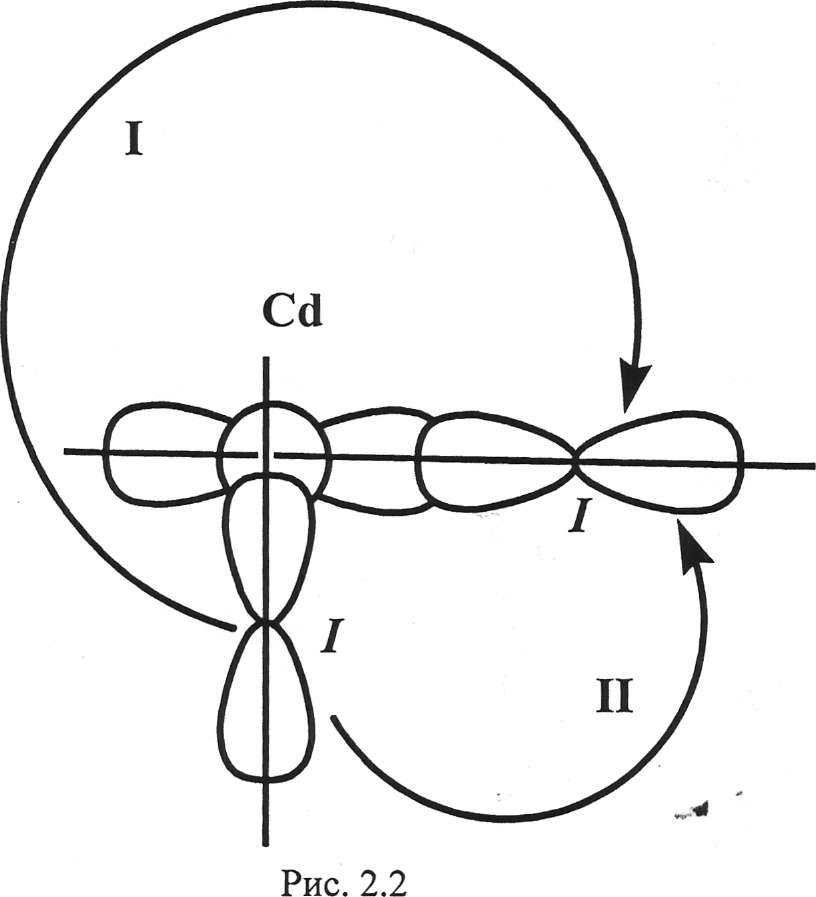
Как видно из рис. 2.2 силы отталкивания между электронными орбиталями на участках I и II сильно различаются. С одной р- орбиталью йода кадмий связывается с помощью s-орбитали, а с другой - с помощью p-орбитали. Связи отличаются по форме и энергии. Такая молекула не будет устойчивой. Для образования устойчивой молекулы в центральном атоме происходит процесс гибридизации валентных орбиталей, который показан на рис 2.3.
Рис.
2.3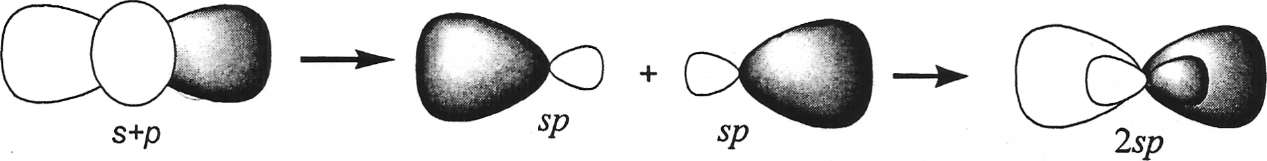
Таким образом, s + р = 2sp; по аналогии: s + р + р = 3sp2; s + р +
+ р + р + р = 4sp . Гибридные орбитали центрального атома - это заряженные поля и, отталкиваясь, они располагаются под определенным углом (валентный угол), чтобы образовалась устойчивая молекула: при гибридизации типа sp валентный угол составляет 180 sp2 - 120 sp3 - 109 Расположение гибридных орбиталей согласно этим валентным углам показано в табл. 2.1.
Таблица 2.1
Тип гибридизации: |
sp |
sp2 |
sp3 |
Расположение гибридных орбиталей в пространстве |
|
|
|
Теоретический валентный угол |
1800 |
1200 |
1090 |
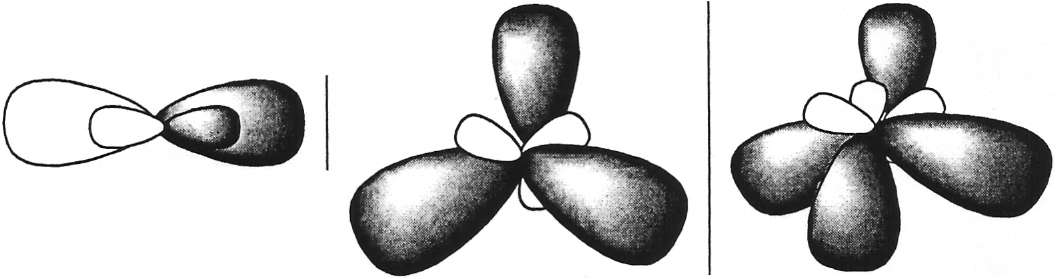
В соответствии с данными табл. 2.1 в молекуле Cdl2 реализуется sp-гибридизация, и валентный угол составляет 1800.
Чтобы изобразить молекулу в целом, остается показать перекрывание полученных гибридных орбиталей центрального атома с валентными орбиталями боковых атомов. В случае рассматриваемой молекулы CdI2 боковым атомом является 53I. Так как это р-элемент, то его валентные наружные электроны имеют орбиталь в виде гантели. В случае, если это будет s-элемент, форма орбитали имеет вид шара.
"Подводя" валентные орбитали йода к гибридным орбиталям кадмия, получаем схему молекулы CdI2 (рис. 2.4).
I Cd I
Рис.
2.4![]()
π - тип
Рис.
2.5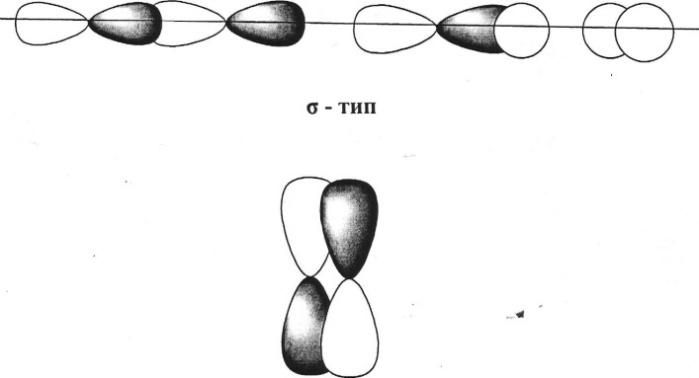
В случае CdI2 в молекуле две ковалентные связи сигма – типа.
Определим полярность. Полярность связана с наличием диполя, обусловленного оттягиванием валентных электронов в сторону более электроотрицательного атома (Приложение 1). В случае молекулы CdI2 более электроотрицательным элементом является йод. Поэтому связь Cd-I является полярной. Однако в целом молекула неполярна, так как при наличии двух диполей оттягивание электронов идет в обе стороны одинаково, и дипольные моменты взаимно компенсируются.
3.1.3. Разберем вопрос о пространственной структуре молекулы. Пространственная структура молекулы связана с типом гибридизации центрального атома и расположением боковых атомов вокруг центрального атома (табл. 2.2).
Таблица 2.2
Тип гибридизации |
sp |
sp2 |
sp3 |
sp3 |
sp3 |
Пространственная структура (форма) молекулы |
линейная |
треуголь-ная |
тетраэдрическая |
пирамидальная |
угловая |
Как видно из табл. 2.2 при sp3 гибридизации может реализоваться тетраэдрическая форма, пирамидальная или угловая в зависимости от числа боковых атомов (4, 3, 2 - соответственно). Из рис. 2.4 следует, что молекула CdI2 имеет линейную форму.
Рассмотрим еще одну молекулу OF2. Выписываем валентные электроны центрального атома - кислорода.
 2p
2p
2s
Далее надо перевести в возбужденное состояние. Однако, так как во втором слое нет свободных (пустых) орбиталей, эту операцию пропускаем. Если в качестве центрального атома будет похожий элемент, но находящийся в третьем периоде, то для таких простых молекул, которые предлагаются в задании не следует при возбуждении переводить электроны с 3s и 3p на 3d,так как на это необходимы большие затраты энергии.
Определяем тип гибридизации. Для этого производим «сложение»: s + p + p +p =4sp3 . при этом не следует писать 2s или 2p, так как речь идет не об электронах (на 2s подуровне), а их действительно 2, а об орбиталях, т.е пространства вероятного нахождения электронов. Рисуем четыре оси и гибридные облака. Подводим валентные орбитали F (это – p- элемент). Получаем угловую молекулу с теоретическим валентным углом 1090 (рис.2.7)
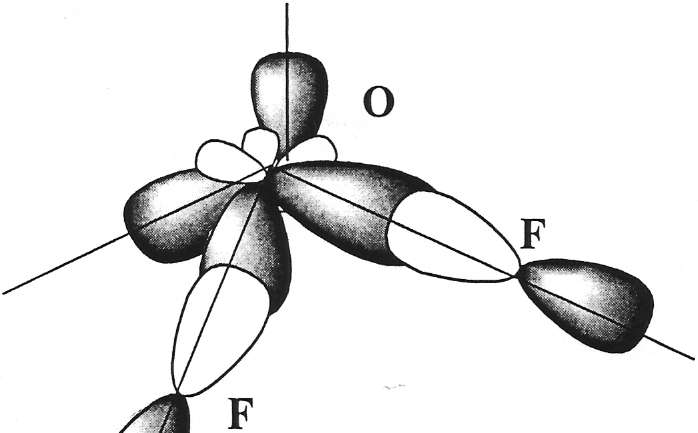
Рис. 2.7
Отдельные
связи О-F
- полярные, молекула в целом тоже полярна,
так как в вершине угла заряд со знаком
"+", а в противоположной стороне
"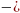 ".
Происходит оттягивание электронов в
сторону F,
т.е. образуется диполь.
".
Происходит оттягивание электронов в
сторону F,
т.е. образуется диполь.
Задачи для выполнения контрольной работы
3.1. С позиции метода ВС покажите образование предложенной молекулы. Какие орбитали соединяющихся атомов участвуют в образовании связей? Сколько связей содержит молекула? Какова пространственная структура молекулы? Каков тип гибридизации центрального атома в указанном соединении (если есть)? Отметьте полярность связей и полярность молекулы в целом.
Вариант |
Молекула |
Вариант |
Молекула |
41 |
H2O |
47 |
C2H2 |
42 |
PH3 |
48 |
SiF4 |
43 |
Cl2 |
49 |
OF2 |
44 |
O2 |
50 |
PCl3 |
45 |
NH3 |
51 |
AsH3 |
46 |
CF4 |
52 |
SbH3 |
53 |
BeBr2 |
62 |
BeI2 |
54 |
H2S |
63 |
SO2 |
55 |
N2 |
64 |
H2Te |
56 |
SiH4 |
65 |
HI |
57 |
BCl3 |
66 |
I2 |
58 |
H2Se |
67 |
C2H2 |
59 |
HBr |
68 |
CCl4 |
60 |
Br2 |
69 |
AlCl3 |
61 |
CO2 |
70 |
COCl2 |
3.2. Используя значение относительной электроотрицательности атомов, расположите соединения в порядке возрастания ионности связи. К какому из соединяющихся атомов смещено электронное облако и почему?
Вариант |
Соединение |
Вариант |
Соединение |
71 |
NH3,PH3,AsH3,SbH3 |
86 |
LiCl,NaCl,KCl,RbCl |
72 |
BeF2,BF3,CF3,NF3 |
87 |
BeF2,MgF2,CaF2,BaF2 |
73 |
H2O,H2S,H2Se,H2Te |
88 |
Rb2S,K2S,Na2S,Li2S |
74 |
CF4,NF3,OF2,F2 |
89 |
MnCl2,FeCl2,NiCl2,MgCl2 |
75 |
NaF.NaCl,NaBr,NaI |
90 |
OF2,TeF2,SeF2,SF2 |
76 |
H2O,Li2O,Na2O,K2O |
91 |
LiF,NaCl,KBr,RbI |
77 |
BeO,MgO,CaO,SrO |
92 |
BaI2,CaBr2,MgCl2,BeF2 |
78 |
CO2,SiO2,GeO2,SnO2 |
93 |
AlCl3,GaBr3,BF3,InI3 |
79 |
BeO,B2O3,CO2,NO2 |
94 |
CF4,GeBr4,SnI4,SiCl4 |
80 |
BH3,CH4,NH3,OH2 |
95 |
RbCl,SrCl2,InCl3,SnCl2 |
81 |
NaCl,MgCl2,AlCl3,SiCl4 |
96 |
SnCl4,SbCl3,TeCl2,ICl |
82 |
N2O,NO,NO2,N2O4 |
97 |
NaCl,CuCl,AgCl,AuCl |
83 |
B2O3,Al2O3,Ga2O3,InO3 |
98 |
Ta2O5,Nb2O5,As2O5,P2O5 |
84 |
Al2O3,SiO2,P2O5SO2 |
99 |
PbO2,SnO2,ZrO2,TiO2 |
85 |
SiH4,PH3,H2S,HCl |
100 |
SnI4,GeBr4,TiBr4,SiCl4 |
