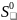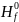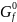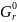- •Условные обозначения
- •Краткие сведения об основных термодинамических величинах
- •Химическое равновесие
- •Принципы определения термодинамических параметров химических реакций
- •Определение термодинамических параметров реакций модификации полимеров с использованием модельных превращений
- •Модификация карбоцепных ненасыщенных полимеров
- •Галобутилкаучуки
- •Гидрированные каучуки
- •Эпоксидированные каучуки
- •Присоединение меркаптанов
- •Модификация насыщенных карбоцепных полимеров
- •Хлорированный полиэтилен
- •Хлорсульфированный полиэтилен
- •Поливиниловый спирт
- •Модификация природных полимеров
- •Тринитроцеллюлоза
- •Триацетат целлюлозы
Модификация карбоцепных ненасыщенных полимеров
Наличие двойных углерод-углеродных связей в ненасыщенных карбоцепных полимерах создает условия их модификации за счет реакций радикального и ионного типа, затрагивающие эти центры. В настоящее время промышленно реализовано ряд процессов, которые позволяют целенаправленно изменять свойства ненасыщенных полимеров за счет их модификации. Рассмотрим некоторые из них.
Галобутилкаучуки
Бутилкаучук , получаемый катионной сополимеризацией изобутилена с 1-5% изопрена, содержит ненасыщенные изопренильные звенья. Эти фрагменты в макромолекулах бутилкаучука легко вступают в реакции радикального и электрофильного присоединения и замещения. При взаимодействии с галогенами (хлором, бромом) бутилкаучук легко образует галобутилкаучуки. В настоящее время до 40% производимого в мире бутилкаучука расходуется для производства галобутилкаучуков. Наибольшое значение приобрело производство хлор- и бромбутилкаучуков.
Хлорбутилкаучук. Хлорбутилкаучук впервые был описан фирмой “Esso Industrial and Engineering Co.Linden New Jersey” (США) в 1955 году. Работы этой фирмы привлекли всеобщее внимание специалистов в области химии полимеров, и это привело к тому, что хлорбутилкаучук в настоящее время производится во всех ведущих странах мира. В нашем регионе производство хлорбутилкаучука освоено ОАО “Нижнекамскнефтехим”.
Привлекательной стороной хлорбутилкаучука является то, что резины на его основе обладают высокой адгезией к металлам, они характеризуются повышенной газо- и влагонепроницаемостью. Они стойки к окислительной деструкции под действием кислорода, озона. Резины на основе хлорбутилкаучука обладают высоким модулем и прочностью при растяжении. Основным потребителем хлорбутилкаучука является шинная промышленность.
Хлорирование бутилкаучука ведется, как правило, элементным хлором. Ниже приведены элементарные стадии этого процесса.
Реакции начинаются по типу электрофильного присоединения по кратным связям. На первой стадии электрофильный агент – катион хлора – присоединяется по двойной связи изопренильного фрагмента в структуре бутилкаучука. Возникающий промежуточный карбениевый ион может претерпеть либо реакцию β-распада с отщеплением протона от соседнего атома углерода, либо присоединить анион хлора. Первое направление приводит к появлению хлораллильных фрагментов в структуре бутилкаучука..
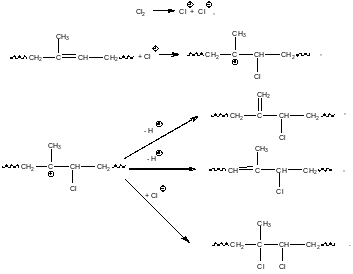
Второе направление приводит к образованию 1,2-дихлорпроизводных изопренильных звеньев. Таким образом, процесс хлорирования бутилкаучука протекает по двум направлениям – как реакция электрофильного замещения, и как процесс электрофильного присоединения. Основным направлением при взаимодействии хлора с бутилкаучуком является аллильное замещение (более 90%). В результате хлорирования бутилкаучука в его структуру вводится 1.1 – 1.3% хлора. Для анализа термодинамических закономерностей хлорирования бутилкаучука рассмотрим модельное превращение – хлорирование пропена, протекающее по следующим направлениям:

В таблице 1 приведены термодинамические параметры образования участников модельного превращения.
Таблица 1. Термодинамические параметры образования пропена, 1,2-дихлорпропана, 3-хлорпропена-1, хлора, хлористого водорода в состоянии идеального газа
Соединение |
|
|
|
|||
298К |
400К |
298К |
400К |
298К |
400К |
|
CH3CH=CH2 |
63.80 |
68.83 |
4.88 |
3.76 |
14.99 |
18.62 |
СH3CHClCH2Cl |
84.80 |
92.44 |
-39.60 |
-40.66 |
-19.86 |
-12.95 |
CH2=CH-CH2Cl |
73.29 |
79.18 |
-0.15 |
-1.04 |
10.42 |
14.18 |
Cl2 |
53.29 |
55.72 |
0.00 |
0.00 |
0.00 |
0.00 |
HCl |
44.64 |
46.69 |
-22.06 |
-22.13 |
-22.77 |
-23.01 |
В таблице 2 приведены термодинамические параметры реакции аллильного замещения атома водорода в пропене.
Таблица 2. Термодинамические параметры для реакции:
CH3CH=CH2 + Cl2 CH2=CH-CH2Cl + HСl
в газовой фазе
Параметр |
298К |
400К |
|
-27.34 |
-27.45 |
|
-26.79 |
-26.93 |
|
0.84 |
1.32 |
Kc |
1.321020 |
1.121015 |
В таблице 3 приведены термодинамические параметры для реакции образования 1,2-дихлорпропана.
Таблица 3. Термодинамические параметры для реакции:
CH3CH=CH2 + Cl2 СH3CHClCH2Cl
в газовой фазе
Параметр |
298К |
400К |
|
-34.85 |
-31.57 |
|
-44.48 |
-44.42 |
|
-32.29 |
-32.11 |
Kc |
4.481025 |
2.051017 |
Реакция аллильного замещения (таблица 2) протекает как высокоэкзотермичное превращение. Изменения энтропии в ходе этого взаимодействия незначительны. Это обстоятельство обусловлено тем, что в ходе реакции не происходит изменение числа частиц: из двух молекул реагентов образуются две молекулы продуктов. Поэтому в ходе взаимодействия не происходит потеря ни поступательных, ни вращательных степеней свободы движения, меняются незначительно лишь их численные значения. Определяющий эффект в свободную энергию реакции вносит энтальпия взаимодействия. Стандартные свободные энергии реакции являются большими отрицательными величинами. Это приводит к большим величинам констант равновесия превращения. Хотя с ростом температуры наблюдается уменьшение констант равновесия, тем не менее, их величины обеспечивают при указанных температурах практически необратимое протекание взаимодействия.
Выделение тепла в реакции 1,2-присоединения происходит в большей степени (таблица 3). Однако это взаимодействие характеризуется большой отрицательной величиной энтропии реакции. В данном превращении из двух молекул образуется одна молекула. Поэтому в ходе этого взаимодействия происходит потеря трех поступательных, двух вращательных степеней свободы движения. Это обстоятельство приводит к столь значительному понижению энтропии реакции.
Стандартная свободная энергия реакции в данном превращении является большей по сравнению с энтальпией реакции. Это обусловлено влиянием энтропийного члена на свободную энергию. Тем не менее, величина стандартной свободной энергии в реакции 1,2-присоединения является меньшей величиной, чем в реакции аллильного замещения. Поэтому реакция 1,2-присоединения характеризуется большими величинами констант равновесия по сравнению с реакцией аллильного замещения.
В реакциях хлорирования с позиций термодинамики более предпочтительным является образование 1,2-дихлорпроизводных, по сравнению с образованием продуктов аллильного замещения. Тот факт, что в реакциях хлорирования бутилкаучука наблюдается противоположное явление, указывает на то, что состав продуктов контролируется не термодинамическими эффектами, а кинетическими.
Бромбутилкаучук. Бромбутилкаучук впервые был описан фирмой “B.F.Goodrich Chemical Co.” В 1952 году. Бромбутилкаучук получают бромированием бутилкаучака элементным бромом. Процесс начинается с электрофильного присоединения катиона брома по кратной связи изопренильного фрагмента в структуре бутилкаучука. Элементарные стадии процесса бромирования бутилкаучука приведены ниже.
В качестве промежуточных продуктов в реакции бромирования образуются не карбениевые ионы, а циклические бромониевые ионы. Бромониевые ионы также имеют два пути дальнейшего реагирования: они могут подвергнутся реакции β-распада с отщеплением протона от соседнего атома углерода, либо они могут присоединить анион брома. Первое направление приводит к появлению фрагментов аллилбромида, второе – к 1,2-дибромпроизводным. Содержание брома в бромбутилкаучуке не превышает 2-3%. Из бромированных фрагментов 70-90% приходится на
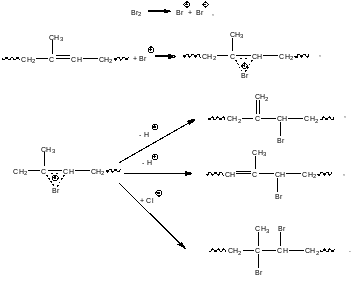
продукты аллильного замещения, а 30-10% - на продукты 1,2-присоединения. Связи углерод-бром по сравнению со связями углерод-хлор, естественно, являются менее прочными. Поэтому по сравнению с хлорбутилкаучуком бромбутилкаучук гораздо легче вступает с различные химические превращения.
Бромбутилкаучук обладает великолепными адгезионными свойствами ко многим металлам, он совместим со многими каучуками в любых соотношениях. Резины на основе бромбутилкаучука характеризуются повышенной химической, атмосферо- и теплостойкостью. Основным потребителем бромбутилкаучука является шинная промышленность.
Бромбутилкаучук производится в мире многими фирмами. В нашем регионе бромбутилкаучук промышленно выпускается ОАО “Нижнекамскнефтехим”.
Для анализа термодинамических закономерностей обсуждаемого процесса рассмотрим в качестве модельной реакции бромирование пропена, протекающее по следующим направлениям:

В таблице 4 приведены термодинамические параметры образования всех участников реакции. В таблицах 5 и 6 приведены термодинамические параметры модельных превращений.
Сопоставление термодинамических данных по хлорированию и бромированию показывает, что эти два процесса существенно отличаются друг от друга. Аллильное замещение под действием брома протекает с малым выделением тепла, в то время как в реакции с хлором наблюдался большой экзотермический эффект.
Таблица 4. Термодинамические параметры образования пропена, 3-бромпропена-1, 1,2-дибромпропана, брома и бромистого водорода в состоянии идеального газа
Соединение |
|
|
|
||||
298К |
400К |
298К |
400К |
298К |
400К |
||
CH3CH=CH2 |
63.80 |
68.83 |
4.88 |
3.76 |
14.99 |
18.62 |
|
CH2=CH-CH2Br |
75.80 |
81.85 |
11.80 |
7.25 |
19.11 |
22.50 |
|
СH3CHBrCH2Br |
89.90 |
97.88 |
-17.40 |
-25.77 |
-4.22 |
1.96 |
|
Br2 |
36.38 |
61.20 |
0.00 |
0.00 |
0.00 |
0.00 |
|
HBr |
47.44 |
49.49 |
-8.66 |
-12.44 |
-12.73 |
-13.34 |
|
Таблица 5. Термодинамические параметры реакции:
CH3CH=CH2 + Br2 CH2=CH-CH2Br + HBr ,
в газовой фазе
Параметр |
298К |
400К |
|
-8.61 |
-9.46 |
|
-1.74 |
-8.95 |
|
23.06 |
1.31 |
Kc |
2.17106 |
1.54105 |
Таблица 6. Термодинамические параметры реакции:
CH3CH=CH2 + Br2 СH3CHBrCH2Br ,
в газовой фазе
Параметр |
298К |
400К |
|
-19.21 |
-16.66 |
|
-22.28 |
-29.53 |
|
-10.28 |
-32.15 |
Kc |
1.381014 |
1.37109 |
Наблюдаемые различия связаны, в первую очередь с большими геометрическими размерами атомных орбиталей у атома брома по сравнению с атомом хлора. Возможность аллильного бромирования при низких температурах обусловлено исключительно тем, что это превращение имеет большую положительную величину энтропии реакции. Реакция аллильного бромирования характеризуется тем, что с повышением температуры сильно меняются как энтальпия, так и энтропия превращения. Если при 298К основной вклад в величину стандартной свободной энергии вносит энтропийный член (80%), то при 400К его вклад понижается до 5,5%. Реакция аллильного бромирования при низких температурах контролируется энтропийными эффектами, а при повышенных – энтальпийными. В реакциях аллильного хлорирования наблюдался лишь энтальпийный контроль реакции. Несмотря на то, что реакция аллильного бромирования характеризуется по сравнению с реакциями аллильного хлорирования большими величинами стандартной свободной энергии реакции, тем не менее данная реакция характеризуется такими величинами констант равновесия, которые способны обеспечить практически необратимое протекание взаимодействия.
Реакция 1,2-присоединения брома по кратной связи характеризуются по сравнению с реакциями аллильного замещения большими величинами тепловых эффектов, хотя выделение тепла происходит в меньшей мере, чем в реакции хлорирования (таблица 3). В этой реакции также происходит в зависимости от температуры существенное изменение энтропии. Однако в рассмотренном интервале температур основной вклад в величину свободной энергии реакции вносит энтальпийный член. Константы равновесия во всем рассмотренном интервале температур остаются большими и обеспечивают практически необратимое присоединение брома по кратной связи.
С позиций термодинамики в реакции бромирования, также как и в реакции хлорирования, присоединение по кратной связи является более благоприятным процессом, чем аллильное замещение. То, что в реакции бромирования образуются преимущественно продукты аллильного замещения, указывает на то, что в этих превращениях наблюдается не термодинамический контроль реакций, а кинетический.