
Коми филиал
Государственного бюджетного образовательного учреждения высшего профессионального образования «КИРОВСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ»
Министерства здравоохранения и социального развития Российской Федерации
Кафедра химии, физики, биологии
Методические указания для студентов 1 курса
Специальности (направления подготовки) 060101 – Лечебное дело
по самостоятельной внеаудиторной работе
по дисциплине Основы биоорганической химии
ТЕМА: Скорость химической реакции. Катализ. Химическое равновесие.
ЦЕЛЬ: Ознакомиться с основами химической кинетики и химического равновесия.
ЗАДАЧИ:
1. Изучить теоретический материал по теме занятия.
2. Научиться записывать кинетические уравнения.
3. Разобрать факторы, влияющие на смещение химического равновесия.
3. Подготовиться к выполнению лабораторной работы.
Студент должен знать:
1. до изучения темы: Типы химических реакции, выражение скорости химических реакций. Понятия катализатор и ингибитор. Принцип Ле Шателье.
2. после изучения темы: Особенности протекания различных типов реакций. Описание протекания во времени химических и биохимических реакций с помощью кинетических уравнений, а ферментативных процессов – с помощью уравнения Михаэлиса-Ментен. Описание положения равновесия обратимых реакций посредством константы химического равновесия и взаимосвязь константы с изменением энергии Гиббса для этих реакций.
СТУДЕНТ ДОЛЖЕН УМЕТЬ:
Определять тип химической реакции: простая, сложная, гомогенная, гетерогенная, последовательная, параллельная, последовательно-параллельная, циклическая, цепная, необратимая и обратимая, ферментативная, сопряженная, колебательная. Записывать кинетическое уравнение для реакции. Производить измерение и расчет скорости реакции.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ ВНЕАУДИТОРНОЙ РАБОТЫ СТУДЕТОВ ПО УКАЗАННОЙ ТЕМЕ
1) Ознакомиться с теоретическим материалом по теме занятия с использование конспектов лекций и рекомендуемой учебной литературы.
2) Ответить на вопросы самоконтроля
1. Что называется скоростью химической реакции, в каких единицах она измеряется? Что такое средняя и истинная скорость?
2. От каких факторов зависит скорость химической реакции?
3. Что называется константой скорости химической реакции? Ее физический смысл. От каких факторов она зависит?
4. Дать определение закона действующих масс. Напишите выражение закона действия масс для следующих реакций: 2 Н2 + О2 = 2 Н2О(пар) 2 SO2 + О2 = 2 SО3 2 СО = СО2 + С
2 ZnS + 3 О2 = 2 ZnO + 2 SO2
5. Во сколько раз следует увеличить концентрацию СО в системе 2СО = СО2 + С, чтобы скорость реакции увеличилась в четыре раза?
6. Во сколько раз надо изменить давление газовой смеси, чтобы скорость реакции 2SO2 + О2 = 2SO3 увеличилась в 27 раз? Что называют порядком реакции по веществу?
7. Как зависит скорость химической реакции от температуры? Что показывает температурный коэффициент скорости химической реакции?
8. На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 9 раз ( =3)?
9. Дать определение понятию "энергия активации". От каких факторов она зависит? Привести уравнение Аррениуса, связывающее ее с константой скорости.
10. Что такое катализатор? Почему введение катализатора в систему изменяет скорость химической реакции?
11. Какие реакции называются обратимыми? Каков физический смысл константы химического равновесия? От каких факторов она зависит?
12. Сформулировать общий принцип смещения равновесия (принцип Ле-Шателье). Определите, куда будет смещаться равновесие реакции N2 + ЗН2 <-> 2NH3 + 92 кДж, если:
а) увеличить концентрацию азота; б) увеличить давление в газовой смеси;
в) уменьшить объем; г) увеличить температуру.
3) Проверить свои знания с помощью тестового контроля
1. Величина ∆G0 при условии Кравн. = 1 равна
1) ∆G0 = 0 2) ∆G0 < 0 3) ∆G0 > 0 4) ∆G0 = 1
2. Равновесие реакции N2+3H2 →2NH3 + Q смещается
1) вправо при нагревании 2) влево при нагревании
3) вправо при понижении давления 4) влево при повышении давления
3. Условие, вызывающее смещение равновесия 2SO2 +O2 ↔ 2SO3 + Q в сторону обратной реакции (влево):
1) увеличение концентрации О2 2) нагревание
3) увеличение концентрации SO2 4) повышение давления
4. Закон, определяющий соотношение между равновесными концентрациями, называется:
1) законом сохранения масс 2) законом Рауля
3) законом действующих масс 4) законом Вант-Гоффа
5. Химическая кинетика изучает:
1) возможность протекания химических процессов
2) энергетические характеристики физических и химических процессов
3) скорости протекания химических превращения и механизмы этих превращений
4) тепловые эффекты биохимических процессов
6. Истинной (мгновенной) скоростью химической реакции называют:
1) количество вещества, прореагировавшего в единицу времени в единице объема
2) производную от концентрации реагирующего вещества по времени в единице объема
3) произведение концентраций реагирующих веществ, возведенных в степени, равные их стехиометрическим коэффициентам в реакции
4) изменение концентрации вещества за единицу времени в единице объема
7. Средней скоростью химической реакции называют:
1) количество вещества, прореагировавшего в единицу времени в единице объема
2) производную от концентрации реагирующего вещества по времени в единице объема
3) произведение концентраций реагирующих веществ, возведенных в степени, равные их стехиометрическим коэффициентам в реакции
4) изменение концентрации вещества за единицу времени в единице объема
8. Как изменяются скорости прямой и обратной реакции во время от начала реакции:
1) прямой – увеличивается, обратной - уменьшается
2) прямой – уменьшается, обратной - увеличивается
3) прямой и обратной - уменьшаются
4) прямой и обратной - увеличиваются
9. Для вычисления средней скорости гетерогенной реакции по изменению количества вещества (n) исходных веществ можно использовать уравнение:
![]()
10. Скорость химической реакции зависит от:
1) времени, температуры, концентрации
2) природы реагирующих веществ, температуры, концентрации
3) времени, температуры, концентрации, природы реагирующих веществ
4) температуры, концентрации
11. На скорость химической реакции влияют: а) природа реагирующих веществ; б) концентрация реагирующих веществ; в) катализатор; г) растворитель; д) температура
1) а, в, д 2) а, б, в, д 3) все факторы 4) б, в, д
12. Скорость измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени на единице поверхности раздела фаз для реакций:
1) гомогенных 2) гетерогенных
3) протекающих в газовой фазе 4) протекающих в твердой фазе
13. Скорость измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени в единице объема для реакции:
1) гомогенной 2) гетерогенной
3) на границе твердое тело-жидкость 4) на границе газ-жидкость
14. Единицы измерения скорости химической реакции: а) моль•л-1с-1; б) л•моль-1; в) с•моль-1; г) моль•л-1мин-1
1) а, г 2) а 3) б, в, г 4) а, в
15. Сформулируйте основной закон химической кинетики:
1) скорость сложной реакции, состоящей из ряда последовательных стадий, определяется скоростью самой медленной стадии
2) скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам в уравнении реакции
3) скорость реакции определяется изменением числа реагирующих молекул в единицу времени в единице объема
4) скорость реакции увеличивается при увеличении температуры
16. Закон действующих масс устанавливает зависимость между скоростью химической реакции и:
1) температурой
2) массой реагирующих веществ
3) концентрацией реагирующих веществ
4) количеством реагирующих веществ
17. Величина константы скорости реакции зависит от:
1) времени реакции, температуры, катализатора
2) природы реакции, температуры, концентрации
3) природы реакции, температуры, катализатора
4)природы реакции и температуры
18. Численное значение константы скорости и скорости совпадают:
1) если концентрации реагирующих веществ постоянны и равны единице
2) если концентрации реагирующих веществ постоянны
3) если реагирующие вещества и продукты реакции находятся в одной фазе
4) никогда не совпадают
19. Приводит к изменению константы скорости реакции: а) изменение температуры; б) изменение объема реакционного сосуда; в) введение в систему катализатора; г) изменение концентрации реагирующих веществ
1) а, в 2) б, г 3) а, б, г 4) а, в, г
20. Скорость реакции определяется изменением концентрации реагирующих веществ в единицу времени:
1) если давление системы постоянно
2) если объем системы постоянен
3) если температура системы постоянна
4) если энергия системы постоянна
21. При изменение количества вещества А скорость не изменится для реакции:
1) А (г) + В (г) → 2) 2А (г) + В2 (г) →
3) 2А (т) + 2В (г) → 4) 3А (г) + В2 (т) →
22. Сумму показателей степеней при концентрациях, входящих в кинетическое уравнение называют:
1) общим кинетическим порядком реакции
2) молекулярностью реакции
3) порядком реакции по веществу
4) стехиометрическими коэффициентами
23. Порядком реакции по веществу называют:
1) показатель степени при концентрации, входящей в кинетическое уравнение
2) сумму показателей степеней при концентрациях, входящих в кинетическое уравнение
3) сумму стехиометрических коэффициентов реакции
4) стехиометрический коэффициент вещества
24. Реакции радиоактивного распада относятся к реакциям:
1) 1 порядка 2) 3 порядка 3) 2 порядка 4) 0 порядка
25. Молекулярностью реакции называется:
1) число молекул, вступающих в данную химическую реакцию
2) сумма стехиометрических коэффициентов реакции
3) число молекул, реагирующих в одном элементарном химическом акте
4) произведение стехиометрических коэффициентов
26. Порядок и молекулярность всегда совпадают:
1) для сложных реакций
2) для простых реакций, протекающих в одну стадию
3) никогда не совпадают
4) для многостадийных реакций
27. Химические реакции по механизму протекания подразделяются на:
1) простые и сложные 2) гомогенные и гетерогенные
3) экзотермические и эндотермические 4) обратимые и необратимые
28. Простой химической реакцией называют реакцию, если:
1) продукт образуется в результате непосредственного взаимодействия частиц реагентов
2) конечный продукт получается в результате осуществления двух и более простых реакций с образованием промежуточных продуктов
3) исходные и конечные вещества находятся в одной фазе
4) продукт образуется в результате взаимодействия двух и более частиц
29. Сложной химической реакцией называют реакцию, если:
1) продукт образуется в результате непосредственного взаимодействия частиц реагентов
2) конечный продукт получается в результате осуществления двух и более простых реакций с образованием промежуточных продуктов
3) исходные и конечные вещества находятся в одной фазе
4) продукт образуется в результате взаимодействия двух и более частиц
30. Лимитирующей стадией сложной химической реакции называют:
1) самую быструю стадию
2) самую сложную стадию
3) стадию, имеющую низкую энергию активации
4) самую медленную стадию
31. Сопряженными называют:
1) реакции, в которых продукт первой элементарной стадии вступает в реакцию второй стадии и т.д., пока не образуется конечный продукт
2) реакции, в которых одно и тоже вещество одновременно взаимодействует с одним или несколькими реагентами, участвуя в одновременно протекающих реакциях
3) реакции, из которых одна вызывает протекание в системе другой реакции, не осуществимой в отсутствии первой
4) реакции, в которых продукты реакции разлагаются с образованием исходных веществ
32. Параллельными (конкурирующими) называют:
1) реакции, в которых продукт первой элементарной стадии вступает в реакцию второй стадии и т.д., пока не образуется конечный продукт
2) реакции, в которых одно и тоже вещество одновременно взаимодействует с одним или несколькими реагентами, участвуя в одновременно протекающих реакциях
3) реакции, из которых одна вызывает протекание в системе другой реакции, не осуществимой в отсутствии первой
4) реакции, в которых продукты реакции разлагаются с образованием исходных веществ
33. Скорость параллельных реакций определяется:
1) скоростью самой медленной стадии
2) разностью скоростей всех стадий
3) суммой скоростей всех стадий
4) скоростью самой быстрой стадии
34. Реакции, в которых продукт первой элементарной стадии вступает в реакцию второй стадии и т.д., пока не образуется конечный продукт, называются
1) параллельными 2) последовательными
3) сопряженными 4) конкурирующими
35. Реакции, в которых одно и тоже вещество одновременно взаимодействует с одним или несколькими реагентами, участвуя в одновременно протекающих реакциях, называются:
1) параллельными 2) последовательными
3) сопряженными 4) конкурирующими
36. С ростом температуры увеличивается скорость реакций:
1) экзотермических 2) экзо- и эндотермических
3) эндотермических 4) обратимых
37. Реакции гидролиза белков относятся к типу:
1) последовательных 2) параллельных
3) сопряженных 4) простых
38. Правило Вант-Гоффа формулируется:
1) при повышении температуры на 10 градусов скорость химической реакции увеличивается в 2-4 раза
2) для большинства химических реакций скорость реакции увеличивается с ростом температуры
3) при понижении температуры на 10 градусов скорость химической реакции увеличивается в 2-4 раза
4) скорость реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам реакции
39. При повышении температуры на каждые 10 градусов скорость большинства реакций:
1) увеличивается в 2-4 раза 2) не изменяется
3) уменьшается в 2-4 раза 4) увеличивается в 4-5 раз
40. Укажите возможные значения температурного коэффициента скорости реакций, протекающих в живых организмах:
1) 2-4 2) 7-9 3) больше 9 4) меньше 2
41. Увеличение скорости реакции с повышением температуры вызывается главным образом:
1) возрастанием числа активных молекул
2) ростом числа столкновений
3) увеличением средней кинетической энергии молекул
4) уменьшением энергии активации реакции
42. Повышение скорости реакции при введении катализатора объясняется: а) уменьшением энергии активации; б) увеличением средней кинетической энергии молекул; в) возрастанием числа столкновений; г) ростом числа активных молекул:
1) а, г 2) а, в, г 3) все 4) б, в, г
43. Действие катализатора на скорость химической реакции объясняется:
1) возникновением активированных комплексов
2) увеличением числа столкновений
3) возникновением активированных комплексов и изменением энергии активации
4) изменением энергии активации
44. Ускоряющее действие катализаторов обусловлено:
1) существенным уменьшением энергии активации соответствующего превращения
2) существенным увеличением энергии активации соответствующего превращения
3) образованием активированного комплекса
4) существенным увеличением числа столкновений
45. Действие ферментов: а) изменяет тепловой эффект реакции; б) снижает энергию активации; в) увеличивает скорость прямой и обратной реакции; г) является избирательным
1) все 2) б, в, г 3) б, г 4) а, б, г
46. Действие катализаторов: а) изменяет тепловой эффект реакции; б) снижает энергию активации; в) увеличивает скорость прямой и обратной реакции; г) является избирательным
1) все 2) б, в, г 3) б, г 4) б, в
47. При действии ферментов: а) снижается энергия активации; б) увеличивается скорость прямой и обратной реакции; в) изменяется тепловой эффект реакции; г) увеличивается скорость только прямой реакции
1) а, б, в 2) а, б 3) б, в 4) а, г
48. Повышение скорости биохимической реакции при введении в систему фермента объясняется: а) уменьшением энергии активации; б) увеличением средней кинетической энергии молекул; в) ростом числа активных молекул; г) уменьшением числа столкновений молекул
1) а, в 2) все 3) б, в 4) а, в, г
49. Мономолекулярной реакцией является:
1) 2SO2 + O2 → 2SO2 2) H2 + Br2 →2HBr
3) 2HI → H2 + I2 4) MgCO3 → MgO + CO2
50. Бимолекулярной реакцией является:
1) 2NO + O2 → 2NO 3) CaCO3 → CaO + CO2
2) SO2 + CI2 → SO2 4) N2 + 3H2 → 2NH3
51. Тримолекулярной реакцией является:
1) C2H4 + H2 → C2H6 3) CO + 2H2 → 2NH3
2) C + H2O → CO + H2 4) F2 + H2 → 2HF
52. Реакция H2 + I2 → 2HI является:
1) мономолекулярной 3) тримолекулярной
2) бимолекулярной 4) первого порядка
53. Реакция C4H10 → C2H6 + C2H4 является:
1) мономолекулярной 3) тримолекулярной
2) бимолекулярной 4) первого порядка
54. Реакция гидролиза крахмала крахмал →декстраны →мальтоза →глюкоза является:
сопряженной 3) параллельной
цепной 4) последовательной
55. Реакция образования оксигемоглобина Hb + O2 → HbO2 имеет общий порядок, равный:
1) 0 2) 0,5 3) 1 4) 2
56. Типы сложных реакций, к которым относится пероксидное окисление липидов:
1) сопряженные 3) параллельные
2) цепные 4) последовательные
57. Типы сложных реакций в организме с участием АТФ:
1) сопряженные 3) параллельные
2) цепные 4) последовательные
58. Фотохимической реакцией является
1) синтез АТФ 3) аэробное окисление глюкозы
2) образование озона 4) гидролиз АТФ
59. Общая схема ферментативного анализа:
1) S + E → P → E 3) S + E → SE → E + P
2) S → PS → P + S 4) P + E → PE → E + S
60. Кинетическим уравнением бимолекулярной реакции является:
1) υ = ķ · С1 · С2 2) υ = ķ · С1² · С2
3) υ = ķ · С1 · С2²
4) υ =
![]() · С1 · С2
· С1 · С2
61. Кинетическим уравнением мономолекулярной реакции является:
1) υ = ķ · С1 · С2 2) υ = ķ · С
3) υ = ķ · С1 · С2² 4) υ = ķ
62. Уравнение Аррениуса:
1)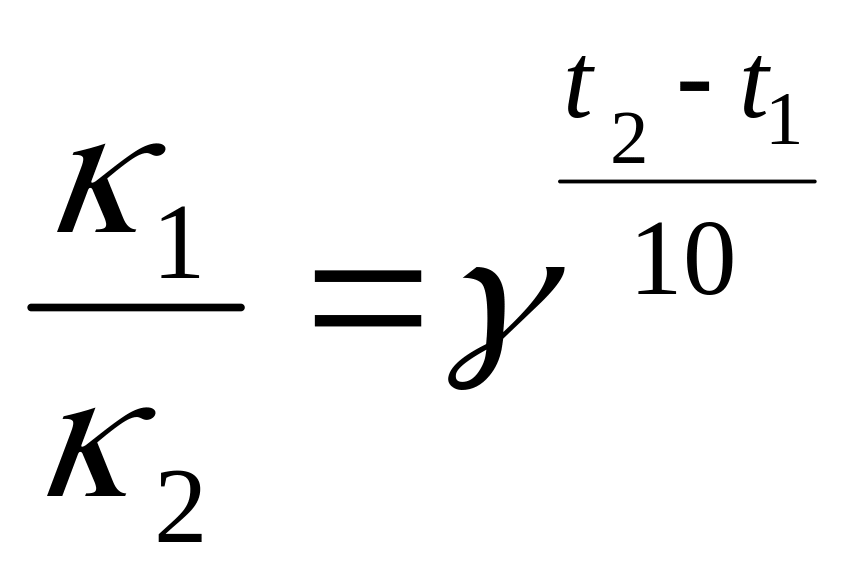 2) k1 = k2
· γ
2) k1 = k2
· γ![]()
![]() 3)
3)![]() 4) k = A
· e
4) k = A
· e![]()
63. Уравнение Вант – Гоффа:
1) 2) 3) k1 = k2 · γ 4) k = A · e
64. Уравнения Михаэлиса–Ментен показывает зависимость скорости ферментативной реакции от:
1) давления 3) концентрации
2) температуры 4) присутствия катализаторов
65. Уравнение Михаэлиса–Ментен:
1) υ max =
![]() 2) υcm
=
2) υcm
=
![]()
![]() 3) υcm
=
3) υcm
=
![]() 4) υ max = =
4) υ max = =
![]()
66. При увеличении концентрации реагента в 3 раза скорость реакции I порядка:
1) уменьшается в 3 раза 3) увеличивается в 3 раза
2) увеличивается в 9 раз 4) уменьшается в 9 раз
67. При увеличении концентрации реагентов в 2 раза скорость реакции II порядка:
1) увеличивается в 2 раза 3) уменьшается в 4 раза
2) увеличивается в 4 раза 4) уменьшается в 2 раза
68. Уравнение Вант-Гоффа показывает зависимость скорости реакции от:
1) давления 3) концентрации
2) температуры 4) размеров реагирующих веществ
69. Температурный коэффициент в уравнении Вант – Гоффа может меняться в:
1) 1 – 2 раза 3) 2 – 6 раз
2) 2 – 4 раза 4) 2 – 8 раз
70. При повышении температуры на 30оС скорость реакции с температурным коэффициентом γ=2:
1) увеличится в 5,48 раз 3) увеличится в 8 раз
2) увеличится в 6 раз 4) уменьшится в 15 раз
4) Выполнить следующие задания - подготовиться к лабораторной работе «Изучение кинетики реакции разложения тиосульфата натрия в кислой среде».
Опыт 1. Исследование влияния концентрации тиосульфата натрия на скорость его разложения в кислой среде.
Концентрация серной кислоты остается постоянной. Изменяется только концентрация Na2S2O3.
а) Заполните 5 пробирок первого ряда раствором тиосульфата натрия и водой в соответствии с таблицей 1, чтобы суммарный объем был равен 8 мл.
б) Заполните 5 пробирок второго ряда раствором серной кислоты согласно таблице 1.
в) Влейте раствор Na2S2O3 из первой пробирки в пробирку с серной кислотой, отметьте время начала сливания растворов ().
г) Продолжайте отчет времени до появления молочно-голубой опалесценции ( к). Время реакции образования серы: ∆ к 0 выразите в секундах и занесите в таблицу 1.
д) Рассчитайте концентрацию реагентов в реакционной системе с учетом разбавления:
![]() ,
,
где С0 и V0 - исходный концентрации и объемы растворов тиосульфата и серной кислоты, взятые для опыта; V р-ра – суммарный объем раствора. Данные запишите в таблицу 1.
е) Значение скорости реакции пропорционально величине 1/∆. Вычислите эту величину.
ж) Аналогичные эксперименты проведите с другими приготовленными растворами. Результаты экспериментов и расчетов занесите в таблицу 1.
Опыт 2. Исследование влияния концентрации серной кислоты на скорость разложения тиосульфата натрия.
Концентрация Na2S2O3 остается постоянной, а меняется концентрация серной кислоты.
а) Заполните два ряда по 5 пробирок согласно таблице 2.
б) Растворы серной кислоты добавьте к растворам тиосульфата натрия. Заметьте время начала реакции и время появления молочно-голубой опалесценции, аналогично опыту 1.
в) Результаты наблюдений и вычислений занесите в таблицу 2.
Опыт 3. Исследование влияния температуры на скорость химической реакции разложения тиосульфата натрия в кислой среде.
а) Заполните 3 пробирки первого ряда раствором тиосуьфата натрия и водой, а 3 пробирки второго ряда – раствором серной кислоты, согласно таблице 1 пробирка №5.
б) При комнатной температуре реакцию проводите путем быстрого приливания раствора тиосульфата к серной кислоте. Отметьте время начала сливания растворов 0.
в) Конец реакции к определяют по появлению молочно-голубоватой опалесценции раствора. Время реакции ∆ к 0 занесите в таблицу 3.
г) Проведите такие же опыты при температурах на 100 и 200С выше комнатной. Для этого надо каждую пару пробирок с солью и кислотой предварительно выдержать около 5 минут в стакане с водой требуемой температуры. Воду в стакане можно подогреть путем добавления горячей воды.
д) Не вынимая пробирку с серной кислотой из воды, быстро влить в нее раствор тиосульфата, отметить время начала опыта и время появления опалесценции. Результаты внести в таблицу 3.
