
- •Подготовка к коллоквиуму
- •1.3. Определение точки эквивалентности в титриметрических методах
- •Основные расчетные формулы в титриметрии
- •Приемы титрования
- •Методы титриметрического анализа
- •Титрование сильной кислоты сильной щелочью и наоборот:
- •Титрование слабой кислоты сильной щелочью:
- •Титрование слабого основания сильной кислотой:
Подготовка к коллоквиуму
Количество вещества пропорционально числу элементарных объектов. Обозначают эту величину п(х), где х - химическая формула элементарного объекта. Единицей измерения количества является моль. Один моль вещества содержит 6,022-1023 элементарных объектов (атомов, молекул, ионов, электронов и других элементарных частиц). В количественном анализе часто используют и дольную единицу - миллимоль (ммоль): I моль * 1000 ммоль.
Молярная масса М(х) характеризует массу единицы количества вещества (I моль) и определяется как отношение массы вещества к его количеству п(х):
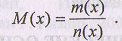
Массу обычно измеряют в граммах или миллиграммах, а молярную массу выражают в г/моль или мг/ммоль.
Молярная концентрация показывает количество растворенного вещества в единице объема раствора.
Молярная концентрация обозначается С(х) и записывается соответственно определению как:
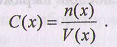
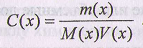
Численные значения молярной концентрации выражают в моль/л или ммоль/мл.
Растворы с молярной концентрацией атомов,молекул, ионов называют молярными. 0,1моль/л =0,1M (здесь буква М обозначает «молярный»).
Нормальная концентрация показывает количество эквивалентов растворенного вещества в единице объема раствора.
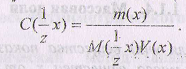
В системе СИ под эквивалентом понимают некую реальную или условную частицу, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентной одному иону водорода (в кислотно-основных реакциях) или одному электрону (в окислительно-восстановительных реакциях). Эквиваленты веществ не являются постоянными, они зависят от типа реакции, в которой участвуют эти вещества. Единицы измерения нормальной концентрации: моль/л или ммоль/мл.
Молярная масса эквивалента М(1/z x) связана с молярной массой вещества х соотношением (f=1/z фактор эквивалентности)
![]()
Когда фактор эквивалентности равен единице, нормальная концентрация равна молярной.
 где nH
число ионов водорода принимающих участие
в реакции
где nH
число ионов водорода принимающих участие
в реакции
Растворы с нормальной концентрацией называют нормальными.
I моль/л = I н (буква н обозначает нормальную концентрацию).
Массовая концентрация Т(х), или mump вещества, выражает концентрацию в единицах массы вещества, растворенного в единице объема раствора:

Единицы измерения: г/л, мг/мл, г/мл, мкг/мл.
Титр по определяемому веществу Т(R/х) показывает, какая масса анализируемого вещества Т(х) реагирует с I мл рабочего раствора титранта R:
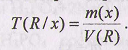
Зная T(R/x) и объем (мл) рабочего раствора V(R), затраченного на титрование, рассчитывают массу определяемого вещества в граммах:
![]()
Массовая доля w(x) вещества показывает, какую часть составляет масса вещества х от общей массы (mобщ-) раствора или смеси веществ:
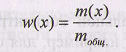 .
.
Основной единицей измерения является единица.
В количественном анализе массовую долю, как правило, измеряют в процентах (поэтому иногда ее называют процентной концентрацией). Она характеризует содержание компонента как в твердом веществе, так и в растворе:
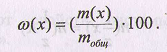
Плотность раствора р характеризует массу единицы объема раствора:
![]()
Используют единицу измерения г/см3, совпадающую с единицей измерения титра раствора (г/мл). Однако эти понятия не тождественны, поскольку масса раствора включает массу растворителя и растворенных веществ. Массовая же концентрация (титр) характеризует только массу растворенного вещества в единице объема.
Титриметрический метод анализа основан на измерении объема реагента с точно известной концентрацией (титранта), пошедшего на реакцию с определяемым веществом. Процесс постепенного прибавления титранта к раствору определяемого вещества называется титрованием. Титрование продолжают до достижения точки эквивалентности, то есть такой точки, в которой количество титранта химически эквивалентно количеству определяемого вещества (закон эквивалентных соотношений). Этот закон выражается формулой
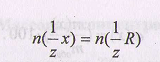
(степень оттировывания равна единице).
Степень оттитровывания - это отношение количества добавленного титранта к количеству определяемого вещества.
До точки
эквивалентности в растворе практически.
отсутствует титраит, а после точки
эквивалентности -определяемое вещество.
Состояние равновесия, устанавливающееся
в растворе после добавления каждой
порции титранта, до достижения точки
эквивалентности описывается свойствами
системы титруемого вещества, после
точки эквивалентности (в области избытка
титрующего вещества) - свойствами системы
титранта. Такая смена систем равновесий
в точке эквивалентности обусловливает
резкое изменение свойств системы (рН,
рМ, потенциал
(Е) и др.). Обычно рассматривают изменение
свойства системы в пределах 0,999-1,001
степени оттитровывания.
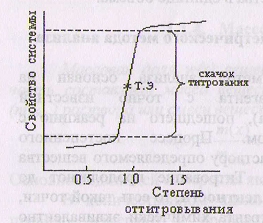
Резкое изменение изучаемого свойства вблизи точки эквивалентности называют скачком титрования. Наглядно этот скачок виден на кривой титрования, которая представляет собой графическое изображение процесса титрования Величина скачка зависит от свойств системы «определяемое вещество - титрант».
Титриметрические методы анализа основаны на использовании следующих типов химических реакций: кислотно-основных, окислительно-восстановительных, комплексообразования и осаждения.
