
- •Введение
- •Цель работы
- •Основные задачи исследования
- •Глава 1. Литературный обзор § 1.1 Система крови
- •§ 1.2 Основные функции крови [1]:
- •§ 1.3 Форма и строение эритроцитов.
- •§ 1.4 Строение и функции гемоглобина.
- •§1.5 Разрушение эритроцитов
- •§1.6 Процессы энергетического метаболизма и основные энергетические параметры эритроцитов.
- •Глава 2. Теоретическая часть § 2.1 Выбор физической модели кинетики энергетического метаболизма.
- •§ 2.2 Факторы, способствующие переходу метаболизма эритроцитов из состояния с высокой концентрацией атф в устойчивое состояние с низкой концентрацией атф
- •§ 2.3 Постановка экспериментальных задач
- •§ 2.4 Неравновесные процессы, протекающие в плазме пробы крови после ее взятия у донора, приводящие к изменению метаболизма эритроцитов
- •Глава 3. Экспериментальная часть § 3.1 Цели экспериментальных работ
- •§ 3.2 Используемые приборы и установки
- •§ 3.3 Используемые материалы
- •§ 3.4 Методики проведения экспериментальных работ
- •§ 3.5 Результаты экспериментов и их обсуждение
- •§ 3.6 Выводы
- •§ 3.7 Некоторые практически важные замечания
- •Заключение
- •Список литературы
§1.5 Разрушение эритроцитов
Известно, что эритроциты живут 2-3 месяца [3]. Основной причиной ухода их из кровяного русла является потеря отрицательных зарядов сиаловых кислот. Отбор из кровяного русла функционально неспособных эритроцитов осуществляется по нативности сиаловых кислот на нитях гликофорина в тонких (2-3 мкм диаметр) капиллярах микроциркуляционной сети крови, в основном в селезенке, а также легких и печени [3].
§1.6 Процессы энергетического метаболизма и основные энергетические параметры эритроцитов.
В цитоплазме эритроцитов в процессах анаэробного усвоения молекул глюкозы синтезируются основной макроэрг – АТФ и энергетические потенциалы НАДФ-Н и НАД-Н. С помощью этих соединений обеспечиваются энергией главные процессы, связанные с жизнеобеспечением и функциональной деятельностью эритроцитов. Концентрация АТФ (в дальнейшем, nАТФ) является основным энергетическим параметром эритроцита. Энергия, выделяющаяся при разрыве макроэргической связи АТФ, обеспечивает активный транспорт катионов через мембрану, поддержание оптимального соотношения концентраций К+ и Na+ (поддержание нормальной работы Na+/К+каналов), сохранение формы и целостности мембраны эритроцита. НАД-Н участвует в метаболизме гемоглобина, предотвращая окисление его в метгемоглобин, а НАДФ-Н участвует в метаболизме липидов.
Атауллаханов Ф.И.
выполнил ряд фундаментальных работ
[12, 13], в которых использовал и
усовершенствовал модель кинетики
метаболизма эритроцитов, представленную
в работах Селькова Е.Е. [14]. Он провел
теоретические и экспериментальные
исследования, касающиеся процессов
энергетического метаболизма эритроцитов.
В
полном объеме представил
биохимию
этих
процессов, описал
соответствующие реакции и участвующие
в них ферменты.
В частности, исследовал процессы
поддержания постоянства объема
эритроцитов, обеспечивающие их целостность
клеток. Рассмотрел кинетику обмена АТФ
в этих клетках и связал ее с механизмом,
обеспечивающим постоянство объема
эритроцитов. Показал, что постоянство
объема связано с поддержанием на
постоянном уровне величины энергетического
заряда φ=![]() ,
где
,
где
![]() ,
,
![]() ,
,
![]() – концентрации АТФ, АДФ и АМФ
соответственно.
– концентрации АТФ, АДФ и АМФ
соответственно.
Фок М.В. в своих исследованиях [10] кинетики процессов метаболизма клеток, в том числе эритроцитов, графическим методом показал кинетику основных процессов метаболизма, обеспечивающих гомеостаз величин кислотности (рН) и концентрации АТФ (nАТФ) в цитоплазме клеток в состоянии покоя. На основании этого он объяснил принцип действия механизма стабилизации этих параметров. Для этого была рассмотрена кинетика метаболизма эритроцитов изменения каждого из указанных параметров как функции рН и nАТФ, при постоянстве всех других параметров клетки:
скоростей притока (V+) и стока (V-) ионов Н+ от значений самих параметров рН и nАТФ в цитоплазме;
скоростей синтеза (V+) и расхода (V-) молекул АТФ от рН и nАТФ в цитоплазме.
Глава 2. Теоретическая часть § 2.1 Выбор физической модели кинетики энергетического метаболизма.
Метаболизм большинства соматических клеток, выполняющих определенные функции в организме, описывается огромным количеством параметров (концентраций ферментов, субстратов, промежуточных продуктов многостадийных реакций и т.д.), что, как правило, существенным образом затрудняет создание математической модели их состояний. Исключение составляют только отдельные виды клеток с простейшим метаболизмом, к которым относится эритроцит. Однако физические модели, основанные на качественном анализе закономерностей протекания конкретных процессов метаболизма, могут дать значимые результаты для решения фундаментальных и прикладных задач. В данной работе использовались только физические модели, которые более просты и наглядны.
В литературе
наиболее известна модель Селькова [14],
используемая в работе Атауллаханова
Ф.И. [13]. Математическая модель сложного
равновесного процесса усвоения глюкозы
по пути Эмбдена-Мейэргофа представлена
системой уравнений, описывающих каждую
реакцию последовательного превращения
молекулы глюкозы в лактат. Расчеты
приводятся при постоянном значении рН
и при постоянстве пула ферментов и
регуляторных субстанций, участвующих
в этих реакциях. В результате получают
зависимость скоростей утилизации
глюкозы от концентрации АТФ в цитоплазме
эритроцита, то есть зависимость скорости
V+
синтеза АТФ от его концентрации nАТФ.
В модели принято, что расход АТФ обусловлен
суммарной тратой этого макроэрга в
простых ферментативных реакциях, идущих
через комплекс. Следовательно, скорость
V-
трат АТФ в зависимости от nАТФ
в цитоплазме эритроцита изменяется по
закону Михаэлиса-Ментен:
![]() ,
,
где
![]() –
скорость
траты АТФ,
–
скорость
траты АТФ,
![]() – концентрация АТФ, величины km
и А – константы. В данной модели km>>
nАТФ,
тогда
– концентрация АТФ, величины km
и А – константы. В данной модели km>>
nАТФ,
тогда
![]() .
Данная модель представлена на рис.3.
.
Данная модель представлена на рис.3.
Рис. 3. Модель кинетики метаболизма
эритроцита, принятая в работах
Атауллаханова Ф.И. [14]. Приведена
зависимость скорости гликолиза АТФ V+
(ммоль/л*ч) и скорости его трат V-
от концентрации АТФ (ммоль/л).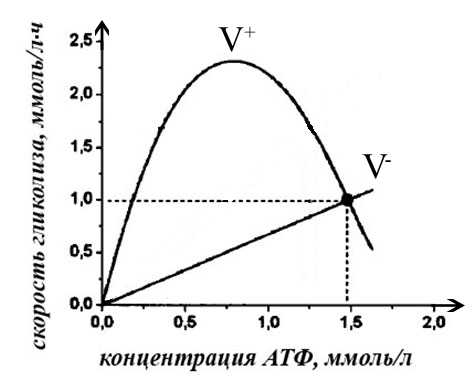
П![]() ри
пересечении кривых V+
и V-
реализуется только одна стационарная
точка. Устойчивость точки определяется
по двум условиям устойчивости по
Ляпунову:
ри
пересечении кривых V+
и V-
реализуется только одна стационарная
точка. Устойчивость точки определяется
по двум условиям устойчивости по
Ляпунову:
– первое условие устойчивости,
где αi
– р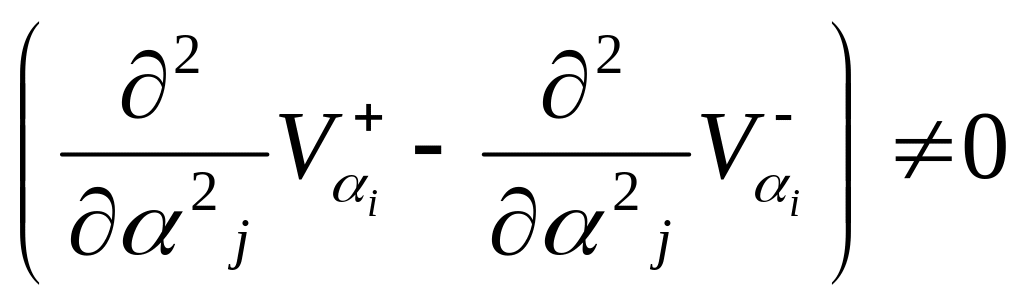 ассматриваемый
параметр,
ассматриваемый
параметр,
![]() и
и
![]() –соответственно, скорости притока и
убыли данного параметра, αj
– параметр,
по которому проверяется устойчивость,
при этом i может быть равно j.
–соответственно, скорости притока и
убыли данного параметра, αj
– параметр,
по которому проверяется устойчивость,
при этом i может быть равно j.
– второе условие устойчивости.
Стационарная точка является устойчивой по условию (1). Видно, что данная модель не допускает существования большего количества устойчивых стационарных точек.
Следовательно, можно заключить, что для установления возможности существования устойчивых точек с помощью моделей, в которых допускается свободной одна переменная, достаточно знать вид кривых зависимостей скоростей синтеза V+ и расхода V- АТФ от его концентрации и их взаимное расположение. Такой графический метод анализа кинетики метаболизма наиболее нагляден и позволяет на качественном уровне устанавливать наличие устойчивых стационарных точек, поэтому в дальнейшем будет решаться поставленная задача данным методом, без привлечения сложных математических уравнений.
Другой физической моделью, схожей с предыдущей, является модель, приведенная в работах Фока М.В. и его соавторов [10]. Она используется для анализа кинетики энергетического метаболизма и представлена на рис. 4. Данная модель принята за основную в данном исследовании.
Рис. 4. Модель кинетики метаболизма
эритроцита, принятая в работах Фока
М.В. [14]. Приведена зависимость скорости
(V+) синтеза АТФ и
скорости (V-) его
трат (отн. ед.) от концентрации АТФ (nАТФ)
(ммоль/л).

Зависимости скоростей синтеза (V+) и расхода (V-) АТФ от его концентрации (nАТФ) в цитоплазме при постоянстве всех остальных параметров, таких как рН, концентраций всех ферментов, количества аденозиновых оснований (АДФ и АМФ) и запасов неорганического фосфата, имеют вид, представленный на рис. 4. Свободным параметром, также как и в первой модели, является концентрация АТФ в цитоплазме.
Кривая зависимости V+ от nАТФ имеет колоколообразную форму с максимумом. При нулевой концентрации АТФ в цитоплазме скорость синтеза V+ АТФ имеет ненулевое значение. Это обусловлено тем, что в рассматриваемых условиях (заданном значении рН, концентрации АДФ, ограниченном запасе неорганического фосфата и при нулевом значении концентрации АТФ) в результате теплового движения субстраты (АДФ и молекул фосфата) сталкиваются, вследствие чего преодолевается активационный барьер, и в результате, происходит синтез АТФ. Дальнейший ход кривой зависимости скорости (V+) синтеза АТФ от nАТФ определяется автокаталитической реакцией синтеза, в которой часть выработанного АТФ расходуется в процессах гликолитических реакций. Поэтому скорость синтеза АТФ сначала зависит линейно от nАТФ, а затем экспоненциально. Далее по мере истощения запасов органического фосфата достигается максимум скорости синтеза АТФ. Дальнейший спад кривой зависимости V+ АТФ от nАТФ обусловлен, в основном, истощением запасов неорганического фосфата. При нулевой скорости синтеза в области высоких значений nАТФ все запасы неорганического фосфата израсходованы.
Зависимость скорости V- расхода АТФ от nАТФ, также как и в первой модели изменяется по закону Михаэлиса-Ментен: , где – скорость траты АТФ, – концентрация АТФ, величины km и А – константы. В данной модели нет условия km>> nАТФ, и кривая скорости расхода V- при высоких значениях nАТФ, отклоняясь от прямой, выходит на постоянный уровень.
Рис. 4 демонстрирует один из возможных вариантов взаимного расположения кривых зависимостей скоростей V+ синтеза АТФ и расхода V- АТФ от nАТФ, которые при пересечении дают три стационарные точки: две из которых (1 и 3), устойчивы по условию (1), одна (точка 2) неустойчивая и является дискриминационной. Таким образом, вторая модель допускает существование второй устойчивой точки в областях низких значений nАТФ.
Если кинетику метаболизма эритроцитов крови в организме можно представить в виде, приведенном на рис. 4, то их состоянию in vivo соответствует точка 3. Это доказывают эксперименты с отмытыми эритроцитами, приведенные в работах Атауллаханова Ф.И. [12, 13].
С помощью данной модели Фока М.В. можно проанализировать возможность перехода метаболизма эритроцита из одного устойчивого состояния в другое. Первый способ осуществления перехода – это запуск быстрых неравновесных процессов (например, при добавлении в пробу крови ингибиторов АТФ), которые могут привести к существенному уменьшению концентрации АТФ, причем значения других параметров не успевают изменяться. При этом метаболизм эритроцитов перейдет в другое устойчивое состояние с гомеостазом концентрации АТФ в области низких значений. Но на практике такой вариант трудно реализуем.
Другой способ осуществления перехода – это кратковременное изменение регулирования (активации или ингибирования) процессов синтеза и трат АТФ, в результате которого изменяется взаимное расположение кривых V+ и V-. Рис. 5 иллюстрирует такое изменение кинетики процессов, которое приводят к упомянутому выше переходу. Условия, при которых производится анализ этих изменений, соответствуют условиям основной модели, используемой в данной модели.
Рис.5. Принцип перехода метаболизма
эритроцитов из одного устойчивого
состояния в другое при различных уровнях
регулирования процессов а) синтеза АТФ
при неизменной активности его трат; б)
трат АТФ при неизменной активности его
синтеза.
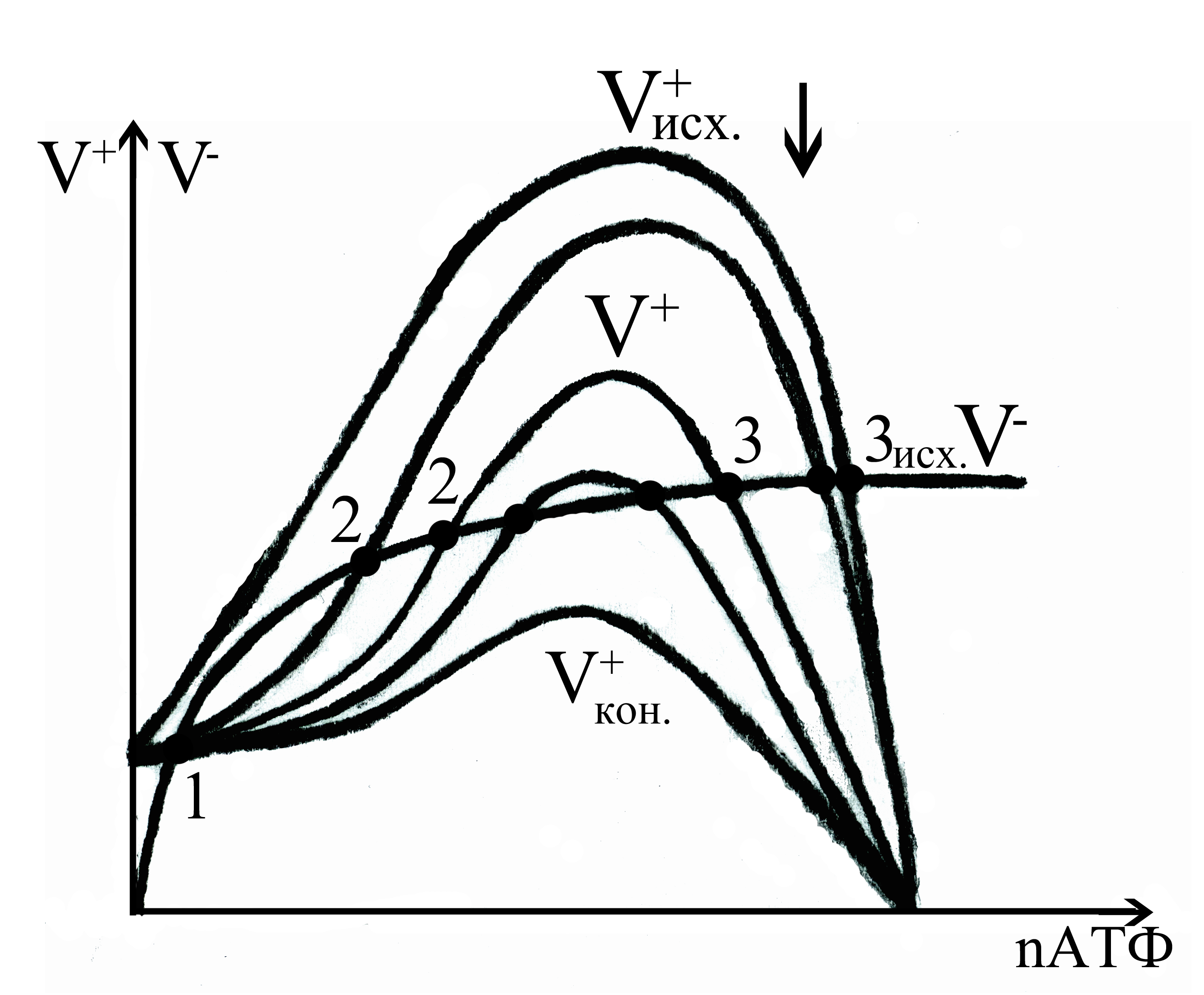

На рис. 5 показаны семейства кривых зависимостей скоростей синтеза V+ и расхода V- АТФ от nАТФ при различных уровнях регулирования процессов энергетического метаболизма эритроцитов. На рис. 5а изображено семейство кривых V+, соответствующих разным уровням активности процесса синтеза АТФ, при неизменном уровне активности процесса трат АТФ. При этом положение кривой зависимости скорости расхода V- от nАТФ неизменно для всех рассматриваемых кривых V+. На рис. 5б показано семейство кривых V-, соответствующих разным уровням активности процессов трат АТФ при неизменном уровне активности процесса синтеза АТФ. Соответственно, положение кривой V+ неизменно для всех рассматриваемых кривых V-.
Рассмотрим случай регулирования активности процесса синтеза АТФ (рис. 5а). Пусть процесс синтеза АТФ активирован. Этому соответствует верхняя кривая на рис.5а. Система имеет одну устойчивую стационарную точку 3. Допустим, что активирование постепенно снимается. Кривая V+ переходит в положение под кривой V+исх.. Видно, что появляются ещё 2 стационарные точки, одна (точка 1) из которых, при низких значениях, устойчива, а вторая (точка 2) – не устойчива (дискриминационная). Дальнейшее смещение кривой V+ может быть обеспечено продолжающимся снятием активирования и включением ингибирования процесса синтеза АТФ. При смещении кривой V+ вниз, в сторону все более низких скоростей гликолиза, устойчивая точка 3 смещается в сторону низких значений nАТФ, а дискриминационная точка 2 в сторону высоких его значений, затем 2-я и 3-я точки сливаются, а при дальнейшем усилении ингибирования исчезают. В конечном итоге остается одна устойчивая точка 1 в области низких концентраций АТФ. Рассмотренная картина смены состояний обратима. Постепенное снятие ингибирования процесса синтеза АТФ и последующая его активация этого процесса, переводят систему из конечного состояния в начальное.
На рис. 5б рассмотрен другой случай регулирования энергетического метаболизма, когда процесс синтеза АТФ не регулируется, а процесс трат постепенно активируется. В исходном состоянии системы второй процесс подавлен, и кривая V-исх. занимает самое нижнее положение, а положение кривой V+ не меняется. Система имеет одну устойчивую стационарную точку. При постепенной активации процессов трат АТФ кривая V- смещается в сторону высоких скоростей расхода АТФ. При касании V- с кривой V+ появляется вторая точка 2 неустойчивая по условию (2). При дальнейшем смещении кривой V- появляется ещё одна точка – 1, которая устойчива по первому условию Ляпунова. При этом устойчивая точка 3 смещается в сторону низких значений nАТФ, а дискриминационная точка 2 в сторону высоких его значений. Затем 2-я и 3-я точки сливаются и при дальнейшем активировании процессов расхода АТФ исчезают. В конечном итоге остается одна устойчивая точка – 1 в области низких значений концентрации АТФ. Подобно предыдущему рассмотренному случаю, данная картина перехода обратима.
Таким образом, изменяя скорости протекания процессов синтеза и трат АТФ с помощью их активации и ингибирования, можно переводить систему из одного устойчивого состояния в другое, если данная физическая модель допускает существование двух устойчивых состояний энергетического метаболизма эритроцита.
В свете изложенного выше, взаимные переходы между состояниями эритроцита с высокой и низкой концентрацией АТФ осуществляются тогда, когда кривые V+ синтеза и V- расхода АТФ смещаются в противоположные стороны (сближаются либо расходятся). Это смещение может достигаться за счет ингибирования процесса синтеза АТФ и одновременной активации процесса его трат. На основе анализа кинетики метаболизма эритроцитов с помощью выбранной за основу физической модели нельзя утверждать, что всегда существует вторая устойчивая точка, лежащая в области низких значений АТФ, поскольку эта модель допускает варианты, когда такой точки не существует. Для данного исследования интересны не все возможные ситуации, а только те, когда энергетический метаболизм эритроцитов близок к in vivo. Для прояснения вопроса о том, всегда ли существует состояние эритроцитов с низкой nАТФ, требуется привлечение более точной модели, которая возможно даст однозначный ответ о наличии в этих условиях указанной устойчивой точки.
Рассмотрим модель равновесных процессов метаболизма, предложенную Фоком М.В. и соавторами в работе [10], дополнив ее некоторыми деталями и назвав обобщенной моделью, как это сделано в работе [15]. В этой работе [15] рассматривается состояние покоя клеток, режимы их активности и деления. Нас интересует только состояние покоя, в котором достигается гомеостаз всех параметров, обеспечивающий жизнеспособность и жизнедеятельность клеток.
В обобщенной модели основными параметрами при анализе кинетики энергетического метаболизма выбраны показатель кислотности рН цитоплазмы, концентрация АТФ в ней и количество липидов C в мембране. Первые два параметра относятся к быстроменяющимся параметрам, так как величины их могут изменяться за доли секунды, то есть значительно быстрее времени обращения крови по большому кругу. В отличие от этих параметров, количество липидов в мембране эритроцитов меняется медленно, но также является важным энергетическим параметром, который определяет жизнеспособность и целостность клетки. Количество ферментов, запасы глюкозы в цитоплазме, объем эритроцитов и др. в модели приняты постоянными. Свободными же оставляют 2 переменные - nАТФ и рН цитоплазмы, которые определяют скорости таких энергозависимых процессов в эритроцитах как скорости синтеза и распада АТФ, скорости подкисления и подщелачивания цитоплазмы, а также скорости синтеза и распада липидов. Эти скорости будут функциями только двух указанных переменных.
![]() ,
,![]() – скорости синтеза и расхода АТФ;
– скорости синтеза и расхода АТФ;
![]() ,
,![]() – скорости подкисления подщелачивания
цитоплазмы;
– скорости подкисления подщелачивания
цитоплазмы;
![]() ,
,![]() – скорости синтеза и распада липидов.
– скорости синтеза и распада липидов.
Зависимости скоростей каждого из перечисленных процессов от рН и nАТФ в трехмерном пространстве величин (pH, nАТФ, V – скорости процессов) могут быть представлены сложными поверхностями [15, 16]. На линиях пересечения поверхностей, полученных для каждых двух противоположно направленных процессов (синтез и расход АТФ, подкисление и подщелачивание цитоплазмы, синтез и распад липидов в мембранных структурах), достигается баланс их скоростей.
Рис.6. Участки поверхностей скоростей
притока и убыли параметров: концентрации
АТФ (nАТФ), показателя
кислотности (рН) и количества липидов
(С) в трехмерном пространстве величин
(nАТФ, pH,
V+|V-).
АВ, MN, KL –
следы кривых баланса скоростей притока
и убыли концентрации АТФ, ионов Н+
и количества липидов С соответственно.
На рис. 6 представлены участки этих поверхностей. Их линии пересечения трехмерны. Пара участков поверхностей V+АТФ и V-АТФ дают линию пересечения, в точках которой скорость синтеза АТФ равна скорости расхода АТФ; пара поверхностей V+рН и V-рН дают линию пересечения, в точках которой скорость подкисления равна скорости подщелачивания цитоплазмы; пара поверхностей V+С и V-С дают линию пересечения, в каждой точке которой скорость увеличения равна скорости уменьшения количества липидов в мембране. Следами этих линий пересечения (в проекции на плоскость (nАТФ; рН)) являются кривые АВ, MN и KL, соответственно, для каждой из перечисленных выше линий пересечения. Как видно из рис. 6, эти кривые попарно пересекаются, что отражает рассогласованность процессов метаболизма.
На рис. 7. эти следы показаны на фазовой плоскости (nАТФ; рН) для случая согласования процессов метаболизма. При значениях рН и nАТФ, соответствующих точкам на этих кривых, V+ = V- ≡ Vобмена (Vобмена – скорость обмена параметра). Скорость обмена является важнейшей характеристикой проточного равновесия противоположно направленных процессов клеточного метаболизма в состоянии покоя.
Рис.7. Согласование процессов
энергетического метаболизма клетки,
которое выражается в пересечении следов
баланса скоростей притока и убыли
рассматриваемых параметров в точке О
на плоскости (nАТФ; рН).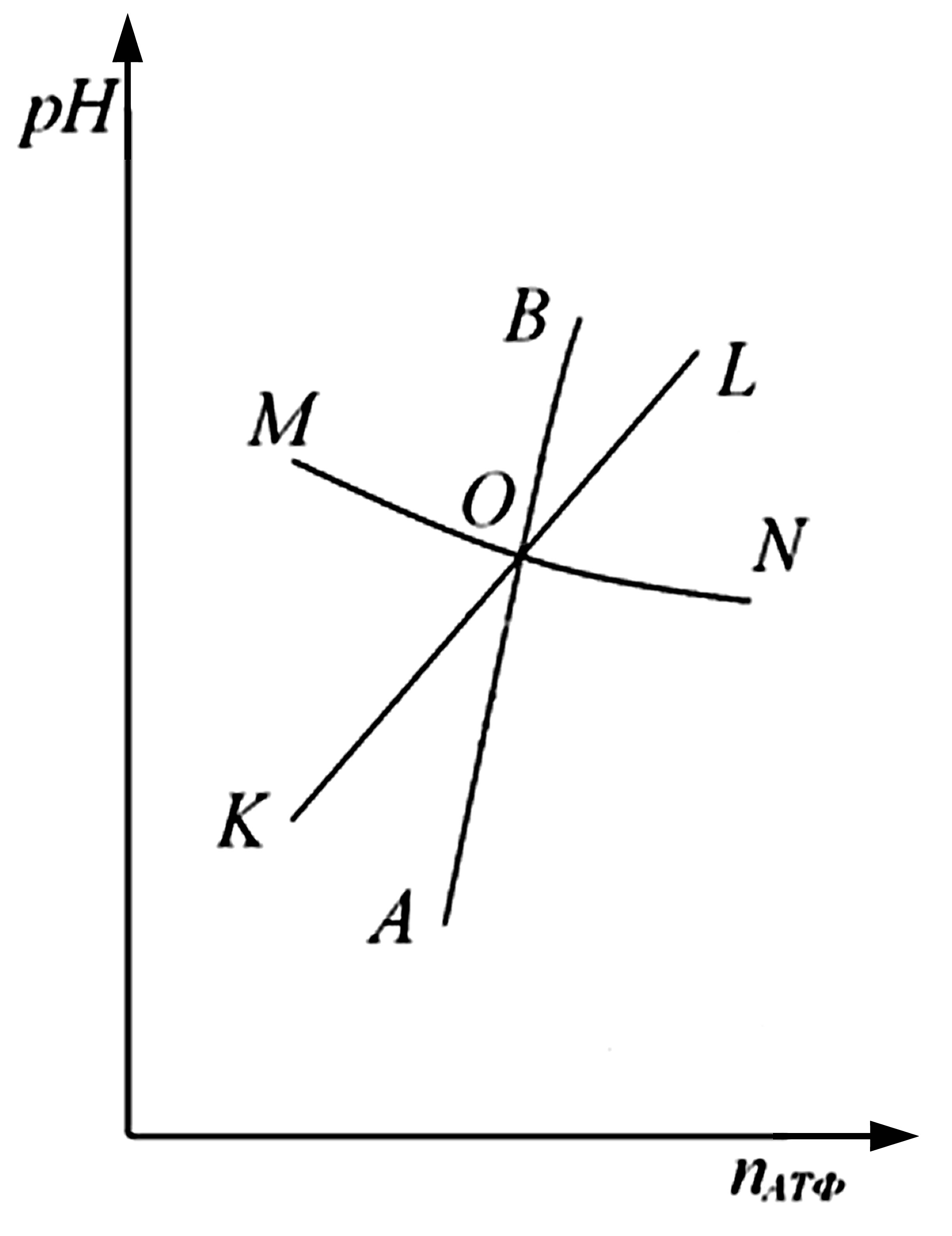
Как видно из рис. 7 кривые АВ и КL монотонно возрастают, а МN спадает, при этом все кривые пересекаются в точке О. Такая конфигурация и взаимное расположение кривых определяют устойчивость точки О по всем трем параметрам.
Рассмотрим устойчивость точки О по концентрации АТФ. В области над кривой АВ преобладают скорость V+ синтеза АТФ, а под кривой скорость V- его трат, следовательно, частная производная Vобмена концентрации АТФ по nАТФ отрицательна. При отклонении состояния метаболизма от точки О в сторону меньших концентраций АТФ, то, начнут преобладать процессы синтеза АТФ и состояние вернется в исходное устойчивое положение. То есть концентрация АТФ возрастает в результате интенсификации окислении субстратов и цитоплазма подкисляется.
Можно показать также, что точка О устойчива по рН согласно условию (1). Как говорилось, кривая МN монотонно спадает. Над кривой баланса MN преобладает скорость притока V+ ионов водорода Н+ в цитоплазму, а под кривой – скорость V- убыли Н+, значит, частная производная Vобмена ионов Н+ по рН отрицательна. При отклонении состояния метаболизма от точки О вверх по рН будут преобладать процессы подкисляющие цитоплазму, в результате которых значение рН возвращается к исходному.
Проведя аналогичные рассуждения можно заключить, что точка О также устойчива по количеству липидов в цитоплазматической мембране. Над кривой баланса KL преобладает скорость V+ синтеза липидов, а под кривой – скорость V- их ферментативного распада. При переходе через точку О слева направо частная производная Vобмена количества липидов по nАТФ отрицательна, также при переходе через точку О снизу вверх частная производная по рН также отрицательна. Следовательно, согласно условию (1) эта точка устойчива по количеству липидов С в цитомембране.
Для дальнейшего анализа кинетики метаболизма эритроцитов важно получить указанные следы кривых баланса скоростей V- и V+ для основных параметров, используемых в принятой за основу модели, во всем физиологическом диапазоне изменений концентрации АТФ и рН, включая область больших, чем в состоянии покоя, значений концентрации АТФ. Ясно, что конфигурации и взаимное расположение кривых, обеспечивающих устойчивость новой точки 3 с координатами (nАТФ3,рН3), в случае согласованности процессов метаболизма, будут подобны рассмотренному выше случаю для состояния покоя клетки. Для эритроцитов это имеет место. Для подавляющего большинства соматических клеток (кроме возбудимых клеток) согласно работе [16] в области высоких значений nАТФ устойчивости состояний метаболизма по рН нет. Поэтому для дальнейшего анализа кинетики метаболизма эритроцитов мы воспользуемся следующей моделью, которая проиллюстрирована на рис. 8.
Рис.8. Следы кривых баланса скоростей:
синтеза и расхода АТФ – кривая АВСD;
увеличения и уменьшения количества
липидов в мембране – кривая МN;
подкисления и подщелачивание цитоплазмы
– кривая KL на фазовой
плоскости (nАТФ,рН) во
всем физиологическом диапазоне
концентраций АТФ и рН.
Кривая ABCD на фазовой плоскости (nАТФ; рН) является следом кривой баланса скоростей синтеза V+ и расхода V- АТФ. Форма этой кривой имеет зигзагообразный вид. Точки ветвей АВ и CD устойчивы по условию (1), кроме точек В и С, которые неустойчивы по условию (2). Точки ветви ВС не устойчивы по условию (1).
Из таких же соображений получена форма кривой KLК1L1. Точки ветвей участков кривой KL и К1L1 устойчивы по условию (1), а точки ветви LK1 не устойчивы по этому условию. Точки L и K1 неустойчивы по условию (2).
Для качественного анализа (достаточного для получения необходимых результатов) хода кривой баланса MN не требуется строить соответствующие поверхности. Расположение и характерную конфигурацию кривой MN можно получить аналитически. Имея начальную точку, для определения конфигурации и расположения на плоскости (nАТФ, рН) кривой MN, можно воспользоваться известной зависимостью рН цитоплазмы от величины трансмембранного потенциала.
Поскольку
цитомембрана не представляет значительного
препятствия для ионов Н+,
то можно использовать соотношение
Больцмана:
![]() (3),
(3),
где
![]() –
концентрация ионов
–
концентрация ионов
![]() в цитоплазме эритроцитов;
в цитоплазме эритроцитов;
![]() – концентрация ионов
в плазме крови;
– концентрация ионов
в плазме крови;
![]() – элементарный заряд;
– элементарный заряд;
![]() – трансмембранный потенциал; k
– постоянная Больцмана; T
– температура.
Прологарифмировав соотношение (1),
получим зависимость рН цитоплазмы от
концентрации АТФ(4):
– трансмембранный потенциал; k
– постоянная Больцмана; T
– температура.
Прологарифмировав соотношение (1),
получим зависимость рН цитоплазмы от
концентрации АТФ(4):
![]() (4),
(4),
где величина Uм является функцией рН и nАТФ.
Соотношение (4) на фазовой плоскости (nАТФ; pH) определяет кривую, являющуюся следом кривой баланса скоростей роста и убыли концентрации Н+ в цитоплазме эритроцитов.
Обычно in
vivo
кислотность плазмы крови
![]() =7,45;
а
=7,45;
а
![]() ~25
мэВ и
~25
мэВ и
![]() =26мэВ,
т.о. из (4) следует, что в норме в цитоплазме
эритроцитов
=26мэВ,
т.о. из (4) следует, что в норме в цитоплазме
эритроцитов
![]() =7,05.
=7,05.
Трансмембранная
разность потенциалов состоит из трех
компонент
![]() ,
где UD
– потенциал термодинамического
равновесия Доннана; UNa/K
– величина трансмембранного потенциала,
обусловленного деятельностью молекулярных
K+/Na+
насосов, зависящая от концентрации АТФ
по закону Михаэлиса-Ментен; UH+
– величина трансмембранного потенциала,
которая определяется выходом части
ионов Н+
при накоплении кислых продуктов при
протекании реакций гликолиза. Последней
составляющей можно пренебречь.
,
где UD
– потенциал термодинамического
равновесия Доннана; UNa/K
– величина трансмембранного потенциала,
обусловленного деятельностью молекулярных
K+/Na+
насосов, зависящая от концентрации АТФ
по закону Михаэлиса-Ментен; UH+
– величина трансмембранного потенциала,
которая определяется выходом части
ионов Н+
при накоплении кислых продуктов при
протекании реакций гликолиза. Последней
составляющей можно пренебречь.
При нулевом значении концентрации АТФ величина трансмембранного потенциала ненулевая, соответствует потенциалу Доннана и составляет 10 мВ [16]. В организме строго поддерживается рН межклеточной жидкости и плазмы крови на уровне рНе=7,35-7,45. Следовательно, рН цитоплазмы эритроцита ниже, чем рН плазмы на величину ΔрН=0,05, обусловленную наличием доннановского потенциала, и имеет значение рНД=7,3. Тогда кривая MN взяв начало в точке (0, рНд) далее спадает, постепенно доходя до насыщения в области высоких значений концентрации АТФ, как это показано на рис.8.
Рис.9. Следы на фазовой плоскости
(nАТФ,рН) кривых баланса
скоростей: синтеза и расхода АТФ –
кривая АВСD; подкисления
и подщелачивание цитоплазмы – кривая
KL; синтеза и распада
липидов – кривая МN –
для эритроцитов, кривая MN1
– для большинства соматических клеток
(кроме нервных).

Для всех соматических клеток (кроме, нейронов), кривая MN обязательно пересекает участок АВ следа АВСD, расположенный в области низких значений АТФ, поскольку у всех этих клеток есть состояние покоя (рис. 9). Ретикулоцит в этом отношении от этих клеток не отличается, поскольку имеет ядро и все признаки обычной соматической клетки. Эта клетка, несомненно, может также находиться в состоянии покоя, и соответствующая ему точка лежит в области низких значений концентраций АТФ. Эритроцит значительно проще своего предшественника. Его энергетическая база ослаблена, поскольку гликолиз является единственным источником энерговыделения. Интенсивность трат АТФ значительно меньше. Эти факторы влияют на взаимное расположение следов кривых в рассматриваемой качественной модели энергетического метаболизма. Подробный анализ изменений энергетического метаболизма ретикулоцита при превращении его в эритроцит, выполненный с помощью обобщенной модели, не позволяет однозначно ответить на вопрос о существовании второй устойчивой точки в области низких значений АТФ в условиях, близких к in vivo. Для этих целей необходимы эксперименты с цельной кровью.
