
- •Введение
- •Цель работы
- •Основные задачи исследования
- •Глава 1. Литературный обзор § 1.1 Система крови
- •§ 1.2 Основные функции крови [1]:
- •§ 1.3 Форма и строение эритроцитов.
- •§ 1.4 Строение и функции гемоглобина.
- •§1.5 Разрушение эритроцитов
- •§1.6 Процессы энергетического метаболизма и основные энергетические параметры эритроцитов.
- •Глава 2. Теоретическая часть § 2.1 Выбор физической модели кинетики энергетического метаболизма.
- •§ 2.2 Факторы, способствующие переходу метаболизма эритроцитов из состояния с высокой концентрацией атф в устойчивое состояние с низкой концентрацией атф
- •§ 2.3 Постановка экспериментальных задач
- •§ 2.4 Неравновесные процессы, протекающие в плазме пробы крови после ее взятия у донора, приводящие к изменению метаболизма эритроцитов
- •Глава 3. Экспериментальная часть § 3.1 Цели экспериментальных работ
- •§ 3.2 Используемые приборы и установки
- •§ 3.3 Используемые материалы
- •§ 3.4 Методики проведения экспериментальных работ
- •§ 3.5 Результаты экспериментов и их обсуждение
- •§ 3.6 Выводы
- •§ 3.7 Некоторые практически важные замечания
- •Заключение
- •Список литературы
§ 1.4 Строение и функции гемоглобина.
Гемоглобин
– главный компонент эритроцита и
основной дыхательный пигмент,
обеспечивающий перенос кислорода (О2)
из легких к тканям в организмах позвоночных
животных, и, в меньшей степени, углекислого
газа (СО2)
от тканей в легкие. Главным образом,
углекислота переносится в виде
![]() в плазме крови. Подсчитано, что в одном
эритроците содержится ~ 340.000.000 молекул
гемоглобина, каждая из которых состоит
примерно из 103 атомов. В крови человека
в среднем содержится ~ 750г гемоглобина
[3].
в плазме крови. Подсчитано, что в одном
эритроците содержится ~ 340.000.000 молекул
гемоглобина, каждая из которых состоит
примерно из 103 атомов. В крови человека
в среднем содержится ~ 750г гемоглобина
[3].
Рис. 2. Строение гемоглобина.
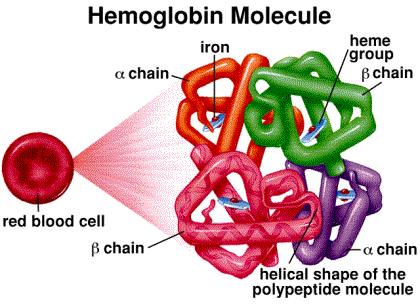
Гемоглобин представляет собой сложный белок, относящийся к группе гемопротеинов. Белковый компонент его представлен глобином, состоящим из двух и двух субъединиц и, соответственно, содержит четыре полипептидные цепочки двух сортов. Небелковый компонент (так называемая простетическая группа) представлен четырьмя одинаковыми железопорфириновыми соединениями – гемами.
Иржак Л.И. в своей работе [4] описал большинство физиологических свойств гемоглобина, его виды и подвиды. Основное внимание в этой работе уделено описанию процессов связывания кислорода гемоглобином в норме и при некоторых патологиях. Также приведена кривая диссоциации оксигемоглобина и описан эффект Бора.
Наиболее подробно физико-химические свойства гемоглобина изучены и представлены в работах Блюменфельда Л.А. [5, 6]. В них большое внимание уделено зарядовым характеристикам молекул гемоглобина. Эти характеристики в значительной степени определяют адгезивные свойства молекул гемоглобина (комплексование и ассоциацию с липидной мембраной). В указанных работах приведены теоретические и экспериментальные исследования, в которых сравниваются свойства окси- и деоксигемоглобина, а также гемоглобина и миоглобина.
При взаимодействии молекулярного кислорода с гемоглобином в условиях in vivo существует небольшая, но конечная вероятность окисления гема двухвалентного железом до трехвалентного, причем молекула О2 не присоединяется, но окисляет железо: Fe2+ + O2 Fe3+ O2. Поэтому при дыхании в эритроцитах непрерывно образуется метгемоглобин, который не способен переносить О2. Восстановление Fe3+ метгемоглобина до Fe2+ происходит с затратами энергии и обеспечивается ферментом – метгемоглобинредуктазой [3].
В ходе метаболизма глюкозы, протекающего в эритроците по побочному пути гликолиза, контролируемого ферментом дифосфоглицератмутазой, в эритроците образуется 2,3-дифосфоглицерат (2,3-ДФГ). Основное его значение заключается в уменьшении сродства гемоглобина к кислороду. 2,3-ДФГ связывается с β-цепями гемоглобина, облегчая отсоединение О2 от молекулы гемоглобина [3].
Большое количество опубликованных работ посвящено строению мембран клеток, в том числе и эритроцитов. В одной из классических работ [7] приведены данные по количеству и белковому составу мембран эритроцитов и функциональному назначению этих белков, архитектонике липидного бислоя.
Методики и результаты идентификации некоторых видов белков мембранных структур представлены в работе [8]. В мембране эритроцита идентифицировано 15 главных белков. Более 60 % всех белков составляют: примембранный белок спектрин и мембранные белки – гликофорин и белок полосы 3.
Спектрин является белком цитоскелета, связанным с внутренней стороной мембраны. Он участвует в поддержании двояковогнутой формы эритроцита.
Гликофорин – белок, относящийся к классу мембранных гликопротеинов, по мнению авторов работ [9, 10, 11], играет важную роль в механизме авторегуляции неспецефической проницаемости цитоплазматической мембраны эритроцита. Этот белок пронизывает мембрану в виде одиночной спирали. Большая его часть выступает с наружной поверхности эритроцита, где к нему присоединены 15 отдельных цепей олигосахаридов, на ветвях которых расположены сиаловые кислоты, несущие отрицательные заряды. В распрямленном виде максимальное удаление ветвей гликофорина от поверхности эритроцита может достигать 200 нм, что больше поляризационной длины плазмы крови (радиуса экранировки Дебая). В результате этого отдельные отрицательные заряды экранированы противоионами плазмы, так что нити гликофорина не взаимодействует с поверхностью своей мембраны. Так как противоионы могут быть общими для гликофоринов различных эритроцитов, то эритроциты могут образовывать монетные столбики.
Белок полосы 3 представляет собой трансмембранный гликопротеид, полипептидная цепь которого много раз пересекает бислой липидов. Этот гликопротеид участвует в обмене кислородом и углекислотой.
