УЧЕБНИКИ. ПОСОБИЯ |
Е.Н.ФРЕНКЕЛЬ
Самоучитель по химии
Пособие для тех, кто не знает, но хочет узнать и понять химию
Часть I. Элементы общей химии (первый уровень сложности)
Продолжение. Cм. В № 13, 18, 23/2007; 6/2008
Глава 4. Понятие о химической связи
В предыдущих главах данного пособия были обсуждения того, что вещество состоит из молекул, а молекулы – из атомов. А не возникал ли у вас вопрос: почему атомы, составляющие молекулу, не разлетаются в разные стороны? Что удерживает атомы в молекуле?
Их удерживает химическая связь.
Для того чтобы понять природу химической связи, достаточно вспомнить простой физический опыт. Два шарика, висящие рядом на ниточках, никак не «реагируют» друг на друга. Но если придать одному шарику положительный заряд, а другому – отрицательный, они притянутся друг к другу. Не эта ли сила притягивает атомы друг к другу? Действительно, исследования показали, что химическая связь имеет электрическую природу.
Откуда же возникают заряды в нейтральных атомах?
При описании строения атомов было показано, что все атомы, за исключением атомов благородных газов, стремятся присоединить или отдать электроны. Причина – образование устойчивого восьмиэлектронного внешнего уровня (как у благородных газов). При приеме или отдаче электронов возникают электрические заряды и, как следствие, электростатическое взаимодействие частиц. Так возникает ионная связь, т.е. связь между ионами.
Ионы – это устойчивые заряженные частицы, которые образуются в результате приема или отдачи электронов.
Например, в реакции участвует атом активного металла и активного неметалла:
Na
+ S
![]() ?
?
В этом процессе атом металла (натрия) отдает электроны:
![]()
а) Устойчива ли такая частица?
б) Сколько всего электронов осталось в атоме натрия?
в) Будет ли эта частица иметь заряд?
Таким образом, в этом процессе образовалась устойчивая частица (8 электронов на внешнем уровне), которая имеет заряд, т.к. у ядра атома натрия заряд по-прежнему +11, а оставшиеся электроны имеют суммарный заряд –10. Поэтому заряд иона натрия +1. Кратко запись этого процесса выглядит так:
![]()
Что происходит с атомом серы? Этот атом принимает электроны до завершения внешнего уровня:
![]()
Простой подсчет показывает, что эта частица имеет заряд:
![]()
Кратко:
![]()
Разноименно заряженные ионы притягиваются, в результате чего возникает ионная связь и «ионная молекула»:
![]()
Существуют и другие способы образования ионов, о которых будет сказано в главе 6.
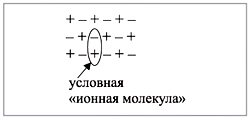
Формально сульфиду натрия приписывают именно такой состав молекулы, хотя вещество, состоящее из ионов, имеет приблизительно следующее строение (рис. 1):
|
Рис. 1. Схема строения вещества, имеющего условную «ионную молекулу» |
Таким образом, вещества, состоящие из ионов, не содержат отдельных молекул! В этом случае можно говорить лишь об условной «ионной молекуле».
Задание 4.1. Покажите, как происходит переход электронов при возникновении ионной связи между атомами:
а) кальция и хлора;
б) алюминия и кислорода.
П о м н и т е! Атом металла отдает внешние электроны; атом неметалла принимает недостающие электроны.
Вывод. Ионная связь по описанному выше механизму образуется между атомами активных металлов и активных неметаллов.
Исследования, однако, показывают, что полный переход электронов от одного атома к другому происходит далеко не всегда. Очень часто химическая связь образуется не при отдаче-приеме электронов, а в результате образования общих электронных пар*. Такая связь называется ковалентной.
Ковалентная связь возникает за счет образования общих электронных пар. Этот вид связи образуется, например, между атомами неметаллов. Так, известно, что молекула азота состоит из двух атомов – N2. Как возникает ковалентная связь между этими атомами? Чтобы ответить на этот вопрос, необходимо рассмотреть строение атома азота:
![]()
В о п р о с. Сколько электронов не хватает до завершения внешнего уровня?
О т в е т. Не хватает трех электронов. Поэтому, обозначив каждый электрон внешнего уровня точкой, получим:
![]()
В о п р о с. Почему три электрона обозначены одиночными точками?
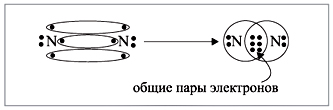
О т в е т. Дело в том, что мы хотим показать образование общих пар электронов. А пара – это два электрона. Такая пара возникает, в частности, если каждый атом предоставит по одному электрону для образования пары. Атому азота не хватает трех электронов до завершения внешнего уровня. Значит, он должен «приготовить» три одиночных электрона для образования будущих пар (рис. 2).
|
Рис. 2. Схема образования молекулы азота из двух атомов азота |
Получена электронная формула молекулы азота, которая показывает, что у каждого атома азота имеется теперь восемь электронов (шесть из них обведены в овал плюс по 2 электрона своих); между атомами возникли три общие пары электронов (место пересечения кружков).
Каждая пара электронов соответствует одной ковалентной связи. Сколько ковалентных связей возникло? Три. Каждую связь (каждую общую пару электронов) покажем при помощи черточки (валентный штрих):
![]()
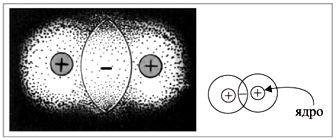
Все эти формулы не дают, однако, ответа на вопрос: что же связывает атомы при образовании ковалентной связи? Электронная формула показывает, что общая пара электронов располагается между атомами. В этой области пространства возникает избыточный отрицательный заряд. А ядра атомов, как известно, имеют положительный заряд. Таким образом, ядра обоих атомов притягиваются к общему отрицательному заряду, который возник благодаря общим электронным парам (точнее, пересечению электронных облаков) (рис. 3).
|
Рис. 3. Схема образования молекулы из двух атомов |
Может ли возникнуть такая связь между разными атомами? Может. Пусть атом азота взаимодействует с атомами водорода:
![]()
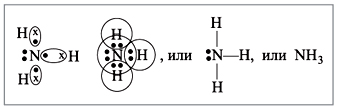
Строение атома водорода показывает, что атом имеет один электрон. Сколько таких атомов нужно взять, чтобы атом азота «получил желаемое» – три электрона? Очевидно, три атома водорода (рис. 4):
|
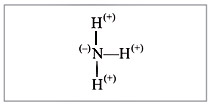
Рис. 4. Схема образования молекулы аммиака NH3 из атома азота и трех атомов водорода |
Крестиком на рис. 4 обозначены электроны атома водорода. Электронная формула молекулы аммиака показывает, что у атома азота стало восемь электронов, а у каждого атома водорода получилось по два электрона (а больше на первом энергетическом уровне и быть не может).
Графическая формула показывает, что атом азота имеет валентность три (три черточки, или три валентных штриха), а каждый атом водорода – валентность один (по одной черточке).
Хотя в состав обеих молекул N2 и NН3 входит один и тот же атом азота, химические связи между атомами отличаются друг от друга. В молекуле азота N2 химические связи образуют одинаковые атомы, поэтому общие пары электронов находятся посередине между атомами. Атомы сохраняют нейтральный характер. Такая химическая связь называется неполярной.
В молекуле аммиака NH3 химическую связь образуют разные атомы. Поэтому один из атомов (в данном случае – атом азота) сильнее притягивает общую пару электронов. Общие пары электронов смещаются в сторону атома азота, и на нем возникает небольшой отрицательный заряд, а на атоме водорода – положительный, возникли полюса электричества – связь полярная (рис. 5).
|
Рис. 5. Схема строения полярной ковалентной связи в молекуле аммиака NH3 |
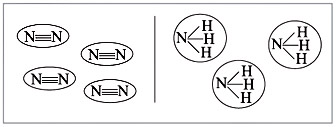
Большинство веществ, построенных при помощи ковалентной связи, состоят из отдельных молекул (рис. 6).
|
Рис. 6. Схемы молекул веществ с ковалентными связями |
Из рис. 6 видно, что между атомами химические связи есть, а между молекулами они отсутствуют или незначительны.
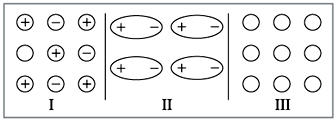
Тип химической связи влияет на свойства вещества, на его поведение в растворах. Так, чем больше, значительнее притяжение между частицами, тем труднее их оторвать друг от друга и сложнее перевести твердое вещество в газообразное или жидкое состояние. Попробуйте определить на схеме, приведенной ниже, между какими частицами силы взаимодействия больше и какая химическая связь при этом образуется (рис. 7).
|
Рис. 7. Схемы строения веществ, образованных различными частицами |
Если вы внимательно прочитали главу, ответ у вас будет следующим: максимальное взаимодействие между частицами осуществляется в случае I (ионная связь). Поэтому все такие вещества – твердые. Наименьшее взаимодействие между незаряженными частицами (случай III – неполярная ковалентная связь). Такие вещества чаще всего газы.
Задание 4.2. Определите, какая химическая связь осуществляется между атомами в веществах: NаСl, НСl, Сl2, АlСl3, Н2О. Дайте пояснения.
Задание 4.3. Составьте электронные и графические формулы для тех веществ из задания 4.2, в которых вы определили наличие ковалентной связи. Для ионной связи составьте схемы перехода электронов.