
УЧЕБНИКИ. ПОСОБИЯ |
Е.Н.ФРЕНКЕЛЬ
Самоучитель по химии
Пособие для тех, кто не знает, но хочет узнать и понять химию
Часть I. Элементы общей химии (первый уровень сложности)
Продолжение. Начало см. в № 13, 18/2007
Глава 2. Важнейшие классы неорганических соединений (окончание)
2.3. Основания
Основания – это сложные вещества, в состав которых входят атомы металлов и гидроксигруппы ОН.
Общая
формула оснований:
![]() где
n – число групп ОН и валентность
металла.
где
n – число групп ОН и валентность
металла.
Валентность ОН-группы равна I.
Основания называют по схеме:
гидроксид (чего?) металла (n),
где n – переменная валентность металла.
Например: Са(ОН)2 – гидроксид кальция, Fе(OH)3 – гидроксид железа(III), NH4OH – гидроксид аммония.
Обратите внимание. В состав последнего основания не входит атом металла. Это исключение. Валентность группы NН4 (аммоний) равна I.
По растворимости в воде основания подразделяют на растворимые и нерастворимые. Это легко определить по таблице растворимости.
Растворимые в воде основания называются щелочами. В состав щелочей входят атомы активных металлов (они находятся в начале ряда напряжений, до магния). Гидроксид аммония тоже относится к щелочам, т.к. существует только в растворах.
Задание 2.21. Пользуясь таблицей растворимости или рядом напряжений, составьте химические формулы двух-трех щелочей.
Свойства и способы получения щелочей
Щелочи можно получить действием активного металла (K, Nа, Cа, Ва) или его оксида на воду:
2Nа
+ 2H2O = 2NаОН + H2![]() ,
,
СаO + H2O = Са(ОH)2.
• Растворы щелочей реагируют с кислотными и амфотерными оксидами, а также с кислотами. Последняя реакция называется реакцией нейтрализации:
![]()
Реакция нейтрализации характерна для всех кислот.
• Растворы щелочей реагируют с растворами солей. Реакция происходит, если образуется хотя бы одно нерастворимое соединение. Эта реакция относится к реакциям обмена, т.е. в результате получается новая соль и новое основание:
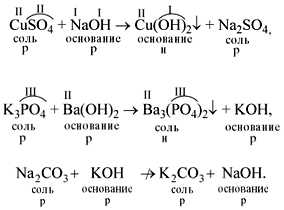
Обратите внимание. 1) Последняя реакция не происходит, т.к. оба вещества в правой части уравнения растворимы в воде.
2) Валентности составных частей исходных веществ определяйте по кислотному остатку или по числу групп ОН.
3) Полученные значения валентностей используйте при составлении формул веществ – продуктов реакции.
4) Растворимость получаемых веществ определяйте по таблице растворимости.
Задание 2.22. Расставьте коэффициенты в приведенных выше схемах реакций.
Задание 2.23. Составьте уравнения возможных реакций обмена:
Fe(NO3)3 + гидроксид калия,
Na2SO3 + гидроксид кальция,
K3PO4 + гидроксид аммония.
Определите, какая из реакций не происходит и почему.
• Растворы щелочей, как и растворы кислот, изменяют окраску индикаторов. В растворе щелочи фиолетовый лакмус синеет, оранжевый метилоранж желтеет, бесцветный фенолфталеин краснеет.
Все изменения окрасок индикаторов можно свести в таблицу (табл. 4):
Таблица 4
Окраска индикаторов в различных средах
Индикатор |
Характер среды |
||
Кислая |
Нейтральная |
Щелочная |
|
Лакмуc |
Красный |
Фиолетовый |
Синий |
Метилоранж |
Красный |
Оранжевый |
Желтый |
Фенолфталеин |
Бесцветный |
Красный |
|
Обратите внимание. Если к воде добавить кислоту, то среда раствора будет кислая, если добавить щелочь – среда щелочная, в чистой воде среда нейтральная.
В о п р о с 1. Можно ли при помощи фенолфталеина узнать, какая жидкость в стакане: вода, кислота НCl, раствор KОН? Можно ли для этого использовать раствор лакмуса?
В о п р о с 2. Почему реакцию между кислотой и щелочью называют реакцией нейтрализации?
