
- •1. Класифікація, будова, ізомерія
- •2. Хімічні властивості
- •Механізм:
- •1. Галогенування
- •2. Нітрування за Коноваловим
- •Ненасичені вуглеводні:
- •Реакції ae:
- •Реакції аr:
- •Реакції аn:
- •Реакції окиснення
- •Ізомеризація алканів.
- •5.1.4 Методи добування алканів
- •Методи добування циклоалканів
- •Методи добування алкенів
- •1. Дегідрування й крекінг алканів (промисловий метод)
- •2. Вилучення води від спиртів (дегідратація).
- •3. Вилучення галогеноводню або галогену від галогеналканів (дегідрогалогенування)
- •4. Гідрування дієнів і алкінів.
- •5.5.2 Методи добування алкінів
- •Можливий вплив аліфатичних вуглеводнів на довкілля:
Лекція 3
Порівняльна характеристика аліфатичних вуглеводнів
1. Класифікація, будова, ізомерія
Алкани або аліфатичні вуглеводні - насичені вуглеводні з відкритим ланцюгом, у молекулах яких атоми вуглецю сполучені між собою σ-зв΄язками. Атоми вуглецю знаходяться в стані sp3-гібридизації. Загальна формула – CnH2n+2
Алканам властива структурна ізомерія - ізомерія вуглецевого скелету, яка починається з бутану.:
Ізомерія – явище існування речовин з однаковою молекулярною (брутто-формулою) формулою, але різними фізичними і хімічними властивостями.

Алкени (олефіни) – вуглеводні, в молекулі яких міститься один подвійний зв΄язок. Загальна формула СnH2n.
Структурна ізомерія алкенів пов΄язана не тільки з розгалуженням вуглецевого скелету, а і з розташуванням подвійного зв΄язку (ізомерія місця або позиційна)

Крім структурної ізомерії для алкенів характерна також геометрична ізомерія (цис-, транс-ізомерія):

-Електрони подвійного зв’язку рухливі і здатні легко зміщуватися. Поляризацію подвійного зв’язку під впливом електронодонорного (D) й електроноакцепторного (А) замісників можна показати в загальному вигляді:

+() I, +M I, M
А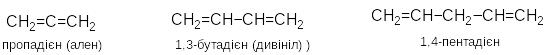 лкадієни
– вуглеводні, що містять два подвійні
зв΄язки.
Загальна
формула СnH2n-2.
Вони можуть
бути кумульованими, кон΄юґованими
або ізольованими:
лкадієни
– вуглеводні, що містять два подвійні
зв΄язки.
Загальна
формула СnH2n-2.
Вони можуть
бути кумульованими, кон΄юґованими
або ізольованими:
Алкіни – вуглеводні, що містіть потрійний зв΄язок. Загальна формула - СnH2n-2. Ізомерія алкінів пов΄язана з положенням потрійного зв΄язку та розгалуженням вуглеводневого радикалу.
Аліциклічні вуглеводні – Аліфатичні циклічні, що містять один або декілька циклів. Загальна формула - СnH2n. Їх поділяють залежно від величини циклів, їх кількості та способу сполучення.

Їм властива структурна ізомерія, що залежить від розміру циклу, природи замісника, їх взаємного розташування, положення подвійного зв΄язку.
 Геометрична
ізомерія пов΄язана
їз розташуванням замісників відносно
площини циклу:
Геометрична
ізомерія пов΄язана
їз розташуванням замісників відносно
площини циклу:
Для циклоалканів властива також конформаційна ізомерія. Циклоалкани за винятком циклопропану не плоскі, а існують у певних просторових конформаціях:

Циклопропан циклобутан циклопентан
Циклогексан:
„ванна” „крісло”

Циклопропан та циклобутан – дуже напружені цикли, бо валентні кути дуже відрізняються від тетраедричного. σ-Зв΄язки між вуглецевими атомами перекриваються поза трикутником, що з΄єднує ядра вуглецевих атомів. Такий -зв’язок носить назву зігнутого -зв’язку (тау) або “бананового”, він не такий міцний, як звичайний -зв’язок, і під впливом деяких реагентів розкривається подібно -зв’язку.
2. Хімічні властивості
Реакційна здатність сполуки тісно пов’язана з її будовою. Алкани та циклоалкани є насиченими вуглеводнями, які мають невелику реакційну здатність. Зв’язки СН та СС мало полярні, їх дуже важко розщепити Тому до більшості реагентів ці сполуки інертні. Алкани за звичайних умов мають низьку реакційну здатність. Реакційна здатність алканів визначається переважно реакційною здатністю водню й залежить від типу вуглецевого атома, з яким сполучений цей водень (первинний, вторинний або третинний). Найактивнішим є водневий атом, що сполучений з третинним вуглецевим атомом звязку СтретН. Здатність водневих атомів до заміщення зменшується в ряду:
Н-атом біля Н-атом біля Н-атом біля Н-атом в
третинного > вторинного > первинного > молекулі
С-атома С-атома С-атома метану
Г омолітичний
розрив зв’язків СН
відбувається при реакціях
радикального заміщення SR.
омолітичний
розрив зв’язків СН
відбувається при реакціях
радикального заміщення SR.
