
- •Порівняльна характеристика аренів
- •Будова ароматичних сполук
- •Будова молекули нафталену
- •Номенклатура і ізомерія
- •Хімічні властивості
- •Реакції електрофільного заміщення
- •Механізм електрофільного заміщення в бензеновому ядрі
- •Орієнтація заміщення в нафталеновому ядрі
- •5.6.1.5 Орієнтація в дизаміщених бензену
- •Реакції заміщення в бічному ланцюгу
Порівняльна характеристика аренів
Класифікація ароматичних вуглеводнів
І .
Бензен та його гомологи
.
Бензен та його гомологи
ІІ. Поліциклічні ароматичні сполуки
А) конденсовані поліядерні арени

нафтален антрацен фенатрен азулен
Б) арени з ізольованими ядрами

біфеніл дифенілметан стильбен трифенілметан
Будова ароматичних сполук
Бензен був виділений ще в 1825 році М.Фарадеєм, і він же визначив співвідношення вуглецю та водню в цій сполуці - 1:1. Після цього виникло питання відносно будови цієї сполуки. Суперечки на тему будови сполуки з формулою С6Н6 продовжувалися майже 40 років. Незважаючи на “ненасичену” формулу, бензен важко вступає в типові для ненасичених сполук реакції приєднання, але досить легко вступає в реакції заміщення. Ці незрозумілі на той час властивості бензену намагався пояснити в 1865 році А. Кекуле, який запропонував структурну формулу бензену у вигляді циклогексатриену-1,3,5 (І):

Але недолік такої структури полягав у тому, вона припускала можливість існування ізомерів дизаміщених бензену, які в дійсності не існують (II). Тому Кекуле запропонував зображувати молекулу бензену у вигляді резонансного гібриду двох структур:

Сучасні дані не підтверджують наявність у молекулі бензену подвійних і одинарних зв’язків, що чергуються між собою. Довжини всіх СС-зв’язків молекули бензену є однаковими й дорівнюють 0.139 нм ,тобто є проміжною між довжиною подвійного та одинарного зв΄язку.
С=С - 0,134нм; Сsp2Сsp2 - 0,144-0,146 нм: СС - 0.154 нм)

бензен циклопентадієн гіпотетичний циклогексатриен
Вуглецеві атоми в молекулі бензену знаходяться в стані sp2-гібридизації. Шість вуглецевих атомів сполучені між собою -зв’язками й замкнені у цикл. Довжини всіх СН -зв’язків теж однакові й дорівнюють 0.108 нм. Усі шість атомів вуглецю і шість атомів водню розміщені в одній площині. Структура молекули бензену є правильним шестикутником.
 Крім
того, в молекулі бензену кожен С-атом
має вільну р-орбіталь,
яка може приймати участь у створенні
-зв’язків
(а). Ці р-електрони
в бензені не поєднуються в пари, а є
делокалізованими,
тобто
створюють спільну -електронну
хмару, що рівномірно розподілена по
всій молекулі (б). Тому формулу бензену
правильніше зображувати у вигляді
рівнобічного шестикутника з вписаною
в нього циклічною -орбіталлю,
що символізує секстет -електронів
(в). На відміну від етиленових сполук,
кожному СС-зв’язку
відповідає електронна густина лише
одного р-електрона.
Такий зв’язок має назву ароматичного
і його часто зображують у вигляді
. Але часто використовують
й формулу Кекуле у вигляді рівнобічного
шестикутника з трьома кон’югованими
подвійними зв’язками:
Крім
того, в молекулі бензену кожен С-атом
має вільну р-орбіталь,
яка може приймати участь у створенні
-зв’язків
(а). Ці р-електрони
в бензені не поєднуються в пари, а є
делокалізованими,
тобто
створюють спільну -електронну
хмару, що рівномірно розподілена по
всій молекулі (б). Тому формулу бензену
правильніше зображувати у вигляді
рівнобічного шестикутника з вписаною
в нього циклічною -орбіталлю,
що символізує секстет -електронів
(в). На відміну від етиленових сполук,
кожному СС-зв’язку
відповідає електронна густина лише
одного р-електрона.
Такий зв’язок має назву ароматичного
і його часто зображують у вигляді
. Але часто використовують
й формулу Кекуле у вигляді рівнобічного
шестикутника з трьома кон’югованими
подвійними зв’язками:
![]()

Будова молекули нафталену
Брутто-формула молекули нафталену - С10Н8.
В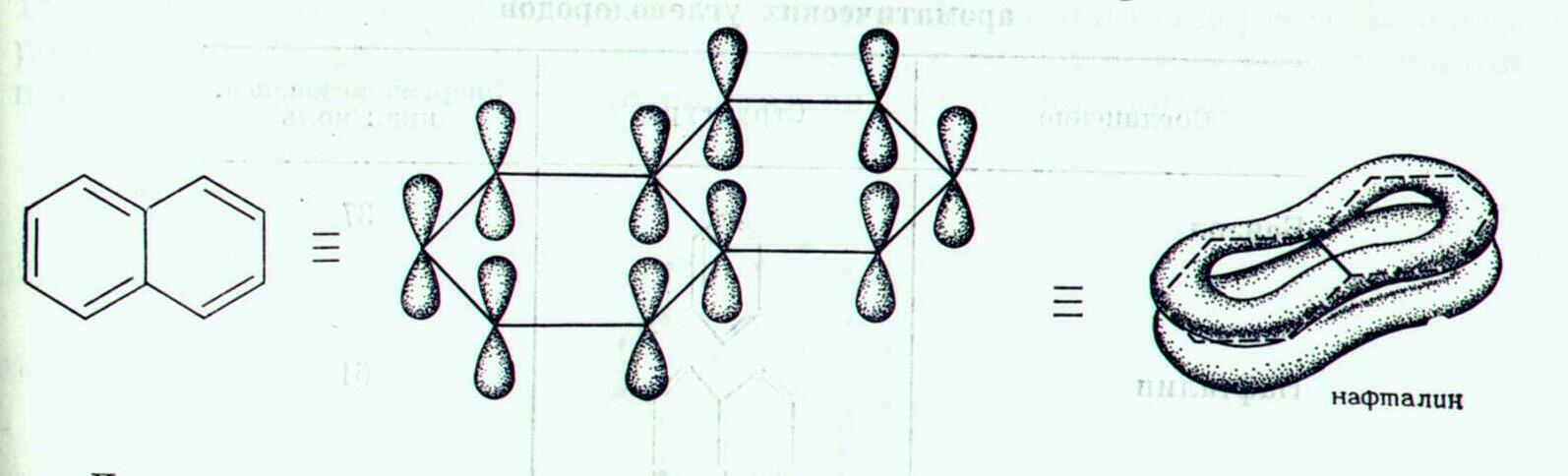 углецеві
атоми молекули нафталену також перебувають
у стані sp2-гібридизації.
Молекула нафталену плоска, являє циклічну
кон’юґовану систему, яка містить 10
р-електронів, що мають форму об’ємних
вісімок, тобто вона задовольняє вимогам
правила ароматичності Ґюккеля.
углецеві
атоми молекули нафталену також перебувають
у стані sp2-гібридизації.
Молекула нафталену плоска, являє циклічну
кон’юґовану систему, яка містить 10
р-електронів, що мають форму об’ємних
вісімок, тобто вона задовольняє вимогам
правила ароматичності Ґюккеля.
П роте,
за даними рентгеноструктурного аналізу,
на відміну від бензену, СС-звязки
в молекулі нафталену не
однакові. Зв’язки між атомами 1 і 2 за
довжиною подібні до подвійних (іноді
кажуть про “ненасичений” характер
нафталену) і взагалі, електронна густина
в молекулі нафталену розподілена не
зовсім рівномірно: -вуглецеві
атоми мають деякий надлишок електронної
густини, а -вуглецеві
атоми електронозбіднені. Унаслідок
цієї нерівноцінності вуглецевих атомів
реакції електрофільного заміщення
полегшуються і відбуваються переважно
в -положення. Окрім
того, нафтален більш здатний до реакцій
приєднання та окиснення, ніж бензен.
роте,
за даними рентгеноструктурного аналізу,
на відміну від бензену, СС-звязки
в молекулі нафталену не
однакові. Зв’язки між атомами 1 і 2 за
довжиною подібні до подвійних (іноді
кажуть про “ненасичений” характер
нафталену) і взагалі, електронна густина
в молекулі нафталену розподілена не
зовсім рівномірно: -вуглецеві
атоми мають деякий надлишок електронної
густини, а -вуглецеві
атоми електронозбіднені. Унаслідок
цієї нерівноцінності вуглецевих атомів
реакції електрофільного заміщення
полегшуються і відбуваються переважно
в -положення. Окрім
того, нафтален більш здатний до реакцій
приєднання та окиснення, ніж бензен.
Антрацен має ще менші ароматичні властивості, ніж нафтален, найбільш реакційноздатні положення 9 і 10. У фенантрену також найбільш реакційноздатні положення 9 і 10, причому зв’язок С9С10 нагадує подвійний.
У молекулі біфенілу бензенові ядра
сполучені -зв’язком
довжиною 0,148 нм (звичайна довжина
СС-зв’язку
0,154 нм). Причиною скорочення СарСар-зв’язку
є взаємна кон’юґація -електронної
густини обох бензенових ядер.
молекулі біфенілу бензенові ядра
сполучені -зв’язком
довжиною 0,148 нм (звичайна довжина
СС-зв’язку
0,154 нм). Причиною скорочення СарСар-зв’язку
є взаємна кон’юґація -електронної
густини обох бензенових ядер.
Проте унаслідок взаємного відштовхування водневих атомів (або замісників) в положеннях 2 і 2 мезомерна взаємодія утруднена, бо за відсутністю замісників ядра в біфенілі розташовані під кутом 45о, якщо в орто-положенні є об’ємні замісники, ядра розташуються взаємно перпендикулярно.

