
- •2. Равновесия в гетерогенных системах
- •2.1. Равновесия в насыщенных растворах малорастворимых электролитов
- •2.2. Условия образования осадка
- •2.3. Влияние ионной силы, одноименного иона и рН на растворимость осадков
- •2.4. Влияние комплексообразования на растворимость и условия осаждения малорастворимых соединений
2. Равновесия в гетерогенных системах
2.1. Равновесия в насыщенных растворах малорастворимых электролитов
В насыщенном растворе малорастворимого электролита состава МА равновесное состояние можно схематически представить следующим образом:
|
(2.1) |
тв.фаза раствор |
Константа
такого равновесия, равная произведению
активностей ионов, называется
термодинамической константой растворимости
![]() .
.
|
(2.2) |
Поскольку
в рассматриваемых системах концентрации
ионов очень малы, то в первом приближении
значения активностей могут быть заменены
на молярные концентрации этих ионов;
тогда константа растворимости будет
концентрационной
![]()
|
(2.3) |
Например, для сульфата бария константа растворимости записывается
![]()
Если состав осадка выражается формулой МmAn, то равновесие в насыщенном растворе его запишется схемой:
|
(2.4) |
Концентрационная константа растворимости будет равна
|
(2.5) |
Например,
![]()
![]()
Пользуясь константой растворимости, можно вычислять концентрации ионов малорастворимых солей в насыщенных растворах, концентрации реагентов-осадителей, необходимые для практически полного осаждения, оценить возможности образования осадка в заданных условиях. Приведем примеры вычислений.
Пример
1. Сколько
г сульфата кальция растворяется в 1 л
воды, если
![]() =
2.5×10-5
?
=
2.5×10-5
?
Решение. Запишем схему равновесия в рассматриваемой системе
|
|
тв.фаза раствор |
Обозначим молярную концентрацию соли в насыщенном растворе через х. Равновесные концентрации ионов Са2+ и SO42- будут также равны х М. Считая в первом приближении, что термодинамическая и концентрационная константы растворимости практически равны, запишем
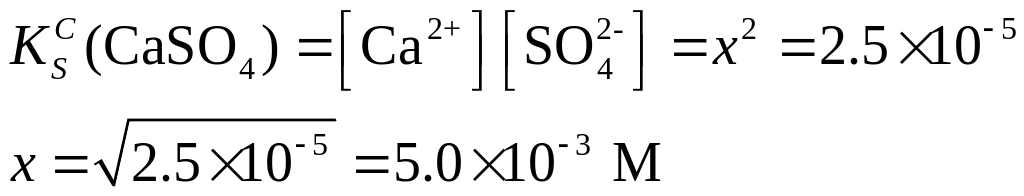
Молярная масса CaSO4 = 136 г/моль. Содержание CaSO4 в граммах на литр раствора (b) будет равно
b = 136×5×10-3 = 0.68 г/л.
Пример
2. В
1 л воды растворяется 0.000002149 г иодида
серебра. Вычислить
![]() .
.
Решение. Найдем молярную концентрацию иодида серебра в насыщенном растворе (х), молярная масса AgI 234.8 г/моль.
![]()
Поскольку
![]()
равновесные концентрации ионов в растворе будут также равны
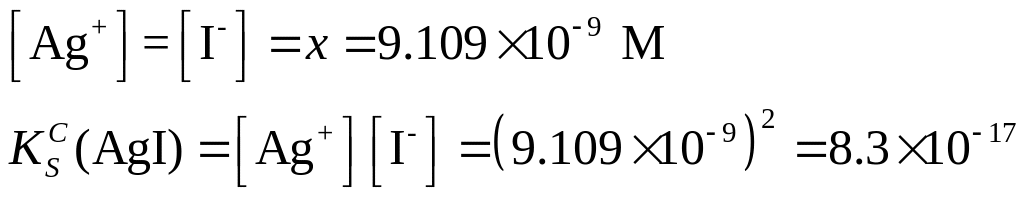
Пример
3. В
1 л воды растворяется 0.0002212 г фосфата
кальция. Вычислить
![]()
Решение. В данном случае равновесие описывается схемой
![]()
Найдем молярную концентрацию соли (х):
М(Са3(РО4)2) = 310 г/моль,
![]()
Молярная концентрация ионов Са2+ в насыщенном растворе в соответствии со схемой будет равна 3 x. a PO43- - 2x. Тогда
![]()
![]()
Пример
4. Какая
соль более растворима в воде - AgCl
или Ag2CrO4
и во сколько раз, если
![]() = 1.78×10-10,
a
= 1.78×10-10,
a
![]() =
l.1×10-12
?
=
l.1×10-12
?
Решение. Запишем схемы равновесий насыщенных растворов AgCl и Ag2CrO4
![]() (I)
(I)
![]() (II)
(II)
Найдем величины растворимости каждой соли, обозначив молярные концентрации AgCl и Ag2CrO4 через х и у.
В равновесии (I): [Ag+] = [Cl-] = x.
В равновесии (II): [CrO42-] = y; [Ag+] = 2y.
Подставим эти значения в выражения для констант растворимости
![]()
![]()
Отсюда
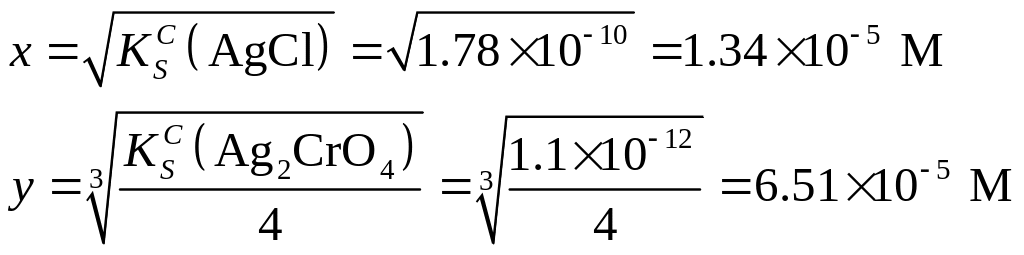
Следовательно, хромат серебра более растворим, чем хлорид. Найдем молярное отношение растворимостей
![]()
Для вычисления весового отношения определим содержание солей в г/л, обозначив их х1 и у1 соответственно.
M(AgCl)= 143.4 г/моль; M(Ag2CrО4) = 331.8 г/моль;
x1 = 1.34×10-5 × 143.4 = 1.92×10-3 г/л; у1 = 6.51×10-5 ×331.8 = 2.16×10-2 г/л;
![]()
З а д а ч и
Вычислить содержание вещества в г в насыщенных растворах солей
Сульфата кальция в 1 л.
Иодата лантана в 60 л.
PbCIF в 1 л.
Хлорида свинца в 175 мл.
Бромида таллия в 1500 мл.
Иодида таллия в 1500 мл.
Магния в 1 л магний-аммоний-фосфата.
Сколько молей кальция находится в 1 л насыщенного раствора карбоната кальция ?
Сколько молей кальция находится в 1 л насыщенного раствора фторида кальция ?
Сколько молей серебра находится в 500 мл насыщенного раствора хромата серебра ?
Сколько молей фосфат-иона находится в 200 мл насыщенного раствора магний- аммоний- фосфата?
184. Сколько молей серебра находится в 0.5 л насыщенного раствора арсената серебра?
Вычислить Ks по данным растворимости осадков
185. В 1 л воды растворяется 0.000174 г роданида серебра.
186. В 1 л воды растворяется 0.04892 г иодата серебра.
187. Растворимость бромата серебра в воде равна 1:571.
188. В 1 л воды растворяется 2.11×10-3 г сульфата радия.
189. В 100 мл воды растворяется 0.3412 г роданида таллия.
190. Растворимость иодата таллия в воде равна 1:1498.
В 1 л воды растворяется 1.140 г фторида бария.
В насыщенном растворе фторида свинца содержится 0.07182 г фторид-иона.
Растворимость хлорида свинца в воде равна 1:226.
В 1 л насыщенного раствора хлорплатината цезия содержится 0.7993 г иона [PtCl6]2-.
Растворимость K2SiF6 в воде равна 1:755.
Растворимость гексациано-(П) феррата серебра в воде равна 1:3.07×109.
В 500 мл воды растворяется 3.72×10-4 г гексациано-(Ш) феррата серебра.
Определить, какая соль более растворима и во сколько раз. Вычислить молярное и массовое отношения
Сульфат бария, сульфат свинца.
Хлорид серебра, бромид серебра.
Хлорид серебра, хромат серебра.
Оксалат кальция, фосфат кальция.
Сульфат свинца, фторид свинца.
Арсенат серебра, хлорид серебра.
Хромат бария, хромат стронция.
