
- •4.1. Загальні уявлення про хімічний зв'язок
- •4.2. Іонний зв’язок
- •4.3. Ковалентний зв’язок
- •4.3.1. Теорія Льюїса
- •4.3.2. Метод валентних зв'язків
- •4.3.3. Валентність при ковалентному типу зв’язку
- •4.3.4. Просторова будова молекул
- •4.3.5. Гібридизація електронних хмар
- •4.3.6. Перекривання електронних хмар при кратних зв’язках
- •4.3.7. Теорія молекулярних орбіталей
- •4.3.8. Сучасна теорія хімічного зв’язку
- •4.4. Донорно-акцепторний зв’язок
- •4.5. Водневий зв’язок
- •4.6. Основні кількісні характеристики хімічного зв’язку
- •4.7. Типи взаємодії між молекулами
- •4.8. Типи хімічного зв’язку між частинками в кристалах
- •Питання для самоперевірки
4.4. Донорно-акцепторний зв’язок
Основні типи хімічного зв’язку – це ковалентний та іонний зв’язки, але досить часто зустрічаються в хімічних сполуках й інші типи зв’язку, зокрема донорно-акцепторний.
Донорно-акцепторний зв’язок – це вид ковалентного зв’язку, який здійснюється без утворення нових електронних пар, тобто за рахунок неподіленої пари електронів, що належить тільки одному із з’єднуючих атомів.
Розглянемо
утворення донорно-акцепторного зв’язку
на прикладі NH![]() .
Іон амонію утворюється при взаємодії
молекули амоніаку з іоном Гідрогену:
NH3
+ H+
→ NH
.
В молекулі амоніаку три атоми Гідрогену
пов’язані з атомом Нітроґену ковалентним
зв’язком:
.
Іон амонію утворюється при взаємодії
молекули амоніаку з іоном Гідрогену:
NH3
+ H+
→ NH
.
В молекулі амоніаку три атоми Гідрогену
пов’язані з атомом Нітроґену ковалентним
зв’язком:
Н
. .
Н еподілена
пара електронів :N : Н
еподілена
пара електронів :N : Н
˙ ˙
Н
Неподілена пара Нітроґену буде загальною при взаємодії амоніаку з іоном водню:

 +
+
Н Н
 . .
. .
. .
. .
Н +
+ N : Н Н : N : Н
+
+ N : Н Н : N : Н
˙ ˙ ˙ ˙
Н Н
Заряд іону водню стає загальним зарядом іону амонію. Суть цієї взаємодії полягає у переході неподіленої пари азоту на вільну орбіталь іону Гідрогену
(в іона Гідрогену на орбіталях немає електронів). Атом, що поставляє свою неподілену пару на зв’язок, називається донором електронів, а атом, що приймає на свої вільні орбіталі цю пару електронів, – акцептором. Зв’язок називається донорно-акцепторним або координаційним. Утворений донорно-акцепторний зв’язок за всіма властивостями не відрізняється від звичайного ковалентного зв’язку: всі чотири атоми Гідрогену в NH однаково міцно пов’язані з атомом Нітроґену. Донорно-акцепторний зв’язок відрізняється від ковалентного лише способом утворення.
Донорами
електронів служать атоми неметалів, у
яких на зовнішньому рівні є неподілені
пари електронів:
![]() ,
,
![]() ,
,
![]() та
ін. Молекули або іони, до
складу яких
входять донорні атоми, називаються
лігандами.
Акцептори електронів – це найчастіше
позитивні іони металів або водню: Ag+,
Cu2+,
Fe3+
та ін. Акцептори електронів називають
центральними
іонами.
Сполуки, утворені за допомогою
донорно-акцепторного зв’язку, мають
назву комплексних
або координаційних:
наприклад [Cu(NH3)4]Cl2,
де Cu2+
– центральний іон, NH3
– ліганд. Центральний іон з найближчим
оточенням лігандів складає внутрішню
сферу комплексної сполуки (комплексу)
або комплексний іон [Cu(NH3)4]2+.
Заряд комплексного іона дорівнює
алгебраїчній сумі зарядів центрального
іона та лігандів. Іони Cl–
утворюють зовнішню сферу комплексу.
Число лігандів у внутрішній сфері
комплексу називається координаційним
числом.
У наведеному прикладі координаційне
число дорівнює 4. Найчастіше координаційні
числа приймають значення 2, 4 і 6.
та
ін. Молекули або іони, до
складу яких
входять донорні атоми, називаються
лігандами.
Акцептори електронів – це найчастіше
позитивні іони металів або водню: Ag+,
Cu2+,
Fe3+
та ін. Акцептори електронів називають
центральними
іонами.
Сполуки, утворені за допомогою
донорно-акцепторного зв’язку, мають
назву комплексних
або координаційних:
наприклад [Cu(NH3)4]Cl2,
де Cu2+
– центральний іон, NH3
– ліганд. Центральний іон з найближчим
оточенням лігандів складає внутрішню
сферу комплексної сполуки (комплексу)
або комплексний іон [Cu(NH3)4]2+.
Заряд комплексного іона дорівнює
алгебраїчній сумі зарядів центрального
іона та лігандів. Іони Cl–
утворюють зовнішню сферу комплексу.
Число лігандів у внутрішній сфері
комплексу називається координаційним
числом.
У наведеному прикладі координаційне
число дорівнює 4. Найчастіше координаційні
числа приймають значення 2, 4 і 6.
4.5. Водневий зв’язок
Водневий зв’язок можна розглядати як різновид донорно-акцепторного зв’язку. Відміна полягає в тому, що акцептором електронів при водневому зв’язку є не іон Н+ , а атом Гідрогену, що входить до складу полярної молекули. Розглянемо водневий зв’язок на прикладі молекул HF. Електронегативність Флуору більша електронегативності Гідрогену. Електронна хмара поділеної пари значно зміщена в бік Флуору
. .
Н → : F : .
˙ ˙
Внаслідок цього в атома Н орбіталі виявляються практично вільними і він приймає неподілену пару Флуору, що входить до складу сусідньої молекули:

Перша молекула Друга молекула
Відбувається асоціація молекул в димери, тримери і т.д. (рис. 16).
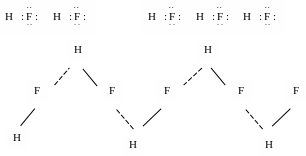
Рис. 16. Водневий зв’язок на прикладі молекул НF
Можна розглядати водневий зв’язок також з іншої точки зору: як взаємодію диполів. Наприклад, кожна молекула HF являє собою диполь
.
Диполі орієнтуються один відносно одного протилежно зарядженими кінцями і притягуються завдяки цим зарядам:

Відбувається асоціація молекул. Водневий зв’язок за міцністю набагато слабкіший звичайного ковалентного зв’язку. Переважно це зв’язок між молекулами, тому водневий зв’язок можна віднести до сил міжмолекулярної взаємодії. Але водневий зв’язок може утворюватися і між атомами однієї і тієї ж молекули. Тоді її відносять до хімічного зв’язку. Роль водневого зв’язку важлива, особливо при переході речовини з одного агрегатного стану в інший.
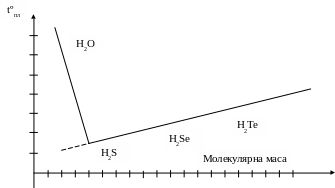
Розглянемо ряд водневих сполук елементів шостої групи періодичної системи: H2O, H2S, H2Se, H2Te. Температура плавлення твердих речовин зменшується від H2Te до H2S (рис. 17).
0
-20
-40
-60
-80
-100
-120
20 40 60 80 100 120 140 160 180
Рис. 17. Температура плавлення водневих сполук
Аномальна поведінка води пов’язана з наявністю водневих зв’язків. На розрив цих зв’язків витрачається енергія, і тому температура плавлення стає вищою, ніж температура сполук, які не мають водневих зв’язків.
