
- •4.1. Загальні уявлення про хімічний зв'язок
- •4.2. Іонний зв’язок
- •4.3. Ковалентний зв’язок
- •4.3.1. Теорія Льюїса
- •4.3.2. Метод валентних зв'язків
- •4.3.3. Валентність при ковалентному типу зв’язку
- •4.3.4. Просторова будова молекул
- •4.3.5. Гібридизація електронних хмар
- •4.3.6. Перекривання електронних хмар при кратних зв’язках
- •4.3.7. Теорія молекулярних орбіталей
- •4.3.8. Сучасна теорія хімічного зв’язку
- •4.4. Донорно-акцепторний зв’язок
- •4.5. Водневий зв’язок
- •4.6. Основні кількісні характеристики хімічного зв’язку
- •4.7. Типи взаємодії між молекулами
- •4.8. Типи хімічного зв’язку між частинками в кристалах
- •Питання для самоперевірки
4.3.7. Теорія молекулярних орбіталей
Енергетичний стан електрона в атомі має назву атомної орбіталі (АО). Енергетичний стан електронів, що беруть участь у зв’язку, називається молекулярною орбіталлю (МО). З певного числа атомних орбіталей утворюється таке ж число молекулярних орбіталей. З кожних двох атомних орбіталей утворюються дві молекулярні: зв’язувальна (МОзв), у якій енергія менша від енергії вихідних атомів орбіталей, і розпушувальна (МОроз), у якій енергія, навпаки, більша (рис. 14).

Рис. 14. Енергетична діаграма молекулярних орбіталей
Заповнення молекулярних орбіталей електронами підкоряється всім законам заповнення атомних орбіталей:
1. Молекулярні орбіталі заповнюються в порядку збільшення їх енергії, починаючи з орбіталей найнижчого енергетичного рівня.
2. Відповідно до принципу Паулі в молекулі не може бути двох електронів з усіма однаковими квантовими числами. Тому на кожній молекулярній орбіталі може знаходитися не більше двох електронів і тільки в тому випадку, коли спіни електронів антипаралельні.
3. Заповнення молекулярних орбіталей одного енергетичного підрівня підкоряється правилу Гунда. Спочатку енергетично рівноцінні МО заповнюються одиночними електронами, а потім відбувається спарювання нових електронів з тими, що є на орбіталі.
Теорія
молекулярних орбіталей пояснює багато
експериментальних фактів, які не змогла
розтлумачити теорія валентних зв’язків.
Наприклад, чому є стійка молекула Н2,
іон Не![]() і немає молекули Не2
(рис. 15).
і немає молекули Не2
(рис. 15).
Е МО роз Е МО роз Е МО роз
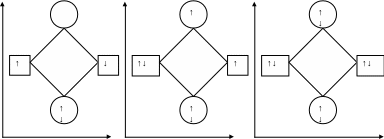
АО АО АО АО АО АО
1s 1
1s 1s 1s 1s 1s 1s
МОзв МОзв МОз
Н2 Не Не2
Рис. 15. Енергетична діаграма й заселеність орбіталей в молекулі Н2,
іоні Не і системі Не – Не
Стійка молекула утворюється тільки у випадку виділення енергії, тобто коли кількість електронів на зв’язувальних орбіталях більша, ніж на розпушувальних. Ця вимога виконується у випадку утворення Н2, Не і не виконується при утворенні Не2. Тому молекули гелію та інших інертних газів одноатомні.
4.3.8. Сучасна теорія хімічного зв’язку
Квантова хімія – сучасне вчення про хімічну і кристалохімічну будову речовини, а також про взаємозв’язок між будовою та властивостями на основі уявлень і методів квантової механіки. Таким чином, квантова хімія являє собою дисципліну на стику фізики й хімії і має першорядне значення для всієї сучасної хімії.
Усі відомості про будову й властивості молекул, радикалів, іонів можуть бути отримані розв’язуванням рівняння Шредингера для систем ядер і електронів. Однак точне розв’язування цього рівняння наштовхується на практично непереборні математичні труднощі, тому використовують наближені методи обчислювання.
У сучасній хімії застосовуються три методи квантово-механічного розглядання хімічних об’єктів: метод валентних зв’язків (МВЗ), метод молекулярних орбіталей (ММО) і теорія кристалічного поля (ТКП). Розрахунки в межах будь-якої з цих теорій наближені, але для даної молекули (або іншої частинки) вони повинні приводити до схожого результативного розподілу електронів по енергетичних рівнях. Для МВЗ і ММО найбільш суттєвим є усуспільнення зв’язувальних електронів, концентрування електронної компактності між ядрами атомів, перекривання електронних хмар взаємодіючих атомів.
ТКП застосовується для розрахунків у випадках іонних кристалічних граток і комплексних сполук. ММО трактує молекулу в цілому, тоді як для хімії більш важливі характеристики її окремих атомних сполук: валентних зв’язків і фрагментів молекули.
Ці питання більш наочно розглядає МВЗ. В той же час ММО автоматично враховує і стан молекул, чого не можна сказати про МВЗ.
Таким чином, три теорії хімічного зв’язку не виключають одна одну, а взаємно доповнюють.
