
Соединения элементов подгруппы хрома
Соединения Сr (0), Мо (0), W (0). Нулевая степень окисления у элементов проявляется в соединениях с -донорными и -акцепторными лигандами, например с молекулами СО. Для хрома и его аналогов известны гексакарбонилы Э(СО)6, Это — бесцветные легко возгоняющиеся твердые вещества (Тпл. 150—170 °С). Их молекулы диамагнитны, имеют форму октаэдра с атомом d-элемента в центре. В нулевой степени окисления атомам хрома и его аналогов можно приписать электронную конфигурацию d6:
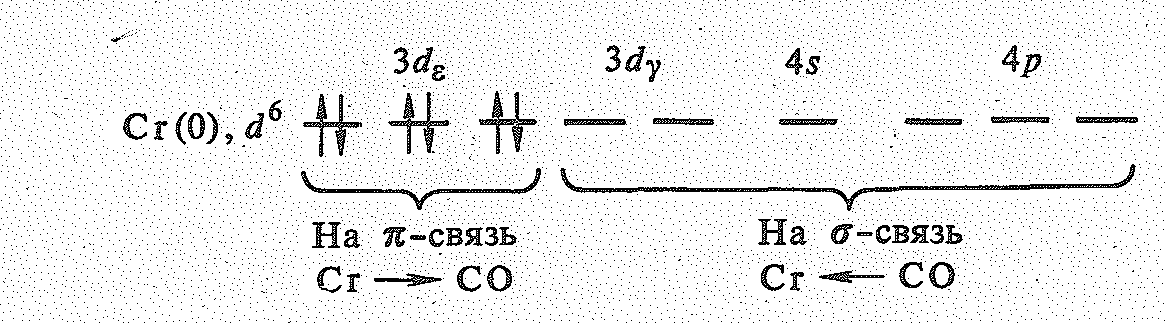

Рис. 1.
За счет шести свободных 3d24s4р3-орбиталей Сr(0) присоединяет шесть молекул СО. Стабилизация молекулы Сr(СО)6 достигается за счет -дативного взаимодействия Сr — СО, в котором принимают участие 3d-электронные пары атома хрома и свободные разр-орбитали молекул СО. Вследствие переноса заряда от СО к атому Сr (при -донорно-акцепторном взаимодействии) и от атома Сr к молекуле СО (при -дативном взаимодействии) результирующий заряд на атоме хрома оказывается положительным, Cr= 0,4+.
Если пренебречь -электронами молекул СО, электронную конфигурацию комплекса Сг(СО)6 можно выразить формулой (рис. 1).
Перенос заряда при образовании -связи М СО и -связи М СО приводит к уменьшению порядка связи в молекуле СО. Так, согласно инфракрасным спектрам для свободной молекулы СО частота валентных колебаний составляет СО= 2155 см-1, а для координированных СО-групп меньше — примерно 2000 см-1.
Карбонилы d-элементов (табл. 1) жидкости или кристаллические вещества, хорошо растворимые в органических растворителях. Как и СО, они чрезвычайно токсичны. Термическим разложением карбонилов получают чистейшие металлы. Кроме того, их используют в химическом синтезе. Карбонилы металлов синтезируют различными способами. Никель, железо и кобальт непосредственно реагируют с оксидом углерода (II), давая карбонилы. Обычно же их получают восстановлением соответствующих солей или комплексов металлов в присутствии СО.
Таблица 1.
К арбонилы
могут быть одно-, двух- и многоядерными.
Одноядерные карбонилы образуют d-элементы
с четным числом валентных электронов.
d-Элементы
с нечетным числом валентных электронов
образуют двухъядерные карбонилы
кластерного типа со связью М—М. Кроме
двухъядерных известны и другие карбонилы
кластерного типа, например Fе3(СО)12,
Со4(СО)12,
Rh6(СО)16.
арбонилы
могут быть одно-, двух- и многоядерными.
Одноядерные карбонилы образуют d-элементы
с четным числом валентных электронов.
d-Элементы
с нечетным числом валентных электронов
образуют двухъядерные карбонилы
кластерного типа со связью М—М. Кроме
двухъядерных известны и другие карбонилы
кластерного типа, например Fе3(СО)12,
Со4(СО)12,
Rh6(СО)16.
Как указывалось, по многим свойствам с молекулой СО сходна молекула N2. Последняя в частности, способна к -донорному и -акцепторному дативному взаимодействию и может выступать в качестве лиганда в комплексных соединениях. Большой теоретический и практический интерес представляют соединения, в которых роль лиганда играют молекулы азота. К подобным соединениям, называемым нитрогенильными, относится, например [Ru(NН3)5(N2)]Сl2.
Образование комплексов с участием молекул N2 в качестве лигандов играет важную роль при фиксации атмосферного азота микроорганизмами, а также в процессе каталитического синтеза аммиака. По-видимому, в естественных условиях (обычные температура и давление) биохимическое связывание атмосферного азота осуществляется с участием комплексов Fе и Мо.
Соединения Сr (II), Мо (II), W (II). Для хрома в степени окисления +2 характерно координационное число 6. Это соответствует образованию, как правило, высокоспиновых комплексов (и структурных единиц) электронной конфигурацией (а)
( |
(б)
|
Поскольку из двух орбиталей dразр -уровня занята только одна орбиталь (б) высокоспиновые октаэдрические комплексы геометрически искажены: два лиганда находятся на большем расстоянии, чем четыре остальных. Так, в кристалле СrСl2 четыре атома хлора удалены от Сr (II) на 0,239 нм, а два других — на 0,290 нм.
При удалении электрона с разрыхляющей орбитали возникает особо устойчивая конфигурация (св)I2(d)3:

Поэтому соединения хрома (II) — сильные восстановители. Для хрома (II) известно лишь небольшое число бинарных соединений, в частности дигалогениды СrНаl2, гидроксид Сг(ОН)2. Оксид хрома (II) СrО (черный) получить очень трудно, и факт его существования подвергается сомнению.
Бинарные соединения хрома (II), а также Сr(ОН)2 проявляют практически лишь основные свойства. Например, Сr(ОН)2 (желтый) взаимодействует только с кислотами:
Сr(ОН)2 + 2ОН3+ + 2Н2O = [Сr(OН2)6]2+
Образующиеся при этом аквокомплексы [Сr(ОН2)6]2+ синего цвета; такую же окраску имеют кристаллогидраты, например Сr(СlO4)24Н2O, CrSO45H2O, CrCl24H2O, СrВr26Н2O.
Дигалогениды довольно легко поглощают газообразный аммиак, образуя аммиакаты, например [Сr(NH3)6]Сl2. Будучи сильными восстановителями
Сr3+ (р) + е- = Сr2+ (р), Еo = — О,407 В
соли Сr (II) в растворах легко окисляются кислородом воздуха:
4[Сr(OН2)6]2+ + O2 + 4Н+ = 4[Сr(OН2)6]3+ + 2Н2O
а при отсутствии окислителя даже восстанавливают воду, постепенно ее разлагая с выделением водорода:
2СrСl2 + 2H2O = 2Сг(ОН)Сl2 + Н2
Соединения Сr (II) получают восстановлением соединений Сr (III), например водородом в растворе в момент выделения, или нагреванием в атмосфере Н2. Дигалогениды можно получить также взаимодействием металла с газообразными ННад (при. 600—700 °С).
Производные Мо (II) и W (II) малочисленны. Из их бинарных соединений в основном изучены дигалогенидьг ЭНаl2.
Кластерные соединения. Для d-элементов характерны соединения, в которых содержатся группировки из двух и большего числа непосредственно связанных друг с другом атомов d-элементов. Такие группировки называются кластерами. Известные в настоящее время кластерные соединения распадаются на два больших класса:
1) низшие галогениды и оксиды и 2) многоядерные карбонилы.
Кластеры первого типа в основном образуются 4d- и 5d-элементами V—VII групп (Nb и Та, Мо и W, Тс и Rе). Среди галогенидов и оксидов найдены двух-, трех- и шестиядерные кластеры. Примером шестиядерного (октаэдрического) кластерного соединения является дихлорид молибдена МоСl2 (желтого цвета). По данным рентгеноструктурного анализа, МоСl2 отвечает .формула [Мо6Сl8]Сl4. Комплекс [Мо6Сl8]Сl4 диамагнитен. Шесть атомов молибдена находятся в центрах граней куба, образуя октаэдр Мо6; восемь атомов хлора расположены в вершинах куба, каждый атом Сl связан с тремя атомами Мо. Внешнесферные ионы Сl выполняют роль мостиков, объединяющих кластеры [Мо6Сl8]4+ между собой.

Рис. 2. Структура октаэдрических кластеров типа М6Х8
(на примере иоми Мо6Сl84+) и типа М6Х12 (на примере иона Nb6Cl122+)
Д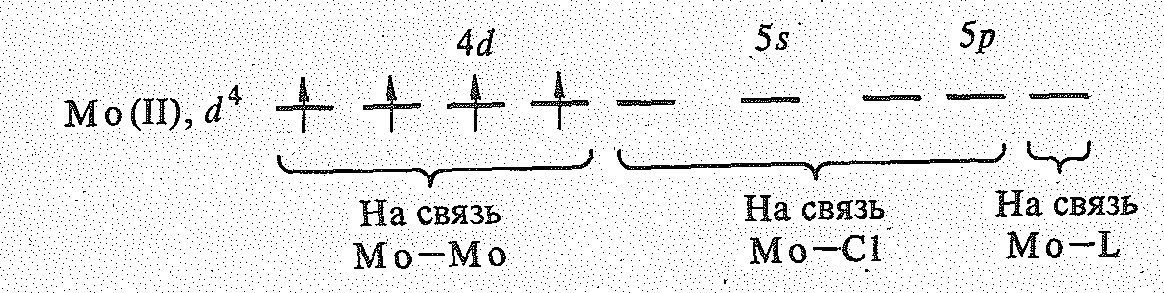 ля
объяснения строения комплекса
воспользуемся чисто качественными
представлениями. Каждый из атомов Мо
на образование ковалентных связей Мо—Мо
с четырьмя соседними атомами Мо
представляют четыре электрона. Четыре
свободные орбитали от каждого атома Мо
используются на образование
донорно-акцепторных связей Мо—Сl:
ля
объяснения строения комплекса
воспользуемся чисто качественными
представлениями. Каждый из атомов Мо
на образование ковалентных связей Мо—Мо
с четырьмя соседними атомами Мо
представляют четыре электрона. Четыре
свободные орбитали от каждого атома Мо
используются на образование
донорно-акцепторных связей Мо—Сl:
Кластерная группировка [Мо6Сl8]4+ устойчива и может, не изменяясь переходить в другие соединения. Так, при действии на МоСl2 щелочей образуется основание [Мо6Сl8](ОН)4, которое при взаимодействии с кислотами дает соли этого иона. Группировка [Мо6Сl8]4+, кроме того, может выступать в качестве комплексообразователя, координируя шесть лигандов по одному к каждому из атомов Мо, с образованием комплексов [Мо6Сl8L6]. Например, получены производные иона [(МобСl8)Сl6]2-, а также соединение [(Мо6Сl8)(ОН)4(ОН2)2]12Н2O и др. Строение МоВr2, ‚WСl2, WВr2 аналогично строению МoСl2.
Среди шестиядерных кластеров весьма распространена группировка типа М6Сl12. Она обнаружена в РtСl2 (РtбСl12), WСl3 ([W6Сl12]Сl6), Nb6С114 ([Nb6Сl12]Сl2) и др.
К треугольным кластерам относятся галогениды рения (III) и их производные. Так, кристалл RеСl3 построен из группировок Rе3Сl9, в которых атомы Rе непосредственно объединены в треугольник (рис. 2). Межъядерное расстояние dRе-Rе составляет 0,248 нм. Оно на 0,027 нм короче межъядерного расстояния в металлическом кристалле рения (dRе-Rе = 0,275 нм). Следовательно, связь металл — металл здесь очень прочная; ей приписывают кратность равную двум: Rе = Rе. Поэтому группировка Rе3Сl9 очень прочная и сохраняется при переводе RеСl3 в газовое состояние (вплоть до 600°С). При взаимодействии RеСl3 с концентрированной НСl образуется тримерный ион [Re3Cl12]3- (рис. 2),
|
|
Рис. 3. Структура треугольных кластеров типа М3Х9 на примере RеСl3 и типа М3Х12 |
|
dRe-Re = 0,248 нм. Примерами производных кластеров [Rе3Наl12]3- являются соли типа М+13[Rе3Наl12] (красного цвета).
К
 двухъядерным кластерам относятся ионы
[Мо2Сl8]4-
и [Rе2Х8]2-
(Х = С1, Вr,
SСN).
Экспериментально установлено, что в
ионе [Rе2Сl8]2-
(рис. 3) межъядерное расстояние dRe-Re
составляет всего 0,224 нм, т. е. на 0,05 1 нм
короче, чем dRe-Re
в металле (0,275 нм). Столь необычно
короткое расстояние и диамагнетизм
этого иона свидетельствуют о четверной
связи Rе
Rе
(одна -с
вязь,
две -связи
и одна -связь).
Аналогичным образом четверная связь
Мо
Мо проявляется в диамагнитном ионе
[Мо2Сl8]4-,
dМо-
Мо = 0,214 нм
(в металле 0,278 нм).
двухъядерным кластерам относятся ионы
[Мо2Сl8]4-
и [Rе2Х8]2-
(Х = С1, Вr,
SСN).
Экспериментально установлено, что в
ионе [Rе2Сl8]2-
(рис. 3) межъядерное расстояние dRe-Re
составляет всего 0,224 нм, т. е. на 0,05 1 нм
короче, чем dRe-Re
в металле (0,275 нм). Столь необычно
короткое расстояние и диамагнетизм
этого иона свидетельствуют о четверной
связи Rе
Rе
(одна -с
вязь,
две -связи
и одна -связь).
Аналогичным образом четверная связь
Мо
Мо проявляется в диамагнитном ионе
[Мо2Сl8]4-,
dМо-
Мо = 0,214 нм
(в металле 0,278 нм).
|
Рис. 4. Структура двухъядерного кластера типа М2Х8 на примере К2Rе2Сl82Н2O. Если принять, что ось проходит через атомы Rе, то возникновение связи можно объяснить следующим образом: -связь образуется перекрыванием dZ2-орбиталей, две -связи взаимодействием dxz и dyz-орбиталей и -связь перекрыванием dxy-орбиталей: |

В качестве производных кластера [Rе2Сl8]2- можно назвать М2[Rе2Сl8]2H2O.
Двухъядерным кластерным оксидом является МоО2. Этот оксид в твердом состоянии имеет структуру, близкую типу рутила, с межъядерными расстояниями dMo-Mo, равными 0,250 и 0,310 нм. Более короткое из них является расстоянием для пары связанных между собой атомов молибдена. Соединение диамагнитно, что соответствует такому объяснению. Найдено, что кластерная группировка М2 для диоксидов со структурой типа рутила проявляется в WO2, TеО2, ReO2‚VО2.
С оединения
кластерного типа весьма характерны для
ниобия и тантала. Среди кластеров этих
элементов лучше изучены галогениды.
Вследствие особенностей структуры
состав галогенидов обычно не отвечает
целочисленным степеням окисления
элементов, например:
оединения
кластерного типа весьма характерны для
ниобия и тантала. Среди кластеров этих
элементов лучше изучены галогениды.
Вследствие особенностей структуры
состав галогенидов обычно не отвечает
целочисленным степеням окисления
элементов, например:
Атомы Nb и Та чаще всего объединяются в октаэдрические и треугольные группировки (рис. 3). Устойчивые октаэдрические кластерные группировки Э6Наl12 обнаружены также в кристаллогидратах типа Nb6Сl147Н2О, Nb6Вr14 7Н2O, Та6Сl147Н2O. Последние в растворе распадаются на ионы [ЭНаl12]2+ и 2Наl-. При действии солей Аg+ из растворов сразу осаждается только 2 моля галогенид-ионов в расчете на 1 моль соединения.
Кроме перечисленных известны также галогениды ниобия и тантала переменного состава, например NbCl3 – NbCl3,13, ТаСl2,9—ТаСl3 и др.
К соединениям кластерного типа относятся также низшие оксиды ниобия и тантала. Так, NbО состоит из кластерных группировок Nb6O12. Полагают, что связи М—М проявляются также в низших оксогалогенидах NbOI2, ТаОСl2.
В кластерных галогенидах атомы d-элемента используют в образовании связи М—М и М—Наl все свои валентные электроны (Тс и Rе—7, Мо и W—б, Nb и Та—5) независимо от степени окисления. Таким образом, стремление к использованию всех своих валентных электронов на образование химических связей у 4d- и 5d-элементов осуществляется либо за счет образования соединений, в которых они проявляют высшую степень окисления, либо за счет образования кластерных соединений.
Следовательно, переход от металла к галогениду (или оксиду) не обязательно связан с разрушением всех связей между атомами металла и полной заменой их на связи металл — галоген. Обычно многие металлы d-элементов характеризуются высокими энтальпиями атомизации, т. е. разрыв связей между атомами d-элементов требует большой затраты энергии. Поэтому при образовании низшего галогенида некластерного типа энергия, выделяемая при образовании связей М—Наl, оказывается недостаточной для компенсации энергии, затрачиваемой на разрыв всех связей М—М.
С оединения
Сr
(III), Мо (III),
W
(III). У хрома
степень окисления +3 является наиболее
устойчивой. Координационное число хрома
(III) равно шести, поэтому его комплексы
(структурные единицы) имеют форму
октаэдра. Валентные электроны в
октаэдрических комплексах Сr
(III)
располагаются только на связывающих и
несвязывающих орбиталях:
оединения
Сr
(III), Мо (III),
W
(III). У хрома
степень окисления +3 является наиболее
устойчивой. Координационное число хрома
(III) равно шести, поэтому его комплексы
(структурные единицы) имеют форму
октаэдра. Валентные электроны в
октаэдрических комплексах Сr
(III)
располагаются только на связывающих и
несвязывающих орбиталях:
Наличие трех непарных электронов обусловливает парамагнетизм производных Сr (III). Большинство соединений Сr (III) интенсивно окрашено.
Оксид хрома (III) Сr2O3 темно-зеленый порошок, а в кристаллическом состоянии черный с металлическим блеском. Структура Сr2О3 соответствует октаэдро-тетраэдрической координации атомов (структура типа -Аl2O3). Оксид хрома (III) тугоплавок (Tпл. 2265 °С), химически инертен. В воде, кислотах и щелочах не растворяется. Его амфотерная природа проявляется при сплавлении с соответствующими соединениями. Так, при сплавдении Сr2O3 с дисульфатом калия образуется сульфат хрома (III):

А при сплавлении Сr2О3 со щелочами и соответствующими основными оксидами образуются оксохроматы (III), называемые хромитами:
2КОН + Сr2O3 = 2КСrО2 + Н2O
кислотный
Оксохроматы (III) d-элементов типа M+2(СrО2)2 являются координационными полимерами, т. е. смешанными оксидами (типа шпинели). В их кристаллах атомы М (II) находятся в тетраэдрическом, а атомы Сr (III) в октаэдрическом окружении атомов кислорода. Смешанным оксидом Сr (III) и Fе (II) является природный хромит — хромистый железняк FеСr2О4.
Осаждаемый из растворов серо-синий гидроксид Сr(ОН)3
Сr3+ + 3OН- = Сr(ОН)3
имеет переменный состав Сr2О3nН2О. Это многоядерный слоистый полимер, в котором роль лигандов играют ОН- и ОН2, а роль мостиков — ОН-группы:

Его состав и структура зависят от условий получения. При стоянии и в особенности при нагревании Сr2O3nН2O вследствие замены связей Сr—ОН—Сr на связи Сr—О—Сr теряет активность. Свежеполученный Сr(ОН)3 (т. е. Сr2O3nН2O ) хорошо растворяется в присутствии кислот и щелочей, которые вызывают разрыв связей в слоистом полимере:
Сr(ОН)3 + 3ОН3+ = [Сr(ОН2)6]3+
основный
Сr(ОН)3 + 3OН- = [Сr(ОН)6]3-
кислотный
Получение гидроксида хрома (III) и его переход в катионные [Сr(ОН2)6]3+ и анионные [Сr(ОН)6]3- комплексы можно выразить следующим суммарным уравнением:

Аквокомплекс [Сr(OН2)6]3+ сине-фиолетового цвета, входит в состав ряда кристаллогидратов Сr (III), например в фиолетовые СrСl36Н2O, СrВr36Н2O, M1+Сr(SО4)212Н2O (квасцы). Результаты рентгеноструктурного анализа и окраска хромовых квасцов говорят в пользу структуры [М(OH2)6][Сr(ОН2)6](SO4)2. Таким образом, квасцы представляют собой двойные соли. Они образуются при взаимодействии растворов М+12SO4 и Сr2(SО4)3. Квасцы, как и некоторые другие производные Сr (III), используются в качестве протравы в красильном деле и при дублении кожи.
В зависимости от условий (температура, концентрация, рН) состав катионных аквокомплексов изменяется, что сопровождается изменением их окраски от фиолетовой до зеленой. Например:

Т ак,
твердый шестиводный кристаллогидрат
СrСl36H2O
в зависимости от ориентации молекул
воды и хлорид-ионов имеет следующие
изомерные формы:
ак,
твердый шестиводный кристаллогидрат
СrСl36H2O
в зависимости от ориентации молекул
воды и хлорид-ионов имеет следующие
изомерные формы:
Изомерия, обусловленная неодинаковым распределением молекул воды и внешнесферных ионов между внутренней и внешней сферами комплексных соединений, называется гидратной.
Существование указанных изомеров можно доказать с помощью следующего эксперимента. При высушивании в эксикаторе с концентрированной серной кислотой [Сr(OН2)6]Сl3 воду не теряет, [Сr(ОН2)5Сl]Сl2Н2O теряет 1 моль, а. [Сr(ОН2)4Сl2]Сl2Н2O — 2 моля воды в расчете на 1 моль взятого изомера. При действии же АgNО3 на растворы этих соединений немедленно осаждается соответственно 3, 2 и 1 моль ионов Сl. Дополнительные доказательства правильности выбранных формул можно получить при измерении электрической проводимости: наибольшей электрической проводимостью обладает раствор [Сr(OН2)6]Сl3, меньшей — раствор [Сr(ОН2)5Сl]Сl2Н2O и еще меньшей — раствор [Сr(ОН2)4Сl2]Сl2Н2O, что находится в полном согласии с уменьшением числа ионов, на которые распадаются при одинаковой молярной концентрации эти соединения.
Трихлорид хрома СrСl3 красно-фиолетового цвета. Его получают при пропускании хлора над раскаленным металлом или нагретой докрасна смесью Сr2O3 и древесного угля:
Сr2O3 + 3С + 3Сl2 = 2СrСl3 + 3СО
Здесь уместно подчеркнуть, что безводные соединения по своей структуре и свойствам существенно отличаются от соответствующих кристаллогидратов. Так, СrСl3 полимерен (слоистая структур а, рис. 4, а), тогда как кристаллы СrСl36H2O имеют островную структуру. В частности, СrСl3 в отличие от СrСl36H2O в воде растворяется исключительно медленно.
Аналогично Сr2(SO4)3 (розового цвета) в воде растворяется плохо, а Сr2(SO4)3 18Н2O (фиолетового цвета) хорошо.
|
|
Рис. 5. Структура слоя, образованного октаэдрическими структурными единицами АB6, соединения типа АВ3 (а) и соединения типа АВ2 (б) |
|
В растворе соли Сr
(III) в большей или меньшей степени
гидролизуются. Как первую стадию
гидролиза галогенидов, сульфата, нитрата
Сr
(III) можно рассматривать образование
гидроксопентааквокомплекса
[Сr(ОН)(ОН2)5]2+:
растворе соли Сr
(III) в большей или меньшей степени
гидролизуются. Как первую стадию
гидролиза галогенидов, сульфата, нитрата
Сr
(III) можно рассматривать образование
гидроксопентааквокомплекса
[Сr(ОН)(ОН2)5]2+:
Далее может происходить полимеризация этих комплексов.
Н
 апример,
в случае сульфата хрома в зависимости
от температуры, рН. концентрации
образуются следующие продукты:
апример,
в случае сульфата хрома в зависимости
от температуры, рН. концентрации
образуются следующие продукты:
При этом раствор из фиолетового становится зеленым.
П ри
попытке получить в водном растворе по
обменным реакциям Cr2S3
или Сг2(СО3)3
вследствие гидролиза выделяется
гидроксид:
ри
попытке получить в водном растворе по
обменным реакциям Cr2S3
или Сг2(СО3)3
вследствие гидролиза выделяется
гидроксид:
Кроме аквокомплексов для Сr(III) известны катионные амминокомплексы
[Сr(NН3)6]3+ (фиолетового цвета). Аммиакатьы в твердом состоянии устойчивы. В водных же растворах они постепенно разрушаются:
![]()
Поэтому получение аммиакатов всего легче осуществляется в неводных растворах или в жидком аммиаке,
П роизводные
анионных комплексов хрома (III)
— хроматы (III)
весьма разнообразны. Ниже приведены
уравнения реакций их получения:
роизводные
анионных комплексов хрома (III)
— хроматы (III)
весьма разнообразны. Ниже приведены
уравнения реакций их получения:
Ионы [Сr(ОН)6]3- окрашены в изумрудно-зеленый цвет. Гидрооксохроматы (III) устойчивы в твердом состоянии, а в растворах — лишь при большом избытке щелочи. В чистой воде они разрушаются. Другие хромат (III)-ионы более устойчивы. Так, при действии ВаСl2 на раствор Н3[Ст(SО4)3] осадок ВаSO4 образуется лишь при нагревании раствора.
Кроме гексахлорохроматов (III) известны комплексные хлориды состава 3КСlСrСl3, которые являются производными двухьядерных комплексов [Сг2Сl9]3-. Структур а последних отвечает сдвоенным октаэдрам СrСl6 с общей гранью.
Как показывают исследования, ион [Сг2Сl9]3- парамагнитен и имеет три непарных электрона. Однотипный же ион [W2Сl9]3- диамагнитен. Кроме того, расстояние между атомами Сr в[Сг2Сl9]3- на 0,07 нм больше, чем расстояние между более крупными атомами W в [W2Сl9]3-. Все это показывает, что в отличие от [Сг2Сl9]3- ион [W2Сl9]3- — кластер, между атомами W непосредственно осуществляется тройная связь (одна и две ).
Поэтому межъядерное расстояние dW-W в ионе [W2Сl9]3- значительно короче (0,240 нм), чем в металлическом вольфраме (0,280 нм).
С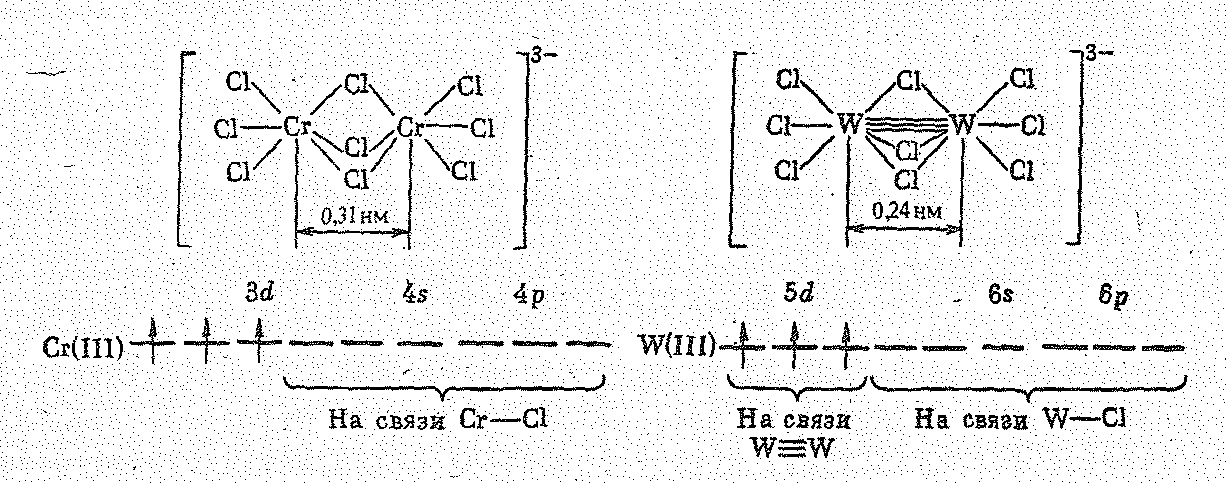
 оединения
Сr
(VI),
Мо (VI),
W
(VI).
Степень окисления +6 хрома, молибдена и
вольфрама проявляется в галогенидах,
оксогалогенидах, оксидах и отвечающих
им анионных комплексах:
оединения
Сr
(VI),
Мо (VI),
W
(VI).
Степень окисления +6 хрома, молибдена и
вольфрама проявляется в галогенидах,
оксогалогенидах, оксидах и отвечающих
им анионных комплексах:
Для хрома (VI) характерно координационное число 4, что отвечает тетраэдрическому строению его анионных комплексов и структурных единиц. Координационные числа молибдена (VI) и вольфрама (VI) разнообразнее; относительно более устойчивы 4 и 6.
В ряду однотипных производных Сr (VI) — Мо (VI) — W (VI) устойчивость заметно повышается. Об этом в частности, свидетельствует сопоставление значений энергии Гиббса образования соединений, например:

Для хрома (VI) относительно устойчивы лишь оксид СгО3 и оксогалогениды СrО2Сl2 и СrО2F2. Для молибдена (VI) и вольфрама (VI) характерны, кроме того, фториды ЭF6 (а также МоСl6, ‚WСl6 и WВr6), оксогалогениды ЭОНаl4, сульфиды ЭS3.
Гексафторид хрома СrF6 плохо изучен. Это очень неустойчивый лимонно-желтый порошок. Гексафториды аналогов хрома: МоF6 бесцветная жидкость (Tпл. 18 °С, Tкип. 34 °С) и WF6 — бесцветный газ (Tпл. 2 °С, Tкип. 17 °С) — значительно устойчивее. Образуются при взаимодействии простых веществ. В отличие от SF6 они весьма реакционноспособны, например, легко разлагаются водой с образованием оксогалогенидов и НЕ. Кислотная природа ЭF6 проявляется также во взаимодействии с основными фторидами:
ЭF6 + КF = КЭF7
Для хрома более характерны оксогалогениды СrО2Наl2: коричнево-красный СrО2F2 (Tпл. 30 °С) и красно-бурый СrО2Сl2, (Tпл. —96,5 °С, Tкип.117 °С). Последнее соединение (хлористый хромил) — жидкость образуется при взаимодействии сухого СrО3 с газообразным НСl:
СrО3 + 2НСl = СrО2Сl2 + Н2O
М олекулы
ЭО2Наl2
имеют форму искаженного тетраэдра с
атомом Э в центре:
олекулы
ЭО2Наl2
имеют форму искаженного тетраэдра с
атомом Э в центре:
Для молибдена и вольфрана кроме ЭО2Наl2 характерны оксогалогениды состава ЭОНаl4. Оксогалогекниды Мо (VI) и W (VI) — твердые вещества, обычно летучие. Оксогалогениды — кислотные соединения с некоторыми признаками амфотерности.
В отличие от однотипных производных серы SО2Наl2 гидролиз ЭО2Наl2 обратим:
ЭО2Наl2 + 2Н2О Н2ЭО4 + 2ННаl
Равновесие гидролиза СrО2Сl2 смещено вправо, а МоО2Сl2 и WO2Сl2 гидролизуются в меньшей степени. Это свидетельствует об ослаблении кислотных признаков в ряду СrО2Сl2— МоО2Сl2—WO2Сl2.
Оксогалогенидам хрома (VI) отвечают соли типа М[СrО3Наl], а производным молибдена и вольфрама — М+12[ЭО2Наl4] (Наl =F и Сl) и М+13[ЭO3F3]. Триоксохлорохроматы (VI) — кристаллические вещества оранжевого цвета. Их можно получить взаимодействием растворов СrО3 и основных хлоридов например:
КСl + СrO3 = К[СгО3Сl]
Триоксогалогенохроматы (VI) в воде постепенно гидролизуются. Соответствующие соединения Мо (VI) и W(VI) устойчивее.
Триоксиды — кристаллические вещества: СrО3 темнокрасный, МоО3 — белый и WО3 — желтый. МоO3 имеет слоистую, а WО3 координационную решетку, структурной единицей которых являются октаэдры ЭО6. СrО3 имеет цепочечную структуру образованную тетраэдрами СrО4.
При нагревании СrО3 (Tпл. 197 °С) довольно легко разлагается, выделяя кислород, а МоO3 (Tпл. 801 °С, Tкип. 1155 °С )и WО3 (Tпл. 1473 °С, Tкип. —1670 °С) в газовую фазу переходят без разложения. Триоксид хрома — энергичный окислитель. Со многими окисляющимися веществами он реагирует со взрывом. СrО3 ядовит!
Триоксид хрома СrО3 в отличие от МоО3 и WO3 легко растворяется в воде, образуя хромовую кислоту, т. е. является кислотным оксидом:
Н2О + СrО3 = Н2СrО4
Кислотная природа МоO3 и WО3 проявляется при растворении в щелочах:
2КОН + ЭО3 = К2ЭO4 + Н2O
Тетраоксохромат (VI) водорода Н2СrО4 в свободном состоянии не выделен. В водном растворе — это кислота средней силы, называется хромовой.
Растворимы в воде оксохроматы (VI), оксомолибдаты (VI) и оксовольфраматы (VI) s-элементов I группы, а также Мg2+ и Са2+. Ион СrО2-4 имеют желтую окраску, ионы МоО2-4 и WО2-4 бесцветны.
Д ля
Мо (VI)
и W
(VI)
известны многочисленные производные
полимерных оксоанионов весьма сложного
состава и строения. Способность к
полимеризации иона СrО42-
выражена менее отчетливо, тем не менее
известны, например, К2Сr2О7
— дихромат, К2Сr3O10
— трихромат, К2Сr4O13
— тетрахромат. Все они содержат анионы,
образованные тетраэдрами СrО4,
соединенными в цепь. Строение иона
Сr2O2-7
показано
ниже:
ля
Мо (VI)
и W
(VI)
известны многочисленные производные
полимерных оксоанионов весьма сложного
состава и строения. Способность к
полимеризации иона СrО42-
выражена менее отчетливо, тем не менее
известны, например, К2Сr2О7
— дихромат, К2Сr3O10
— трихромат, К2Сr4O13
— тетрахромат. Все они содержат анионы,
образованные тетраэдрами СrО4,
соединенными в цепь. Строение иона
Сr2O2-7
показано
ниже:
Полихроматы образуются при действии кислот на хроматы. Так если на крепкий раствор хромата калия подействовать кислотой, то его окраска сначала станет красно—оранжевой, потом изменится до более темной за счет образования дихроматов, затем трихроматов и т.д.:
2СrО2-4 + 2Н+ = Сr2О2-7 + Н2O
3Сr2О2-7 + 2Н+ = 2Сr3О2-10 + Н2O и т. д.
В результате дальнейшего подкисления раствора концентрированной серной кислотой при охлаждении выделяются темно—красные кристаллы триоксида:
К2СrO4 + Н2SO4 = СrO3 + К2SO4 + Н2O
Если же действовать на растворы полихроматов щелочью, процесс идет в обратном направлении и в конечном счете получается снова хромат. Взаимные переходы хромата и дихромата можно выразить уравнением обратимой реакции:
2СгО2-4 + 2Н+ 2НСrO4 Сr2О2-7 + Н2O
Это равновесие очень подвижно. Его можно сместить изменением характера среды, осаждением нерастворимых хроматов Ва2+, Рb2+, Аg+, у которых произведение растворимости меньше, чем у соответствующих дихроматов. Из оксохроматов (VI) наибольшее значение имеют соли Na+ и К+, которые получают сплавлением Сr2O3 или хромистого железняка с соответствующими карбонатами при 1000—1300 °С на воздухе. При этом Сr (III) окисляется до Сr (VI):
4Fе(Сr+3O2)2 + 8Nа2СO3 + 7O2 = =8Nа2Сr+6О4 + 2Ге2O3 + 8СO2
Дихромат натрия Nа2Сr2O72Н2O выделяют из подкисленных растворов Nа2СrО4 . Из раствора Nа2Сr2O7 осаждением при помощи КСl получают менее растворимый К2Сr2O7.
Д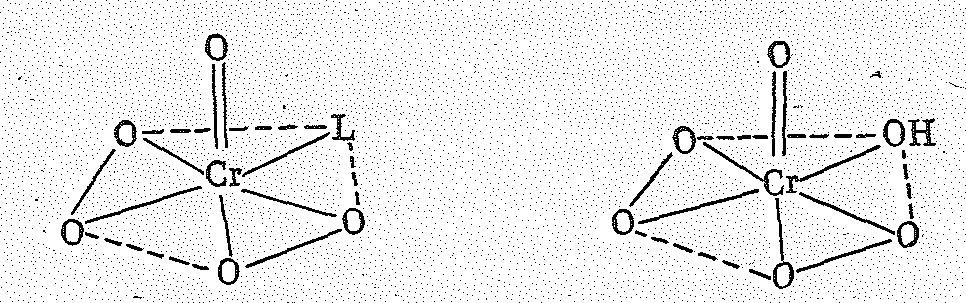 ля
хрома известны разнообразные
пероксо-комплексы, например голубой
СrО(О2)2L
(L
— молекулы воды или эфира) и фиолетовый,
вероятно, состава [СrО(O2)2OН]-.
Эти комплексы имеют форму пентагональной
пирамиды с атомом кислорода в вершине:
ля
хрома известны разнообразные
пероксо-комплексы, например голубой
СrО(О2)2L
(L
— молекулы воды или эфира) и фиолетовый,
вероятно, состава [СrО(O2)2OН]-.
Эти комплексы имеют форму пентагональной
пирамиды с атомом кислорода в вершине:
СrО(О2)2L [СrО(O2)2OН]-
Голубой СrО(O2)2L образуется при обработке кислого раствора дихромата перекисью водорода:
Сr2O2-7 + 4Н2O2 + 2Н+ + L = 2СrО(O2)2L + 5Н2O
В водном растворе СrО(O2)2L нестоек, более устойчив в эфире; при распаде выделяет кислород и превращается в аквокомплексы Сr (III).
Производные [СrО(O2)2OН]- образуются при действии Н2O2 на нейральные растворы дихроматов:
К2Сr2О7 + 6Н2O2 = 2К[СrО(O2)2OН) + 5H2O + O2
Соли типа М+1[СrО(O2)2OН) легко взрываются. Известны также пероксопроизводные Сr (V) и Сr (IV).
Для молибдена (VI) и вольфрама (VI) известны сульфиды ЭS3, а также производные ионов [ЭS4]2-, [ЭOS3]2- [ЭO2S2]2-, [ЭO3S]2-. Они получаются при пропускании сероводорода через растворы молибдатов и вольфрвматов:
К2ЭO4 + 4Н2S = К2[ЭS4] + 4Н2O
Соединения хрома (VI) — сильные окислители, переходят в окислительно-восстановительных процессах в производные Сr (III). В нейтральной среде образуется гидроксид хрома (III):
Сr2О72- + 3(NН4)2S + H2O = 2Сr(ОН)3 +3S + 6Н3N + 2OН-
в кислой — производные катионного комплекса [Сr(ОН2)6]3+
Сr2O72- + 3SO32- + 8Н+ = 2Сг3+ + 3SO42- + 4Н2O
в щелочной производные анионного комплекса [Сr(ОН)6]3-:
2СrO42- + 3(NН4)2S + 2OН- + 2Н2O = 2[Сr(OН)6]3- + 3S + 6Н3N
Наибольшая окислительная активность оксохроматов (VI) наблюдается в кислой среде:
Сr2О72- + 14Н+ + 6е- = 2Сr3+ + 7Н2O, Еo = 1,33 В.
Окислительная способность соединений хрома (VI) используется в химическом анализе и синтезе.
Окислительные свойства производных Мо (VI) и W (VI) проявляются лишь при взаимодействии с наиболее сильными восстановителями, например с водородом в момент выделения.
Из производных хрома и его аналогов применяются главным образом соединения самого хрома. Так, Сr2O3 используется для приготовления красок и как катализатор, СrО3 — для электролитического получения хрома и хромированных изделий.

 а)
а)




