
- •По дисциплине «химия»
- •Способы выражения состава растворов
- •Основные способы выражения состава раствора
- •1. Осмотическое давление
- •2. Давление пара. I закон Рауля
- •3. Температура кипения и замерзания. II закон Рауля
- •Свойства растворов электролитов
- •1. Степень диссоциации и константа диссоциации слабых электролитов
- •2. Сильные электролиты. Активность. Ионная сила
- •Для электролита KmAn аналогичные выражения имеют вид:
- •Диссоциация воды. Буферные растворы
- •Произведение растворимости
- •Гидролиз солей
- •1. Гидролиз по аниону.
- •2.Гидролиз по катиону.
- •3. Гидролиз по катиону и аниону одновременно.
- •4. Необратимый полный гидролиз.
- •Давление насыщенного водяного пара при различных температурах
- •Криоскопические (k) и эбулиоскопические (е) константы некоторых растворителей
- •Константы диссоциации слабых электролитов при 25 с
- •Коэффициенты активности ионов
- •Произведения растворимости малорастворимых электролитов при 25 с
- •Литература
- •Содержание
- •Гидролиз солей 29
- •162600, Г. Череповец, ул. Луначарского, 5.
МИНИСТЕРСТВО
ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ЧЕРЕПОВЕЦКИЙ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Инженерно-технический
институт *************** Кафедра химии
ПРАКТИЧЕСКИЕ
ЗАНЯТИЯ
ПО ТЕМЕ «РАСТВОРЫ»
Учебно-методическое
пособие
Череповец 2001
Практические
занятия по теме «Растворы» по дисциплине
«Химия»: Учеб.-метод. пособие. – Череповец:
ЧГУ, 2001. – 39 с.
Практикум
содержит краткие теоретические сведения,
примеры решения задач и контрольные
задания по всем основным разделам темы
«Растворы» курса общей химии. Содержание
учебно-методического пособия соответствует
государственному стандарту дисциплины
«Химия» для химических и инженерно-технических
специальностей.
Рассмотрено
на заседании кафедры химии, протокол
№ 8 от 27.04.2001 г.
Одобрено
редакционно-издательской комиссией
Инженерно-технического института ЧГУ,
протокол № 9 от 10.05.2001 г.
Составители:
О.А. Калько – канд. техн. наук, доцент;
Э.В. Копылова
Рецензенты:
В.А. Котенко – канд. техн. наук, доцент
(ЧГУ);
Г.В. Козлова –
канд. хим. наук, доцент (ЧГУ)
Научный редактор:
О.А. Калько – канд. техн. наук, доцент
©
Череповецкий государственный
университет,
2001
Растворы
– это
гомогенные химические системы переменного
состава, образованные двумя или
несколькими веществами. Жидкие растворы
состоят из жидкого растворителя (обычно
Н2О)
и одного или нескольких растворенных
веществ, которые до смешения с
растворителем могли быть твердыми,
жидкими или газообразными.
Количественный
состав раствора принято выражать через
безразмерные относительные величины
(иначе доли: массовую, объемную, молярную)
или через размерные величины –
концентрации. В табл. 1 приведены формулы
для расчета наиболее часто применяемых
способов выражения состава растворов
(индекс «1» обозначает характеристику
растворителя, индекс «2» относится к
растворенному веществу, а отсутствие
индекса указывает на свойство раствора
как целого). Таблица
1
Способ выражения состава раствора
Формула
Массовая доля
растворенного вещества (процентная
концентрация по массе)
– отношение массы растворенного
вещества к массе раствора, доли
единицы или % мас.
= m2
/ m =
=
m2 / (m1
+ m2)
Молярная
(мольная) доля компонента раствора
N i
– отношение количества вещества
данного компонента к общему количеству
вещества, находящегося в растворе,
доли единицы или % мол.
N1
= n1
/ (n1
+ n2);
N2
= n2
/ (n1
+ n2);
N1
+ N2 = 1
Объемная доля
–
отношение объема компонента раствора
к объему раствора, доли единицы или
% объем.
= V2
/ V
Моляльная
концентрация (моляльность) b –
отношение количества растворенного
вещества к массе растворителя,
моль/кг
b
= n2
/ m1
=
=
m2 /(M2 m1)
Молярная
концентрация (молярность) СМ
– отношение количества растворенного
вещества к объему раствора, моль/дм3
или М
СМ
= n2 /V
=
=
m2 /(M2 V
)
Молярная
концентрация эквивалентов вещества
(нормальность) СН – отношение
количества эквивалентов растворенного
вещества к объему раствора, моль/дм3
или н.
СН
=
n2 1/ z
/ V
=
=
m2
/ ( M2 1/ z
V )
Титр раствора
Т показывает массу растворенного
вещества, содержащегося в 1 см3
раствора, г/см3
Т = m2
/V
Пример 1. Массовая
доля вещества.
Определить массовую
долю (в % мас.) хлорида калия, в 750 см3
раствора которого содержится 79,7г KCl,
плотность раствора 1,063 г/см3.
Р е ш е н и е
=
Пример 2. Упаривание
раствора. При
упаривании 50 г раствора с массовой
долей соли 1
=
0,2 масса раствора уменьшилась на m
= 10 г. Определить массовую долю соли в
растворе 2
после
упаривания.
Р е ш е н и е
1. 1
= m2 /
m, следовательно,
m2 = 1
m;
2. 2
=
Пример 3.
Разбавление раствора.
Определить объем
50%-ного раствора азотной кислоты (в см3)
плотностью 1,315 г/см3, необходимого
для приготовления 5 дм3 2%-ного
раствора, плотность которого 1,010 г/см3.
Р е ш е н и е 1.
Примем обозначения для величин, указанных
в условии задачи:
для раствора 1:
1
= 50 % = 0,5; 1
= 1,315 г/см3; V1
– ?;
для раствора 2:
2
= 2 % = 0,02; 2
= 1,010 г/см3; V2
= 5 дм3.
2. 1
= m1 /( 1
V1), следовательно,
V1 = m1
/ (1
1);
2 = m2
/( 2
V2), следовательно,
m2 = V2
2
2 .
Раствор 2 получают,
прибавляя к раствору 1 воду, поэтому m1
= m2. Тогда в
формулу для V1
следует подставить выражение для m2.
3. V1
= Общее
правило, используемое для приготовления
разбавленных растворов из концентрированных:
при
одном и том же количестве растворенного
вещества массы растворов и их массовые
доли обратно пропорциональны друг
другу:
1
m1 = 2
m2 или
Пример 4.
Концентрирование раствора. Какую
массу сухой соли (х)
нужно добавить к 50 г раствора с массовой
долей этой же соли 1
= 0,1, чтобы
получить раствор, массовая доля соли
в котором равна 2
= 0,2.
Р е ш е н и е
1. 1
= m2
/ m, следовательно,
m2 = 1
m, где m2
– масса соли в исходном растворе. Тогда
2 =
2.
Решаем полученное уравнение относительно
х:
2
m
+ 2 х
= 1
m
+ х ;
2
m
–
1
m
= х –
2
х ; (2
– 1)
m
= (1 – 2)
х ;
х =
Пример
5. Смешивание
растворов с разными концентрациями. Смешали
два раствора: массой m1
с массовой долей растворенного вещества
1
и массой
m2
с массовой долей того же вещества 2,
причем 1
> 2.
Образовался раствор, массовая доля
растворенного вещества в котором равна
3.
Выразите соотношение m1 / m2.
Р е ш е н и е 1.
Пусть 1
m1
– масса
растворенного вещества в первом
растворе; 2 m2 -
масса растворенного вещества во втором
растворе; (m1 + m2)
– масса
образовавшегося раствора; 3 (m1
+ m2)
– масса
растворенного вещества в образовавшемся
растворе. Сумма масс растворенного
вещества в первом и втором растворах
равна массе этого вещества в образовавшемся
растворе:
1
m1
+ 2
m2
= 3(m1
+ m2);
1
m1
– 3
m1
= 3
m2
- 2
m2;
(1
– 3)
m1
= (3
– 2)
m2
или m1
/ m2
= (3
– 2)
/ (1
– 3)
. 2.
Правило смешивания: массы
смешиваемых растворов m1
и m2
обратно пропорциональны разностям
массовых долей 1
и 2
смешиваемых
растворов и массовой доли смеси 3. Для
облегчения использования правила
смешивания можно применять правило
креста
(иначе
квадрат
Пирсона)
:
1
3
– 2
m1
3
2
1
– 3
m2
m1
/ m2
= (3
– 2)
/ (1
– 3)
Пояснение:
по диагонали из большей концентрации
вычитают меньшую, получают
(1
– 3),
так как 1
3,
и (3
– 2),
так как
3
2.
Затем составляют отношение масс исходных
растворов m1
/ m2.
Пример
6. Определить
массу раствора 9 %-ного столового
уксуса, который получают из 90 г 80 %-ной
уксусной кислоты.
Р е ш е н и е 80
% 9 % 90 г
9 %
0
% 71 % х
г
Масса
образовавшегося столового уксуса равна
710 + 90 = 800 г .
Пример
7. Взаимосвязь
между способами выражения состава
раствора. Вычислить
молярную концентрацию и молярную
концентрацию эквивалентов для 10 %-ного
раствора сульфата меди, плотность
которого равна 1,107 г/см3.
Р е ш е н и е
1.
=
2. Тогда формулы
для пересчета концентраций имеют вид:
СМ
=
СН
=
3.
Получим соотношение между молярными
концентрациями:
М21 / z
=
4.
Общее правило пересчета молярных
концентраций: молярная
концентрация эквивалентов вещества в
z
раз больше молярной концентрации
растворенного вещества, т. е. СН
= z СМ,
где z
– основность кислоты (кислотность
основания) или для соли – произведение
числа атомов металла на его степень
окисления.
Пример
8. Приготовление
растворов. Вычислить
объем раствора серной кислоты с массовой
долей 96 % мас. ( = 1840
г/дм3),
необходимого для приготовления раствора
объемом 2 дм3
с молярной концентрацией 0,25 моль/дм3.
Р е ш е н и е
1.
=
где
Vx
– объем
раствора серной кислоты, который нужно
разбавить водой для приготовления
нового раствора. Отсюда
Vx
=
2.
Массу H2SO4
можно получить из формулы для молярной
концентрации:
m2
= CМ
M2
V. 3.
Формула для расчета Vx
будет иметь вид
Vx = =
0,028 дм3.
З А Д А Ч И
1. Вычислить
молярную и нормальную концентрации
49 %-ного раствора ортофосфорной
кислоты ( = 1,33 г/см3).
2. Вычислить
процентное содержание серной кислоты
в ее 5 М растворе (
= = 1,29 г/см3).
3. Сколько
литров 0,1 н. раствора нитрата серебра
необходимо для реакции с 0,5 дм3
0,3 н. раствора AlCl3?
4. Определить
массовую долю (% мас.) хлорида натрия в
растворе, полученном при смешении
20 %-ного раствора хлорида натрия
массой 20 г и 30 %-ного раствора поваренной
соли объемом 100 см3 и плотностью
1,09 г/см3.
5. Сколько соли
нужно растворить в воде массой 2 кг,
чтобы получить раствор с массовой долей
0,2?
6. Определить
молярную концентрацию раствора,
полученного при разбавлении 2 М раствора
объемом 200 см3 водой объемом 300
см3?
7. Определить,
какая масса ортофосфорной кислоты
содержится в растворе объемом 0,5 дм3,
если концентрация кислоты равна 0,3 н.
8. Чему равна
нормальная концентрация 50 %-ного
раствора серной кислоты (
= 1,4 г/см3 )?
9. Сколько
граммов соли и воды содержится в 800 г
12 %-ного раствора нитрата натрия?
10. Требуется
приготовить раствор массой 500 г с
массовой долей хлорида калия 14 % мас.
Рассчитать массы требуемых хлорида
калия и воды.
11. Чему равна
молярная концентрация 20 %-ного
раствора HСl, плотность которого
составляет 1,10 г/см3?
12. Вычислить
молярность и нормальность 40 %-ного
раствора H3PO4 ( =
= 1,25 г/см3).
13. Чему равна
нормальная концентрация 18 %-ного
раствора серной кислоты (
= 1,29 г/см3)?
14. Чему равна
массовая процентная концентрация
H2SO4 в ее 10 н. растворе (
= 1,29 г/см3)?
15. На нейтрализацию
50 см3 раствора щелочи израсходовано
30 см3 0,2 н. раствора серной
кислоты. Какова нормальность раствора
щелочи? Сколько 0,1 н. раствора HСl
потребовалось бы для этой же цели?
16. Определить
молярную долю дийода в неводном растворе,
полученном смешиванием 5,02 г дийода и
100,04 г этанола.
17. Рассчитать
моляльность неводного раствора хлорида
ртути (II), полученного смешиванием 9,98
г растворенного вещества и 120 см3
этанола плотностью 785 г/дм3.
18. Определить
массу растворенного вещества (в г),
содержащегося в 200 см3 0,075 н.
раствора сульфата рубидия. 19.
Следующая реакция проводится смешиванием
водных растворов реагентов:
ZnCl2
+ 4NaOH = Na2[Zn(OH)4]
+ 2NaCl. Определить
эквивалентную концентрацию первого
реагента в 200 см3
исходного раствора, если в нем содержалось
1,83 г этого вещества.
20. В 800 г воды
растворили оксид серы (IV)
объемом 7,84 л (н.у.). Вычислить массовую
долю оксида в полученном растворе.
21. Найти
массовое процентное содержание AgNO3
в растворе, если эквивалентная
концентрация его равна 0,64 моль/дм3
( = 1088 г/ дм3).
22. Найти
массовую процентную концентрацию
KМnO4, если нормальная концентрация
соли составляет 0,4 н. (
= 1,04 г/см3).
23. Определить
объем раствора серной кислоты с массовой
долей 0,093 и плотностью раствора 1,05
г/см3, который потребуется для
приготовления 0,35 М раствора серной
кислоты объемом 40 см3.
24. К 2 М раствору
KCl объемом 40 см3 (
= 1,09 г/см3) добавили 200 г воды.
Определить молярную концентрацию
полученного раствора и массовую долю
хлорида калия в нем. Плотность полученного
раствора равна 1,015 г/см3.
25. Рассчитать
титр 0,04 н. раствора хлорида натрия.
СВОЙСТВА
РАЗБАВЛЕННЫХ РАСТВОРОВ НЕЭЛЕКТРОЛИТОВ
Осмосом
называют явление односторонней
диффузии молекул растворителя через
полупроницаемую перегородку, разделяющую
растворы с различным содержанием
растворенного вещества. Давление,
которое нужно приложить к раствору,
чтобы остановить одностороннюю диффузию
растворителя, называют осмотическим.
Связь между
осмотическим давлением и составом
разбавленных растворов неэлектролитов,
Па или кПа, описывается законом
Вант-Гоффа:
росм
=
где С
– концентрация, моль/м3;
СМ
– концентрация,
моль/дм3;
R – универсальная
газовая постоянная, Дж/(мольК);
T
– абсолютная
температура, К. Уравнение
позволяет вычислить для разбавленных
растворов неэлектролитов: молекулярную
массу растворенного вещества; концентрацию
раствора;
3)
осмотическое давление раствора. Растворы,
обладающие одинаковым осмотическим
давлением, называются изотоническими.
Пример
1. В
250 см3
раствора содержится 17 мг растворенного
вещества. Осмотическое давление раствора
при 27 С
равно 1,84 кПа. Вычислить молярную массу
растворенного вещества.
Р е ш е н и е
По
закону Вант-Гоффа росм V
= n2 R T
=
М2 =
Пример 2. Вычислить
осмотическое давление раствора при 22
С, в 1,2 дм3
которого содержится 0,021 г сахара
С12Н22О11.
Р е ш е н и е 1.
Молярная концентрация раствора составит
СМ =
=
2. росм
= СМ R T
= 510-5
моль/дм3 8,314
Дж / (моль К) 295
К = 0,13 кПа.
Пример 3. Определить
массу глюкозы С6Н12О6 ,
которую должен содержать 1 дм3
раствора, чтобы быть изотоничным
раствору, содержащему в 1 дм3 9,2 г
глицерина С3Н8О3.
Р е ш е н и е 1.
Определим молярную концентрацию
глицерина
СМ(С3Н8О3)
=
=
2.
При одинаковой температуре изотоническими
будут растворы с одинаковой молярной
концентрацией неэлектролита.
Следовательно, масса глюкозы будет
равна
m(С6Н12О6)
= СМ(С3Н8О3)
M(С6Н12О6)
V,
m(С6Н12О6)
= 0,1 моль/дм3
180 г/моль
1 дм3 = 18 г.
Пар над жидкостью
в состоянии равновесия называется
насыщенным. Давление насыщенного
пара – характерная величина для данного
вещества и зависит от температуры. При
постоянной температуре давление пара
раствора р всегда ниже давления
пара чистого растворителя р
Так как в разбавленных
растворах n2 n1,
то при расчете мольной доли допустимо
считать, что N2
= n2 /n1
, тогда закон Рауля примет вид
Значения
давления насыщенного водяного пара
при различных температурах приведены
в табл. 1 приложения.
Пример 1. Вычислить
давление пара воды над раствором,
содержащим 45 г глюкозы С6Н12О6
в 720 г воды при 25 С.
Р е ш е н и е
Давление пара
воды при 25 С
составляет р
= 3168 Па (см. табл. 1 приложения). По I
закону Рауля
р = р
– р
р = 3168 – 3168
Пример 2. Вычислить
молярную массу неэлектролита, если
28,5 г этого вещества, растворенного в
785 г воды, вызывают понижение давления
пара воды над раствором на 52,37 Па при
40 С.
Р е ш е н и е Давление
пара воды при 40 С
составляет 7375,9 Па (см. табл. 1). По I
закону Рауля
отсюда М2
= 92,04 г/моль.
Согласно II
закону Рауля, повышение температуры
кипения Tкип
и понижение температуры замерзания
Tзам
раствора по сравнению с чистым
растворителем прямо пропорционально
моляльной концентрации растворенного
вещества – неэлектролита:
Tкип
= Tкип – Т где
Ткип , Т
– температура кипения раствора и
чистого растворителя, К; Тзам,
Т
– температура замерзания раствора
и чистого растворителя, К; b ‑ моляльность
раствора, моль/кг; E,
K – эбулиоскопическая
и криоскопическая константы, кгК/моль.
Таким образом,
раствор кипит при более высокой
температуре, чем чистый растворитель,
а замерзает при более низкой температуре. Значения
E
и K
некоторых растворителей приведены в
табл. 2.
Молярную массу
растворенного вещества по повышению
температуры кипения или понижению
температуры замерзания раствора
вычисляют по формулам:
M2
= E
Пример.
Определить температуру кипения и
температуру замерзания раствора,
содержащего 1 г нитробензола С6Н5NO2
в 10 г бензола. Температура кипения
чистого бензола 80,2 С,
температура замерзания чистого бензола
5,4 С.
Р е ш е н и е
1. Используя табл.
2, определим эбулиоскопическую и
криоскопическую константы бензола: Е
= 2,57 кгК/моль;
K = 5,1 кгК/моль. 2.
По II
закону Рауля повышение температуры
кипения раствора нитробензола в бензоле
определяется по формуле
Tкип = E
3. Температура
кипения раствора равна
Ткип=
Tкип
+ Т
= 2,09 + 80,2 = 82,29 С. 4.
По закону Рауля понижение температуры
замерзания раствора нитробензола в
бензоле составит
Tзам
= K
=
5,1 кгК/моль
5. Температура
замерзания раствора равна
Тзам=
Т
– Tзам
= 5,4 – 4,14 = 1,26 С.
З А Д А Ч И
1. При какой
температуре осмотическое давление
раствора, содержащего 45 г глюкозы в 1
дм3, достигнет 607,8 кПа?
2. Раствор, 1
см3 которого содержит 0,0405 г
некоторого растворенного вещества,
изотоничен с 0,225 М раствором сахара.
Вычислить молекулярную массу растворенного
вещества.
3. Вычислить
давление пара раствора, в 450 г которого
содержится 90 г глюкозы при 25 С.
4. При 0 С
давление пара эфира (С2Н5)2О
составляет 2465 Па. Найти для этой
температуры давление пара 5 %-ного
раствора анилина С6Н5NH2
в эфире.
5. Сколько
граммов сахара содержится в 250 см3
раствора, осмотическое давление которого
при 7 С составляет
283,6 кПа? Вычислить молярность раствора.
В каком объеме (см3) раствора
содержится 1 моль сахара?
6. Вычислить
давление пара 10 %-ного раствора сахара
при 100 С.
7. Сколько
граммов глюкозы С6Н12О6
следует растворить в 260 г воды для
получения раствора, температура кипения
которого превышает температуру кипения
чистого растворителя на 0,05?
8. Температура
кипения ацетона равна 56,1 С
(E = 1,73). Вычислить
температуру кипения 8 %-ного раствора
глицерина С3Н6О3 в
ацетоне.
9. Вычислить
осмотическое давление 25 %-ного
раствора сахара при 15 С
( = 1,105 г/см3).
10. Сколько
граммов сахара С12Н22О11
следует растворить в 720 г воды для
получения раствора, давление пара
которого на 18,66 Па ниже давления пара
Н2О при 20 С?
11. Вычислить,
на сколько градусов понизится
температура замерзания бензола С6Н6,
если в 50 г его растворить 1,5 г нафталина
С10Н8.
12. Осмотическое
давление раствора при –3 С
составляет 2735 кПа. При какой температуре
осмотическое давление достигнет
3040 кПа?
13. При растворении
0,4 г некоторого вещества в 10 г воды
температура кристаллизации раствора
понижается на 1,24.
Вычислить молекулярную массу растворенного
вещества.
14. Вычислить
давление пара раствора, в 468 г которого
содержится 18 г глюкозы С6Н12О6
при 25 С.
15. Вычислить
осмотическое давление 4 %-ного раствора
сахара при 20 С,
если плотность раствора равна 1,014
г/см3.
16. Вычислить
давление пара раствора при 65 С,
содержащего 13,68 г сахара в 90 г Н2О,
если давление водяного пара при той же
температуре равно 24 994 Па.
17. На сколько
градусов понизится давление пара при
температуре 28 С,
если в 340 г воды растворить 54 г глюкозы.
18. Вычислить,
при какой температуре осмотическое
давление раствора, содержащего 45 г
глюкозы в 1 дм3, достигнет 656,8
кПа.
19. Раствор
сахара в воде показывает повышение
температуры кипения на 0,312.
Вычислить величину понижения температуры
замерзания этого раствора.
20. Осмотическое
давление раствора, в 0,25 дм3
которого содержится 0,66 г мочевины,
равно 111439 Па при 33 С.
Вычислить молекулярную массу мочевины.
21. Найти
молекулярную массу неэлектролита, если
при растворении 12 г его в 292 г Н2О
при 10 С понижение
давления пара раствора составило
28,4 Па.
22. Температура
замерзания бензола С6Н6
равна 5,5 С. Раствор,
содержащий 6,15 г нитробензола в 400 г
бензола, замерзает при 4,86 С.
Вычислить молекулярную массу нитробензола.
23. Сколько
молекул растворенного вещества
содержится в 1 см3 раствора,
осмотическое давление которого при 54
С составляет 6 065
Па?
24. Давление
пара раствора, содержащего в 270 г воды
12 г неэлектролита при 70 С,
равно 30 749,6 Па. Вычислить
молекулярную массу растворенного
вещества.
25. Определить
молекулярную массу эфира, если при 30
С давление пара
раствора, содержащего 3,08 г анилина в
370 г эфира, равно 85 792 Па, а давление
пара растворителя при той же температуре
составляет 86 365 Па.
Электролитами
называют вещества, которые полностью
или частично распадаются в растворе
или расплаве на ионы.
Распад молекулы
на ионы под действием воды или другого
растворителя называется электролитической
диссоциацией. Процесс образования
ионов при взаимодействии с растворителем
полярной молекулы называется
ионизацией.
Сила электролита
определяется степенью диссоциации
, которая
определяется как отношение числа
молекул, распавшихся на ионы N,
к общему числу растворенных молекул
Nобщ, доли
единицы или %:
=
Электролиты делят
на сильные (
> 30 %) и слабые (
< 30 %). К сильным электролитам
в водных растворах принадлежат
практически все соли, многие неорганические
кислоты (HCl, HBr,
HI, HClO4,
H2SO4,
…), а также гидроксиды щелочных и
щелочноземельных металлов. Для сильных
электролитов степень диссоциации равна
единице (или 100 %).
Слабые электролиты
при растворении в воде распадаются на
ионы частично, так как процесс диссоциации
является обратимым и характеризуется
константой равновесия. Для электролита,
дающего при диссоциации одной молекулы
два иона по уравнению KА
K+
+ Аˉ , константа химического равновесия
равна
K
=
где
K+,
Аˉ
,
KА
– равновесные концентрации соответственно
катиона, аниона и недиссоциированных
молекул, моль/дм3.
Константа равновесия в этом случае
называется константой
диссоциации Kдис .
Kдис
характеризует способность электролита
распадаться на ионы. Она не зависит от
концентраций электролита и ионов, а
зависит от природы электролита и
температуры.
Между Kдис
и степенью диссоциации
существует количественная зависимость
(закон разбавления Оствальда):
Kдис
=
где
СМ – исходная молярная
концентрация, моль/дм3.
Для растворов
очень слабых электролитов
<< 1 и (1 – )
1, формула упрощается:
Kдис
= 2 СМ
. Отсюда
=
Из закона разбавления
следует, что при понижении концентрации
раствора степень диссоциации слабого
электролита увеличивается. Если
обозначить концентрацию иона [ион], то
получим
[ион] = CМ ,
следовательно,
[ион] =
Для
слабых электролитов, при диссоциации
одной молекулы которых образуется
более двух ионов, данный процесс
протекает ступенчато. Например, для
ортофосфорной кислоты:
Н3РО4
Н+ + Н2РО
Н2РО
Н+ + НРО
НРО
Н+ + РО Константа
диссоциации суммарного процесса равна
произведению констант диссоциации по
всем ступеням:
Н3РО4
3Н+ + РО
,
Kдис =
Kдис 1
Kдис 2
Kдис 3 = 2,2
10-22. Значения
констант диссоциации некоторых слабых
электролитов приведены в табл. 3
приложения.
Пример 1. Вычислить
степень диссоциации в 0,2 М растворе
муравьиной кислоты, если Kдис=
2,110-4.
Р е ш е н и е
По
закону разбавления Оствальда
=
=
Пример 2. Какова
концентрация водородных ионов в 0,1 М
растворе германиевой кислоты Н2GeO3,
если константа диссоциации кислоты по
первой ступени равна 2,6
10-9?
Р е ш е н и е
[Н+]
=
=
Пример 3. Вычислить
концентрацию ионов ОН ˉ в растворе,
содержащем смесь NH4OH
(СМ, 1 = 0,2 M) и
NH4Сl
(СМ, 2 = 1 M),
если Kдис NH4OH
равна 1,810-4.
Р е ш е н и е
Концентрация
ионов ОН ˉ определяется уравнением
диссоциации
NH4OH
NH4+
+ OH ˉ
.
Из выражения для
константы диссоциации Kдис
=
NH4+
= СМ, 2 = 1 моль/л, так как
NH4Сl
– сильный электролит и практически
полностью диссоциирует на ионы, а
концентрацией
ОН –
=
В растворах сильных
электролитов в результате их практически
полной диссоциации создается высокая
концентрация ионов, которая
определяется по формуле
[ион] = n СМ ,
где
n – число ионов данного
вида, образующихся при диссоциации
одной молекулы электролита.
Для учета
взаимодействия между ионами в растворе
сильного электролита введено понятие
«активность». Активность – это
эффективная концентрация иона, в
соответствии с которой ион проявляет
себя в химических реакциях. Концентрация
и активность иона а связаны
соотношением
а = [ион]
f, где
f – коэффициент
активности.
В сильно разбавленных
растворах сильных электролитов f
= 1, а = [ион].
Константа
диссоциации сильного электролита,
диссоциирующего по уравнению KА
K+
+ Аˉ ,
записывается
так:
Kдис
=
где
Активность
электролита KA (катион
и анион однозарядные) связана с
активностями ионов соотношением
а2 =
Для электролита
KA средняя ионная
активность а
и средний ионный коэффициент
активности f
связаны с активностями и коэффициентами
активности катионов и анионов
соотношениями:
а
=
а
=
В разбавленных
растворах электролитов средний ионный
коэффициент активности можно вычислить
по уравнению (предельный закон
Дебая-Гюккеля):
lg
f
= – 0,5
z+
где
z+ ,
Ионной силой
раствора I называют
полусумму произведения концентраций
каждого иона на квадрат его заряда:
Значения
коэффициентов активности ионов в
зависимости от ионной силы раствора
приведены в табл. 4 приложения.
Наличие взаимодействия
между ионами в растворах сильных
электролитов приводит к тому, что
найденная экспериментально степень
диссоциации сильного электролита
оказывается меньше 1. Ее называют
кажущейся степенью диссоциации и
рассчитывают по формуле
=
где
n – число ионов,
образующихся при диссоциации одной
молекулы электролита; i
– изотонический коэффициент
Вант-Гоффа.
Изотонический
коэффициент i
показывает, во сколько раз
экспериментально найденное свойство
раствора электролита отличается от
такого же свойства, вычисленного для
раствора неэлектролита при той же
концентрации:
i
=
где
свойством раствора может быть росм,
р, Ткип
или Тзам.
Следовательно, раствор электролита
будет изотоничен раствору неэлектролита
той же концентрации, если вычисленное
значение свойства раствора неэлектролита
умножить на изотонический коэффициент:
р
Пример
1. Рассчитать
концентрации ионов в 0,01 М растворе
K2SO4.
Р е ш е н и е
K2SO4
диссоциирует по уравнению
K2SO4 2K+
+ SO
K+
= 2 СМ = 2
0,01 = 0,02 моль/дм3;
SO
Пример 2. Вычислить
активность NaI в 0,05 молярном
растворе, если известно, что средний
ионный коэффициент активности равен
0,84.
Р е ш е н и е а2
= а+
а–
= СМ2
f2
= 0,052
0,842
= 1,76
10-3.
Пример 3. Каковы
активные концентрации ионов Sr2+
и
Р е ш е н и е Sr(NO3)2
диссоциирует
по уравнению Sr(NO3)2 Sr2+ + 2
.
Так как
СМ = 0,06
моль/дм3,
то
равновесные концентрации ионов равны:
Sr2+
= СМ = 0,06 моль/дм3;
= 2СМ = 2
0,06 моль/дм3.
Находим ионную
силу раствора:
I = 1/2
([Sr2+]
z
По значению ионной
силы раствора вычисляем коэффициенты
активности ионов:
lg
f+
= - 0,5z
следовательно,
f+ = 0,14.
lg f
–
= -0,5z
=
-0,512
следовательно,
f –
= 0,61.
Вычисляем активные
концентрации ионов:
a+
= [Sr2+ ]
f+
= 0,06
0,14 = 0,0084 моль/дм3;
a –
= [NO3-
]
f –
= 2
0,06
0,61 = 0,0734 моль/дм3.
Пример 4. Водный
раствор соляной кислоты (b
= 0,5 моль/кг) замерзает при –1,83 С.
Вычислить кажущуюся степень диссоциации
кислоты.
Р е ш е н и е
Вычислим Tзам
неэлектролита той же концентрации:
T
Используя табл.
2 приложения, определим криоскопическую
константу воды: K(Н2О)
= 1,86.
T
=
K
b = 1,86
0,5 = 0,93 С .
Следовательно,
i =
Отсюда
=
=
З А Д А Ч И
1. Вычислить
константу ионизации СН3СООН,
если степень ее ионизации в 0,05 н.
растворе равна 1,9 %.
2. Вычислить
активность LaCl3 в 0,018 молярном
растворе, если f
= 0,57.
3. Вычислить
концентрацию ионов водорода и степень
диссоциации 0,5 н. раствора уксусной
кислоты (Кдис = 1,810-5).
4. Вычислить
ионную силу раствора, содержащего 0,03
моль/дм3 MgCl2 и 0,02 моль/дм3
K2SO4.
5. Вычислить
концентрацию ионов ОН– и степень
диссоциации 1 н. раствора NH4OH
(Кдис = 1,810-5).
6. Электролит
АВ в 0,1 М растворе имеет степень
диссоциации, равную 85 %. Вычислить
молярную концентрацию ионов А+
и В– в растворе.
7. Определить
кажущуюся степень диссоциации 0,01 М
раствора NaBr , если i = 1,32 .
8. В 0,1 М растворах
степень диссоциации щавелевой кислоты
Н2С2О4 равна 31 %, а
соляной – 92 %. При какой концентрации
раствора степень диссоциации щавелевой
кислоты достигнет значения НСl?
9. Вычислить
степень диссоциации и концентрацию
ионов водорода в 0,1 М растворе H2S,
Кдис которой по I ступени
составляет 910-8.
10. Вычислить
активность Sr(NO3)2
в растворе, содержащем 3,17 г соли в 500 г
воды, а f
= 0,59.
11. Вычислить
степень диссоциации и концентрацию
ионов водорода
в 1%-ном растворе
уксусной кислоты, плотность которого
равна 1 г/см3, а Кдис =
1,810-5.
12. 1 дм3
раствора содержит по 0,01 моль AlCl3
и MgSO4. Вычислить
ионную силу раствора.
13. Вычислить
степень диссоциации и концентрацию
ионов водорода в 10 %-ном растворе
уксусной кислоты, плотность которого
равна 1,01 г/см3, а Кдис
= 1,810-5.
14. Вычислить
ионную силу раствора, содержащего 0,085
г NaNO3 и 7,98 г CuSO4 в 200 г
воды.
15. В воде
растворили 0,35 моль электролита АВ.
В растворе образовалось 0,014 моль катионов
А+. Вычислить степень диссоциации
электролита АВ в данном растворе.
16. Степень
диссоциации электролита АВ2
в 0,1 М растворе равна 60 %. Рассчитать
молярную концентрацию ионов А2+
и В – в этом растворе.
17. Кдис(HNO2)
= 510-4. Вычислить
степень ее диссоциации в 0,05 М
растворе.
18. Из каждых
500 молекул электролита 8 распадаются
на ионы. Чему равна степень диссоциации
этого электролита? К электролитам
какого типа его можно отнести?
19. Вычислить
ионную силу 1 %-ного раствора Na2SO4.
20. Кдис(HF)
= 7,410-4. Вычислить
степень диссоциации HF
в 0,3 М растворе.
21. Вычислить
ионную силу раствора, содержащего 0,373
г KCl и 2,116 г Sr(NO3)2 в 250 г Н2О.
22. Вычислить
активность KI в растворе, содержащем
0,664 г иодида калия в 200 г Н2О, если
f = 0,84.
23. Вычислить
ионную силу раствора, содержащего 0,373
г NaСl и 2,116 г Ca(NO3)2
в 250 г Н2О.
24. Вычислить
Кдис(H2CO3) по первой
ступени, если степень диссоциации H2CO3
в 0,1 М растворе составляет 0,173 %.
25. Вычислить
степень диссоциации и концентрацию
ионов водорода
в 1 %-ном растворе
гидроксида аммония, плотность которого
равна 1 г/см3, а Кдис
= 1,810-5.
Вода
является слабым электролитом и в малой
степени диссоциирует по уравнению
Н2О
Н+ + ОН – . Константа
диссоциации воды мала и равна 1,8 10-16
при 22 С. Таким
образом, из 108 молекул воды
распадается на ионы только одна. Поэтому
концентрацию недиссоциированных
молекул можно принять равной общей
концентрации воды и как постоянную
величину объединить с константой
равновесия:
1,810-16 То
есть в воде и разбавленных водных
растворах произведение концентрации
ионов водорода на концентрацию
гидроксид-анионов есть величина
постоянная, равная 10-14 при 22 С.
Ее называют ионным произведением
воды (KВ ).
По уравнению
диссоциации в воде концентрации ионов
равны
[Н+ ] = [ОН –
] =
Степень кислотности
или щелочности раствора можно выразить
концентрацией ионов [Н+] или
[ОН –]. Обычно пользуются
концентрацией катионов водорода,
которая имеет следующие значения для
растворов:
кислого [Н+
] > 10-7; нейтрального
[Н+ ] =
10-7; щелочного [Н+ ] <
10-7.
Концентрации
катионов водорода и гидроксид-анионов
принято выражать в логарифмических
единицах, в виде так называемых
водородного показателя рН и
гидроксильного показателя рОН:
рН = -lg
[Н+] и рОН = -lg
[ОН –]. Тогда рН
различных растворов будут иметь
следующие значения:
кислого раствора
рН < 7; щелочного – рН > 7;
нейтрального – рН = 7
Концентрации
ионов Н+ и ОН– , а также
водородный и гидроксильный показатели
связаны между собой соотношениями:
[Н+] =
В
растворах сильных электролитов
активности ионов меньше их истинных
концентраций, поэтому для определения
рН и рОН растворов сильных кислот или
сильных оснований необходимо использовать
уравнения:
a (Н+)
= [Н+]
f+
;
a (OН–)
= [OН–]
f–
. Растворы,
способные сохранять практически
постоянным значение рН при разбавлении
или добавлении небольших количеств
сильной кислоты или сильного основания,
называются
буферными. Буферные
смеси состоят из слабой кислоты и ее
соли или слабого основания и его соли.
Например, (СН3СООН
+ СН3СООNa)
– ацетатная
буферная смесь или (NH4OH
+ NH4Cl)
– аммонийная буферная смесь. Концентрация
ионов водорода в буферной смеси слабой
кислоты и ее соли равна, моль/дм3:
[Н+]
=
Откуда
рН = -
lg Kк-ты
– lg[кислоты]
+ lg[соли]
= р Kк-ты
– lg По
аналогии для буферной смеси слабого
основания и его соли
рН
= 14
– р Kосн
+ lg
где
рKосн
= -lg Kосн. Пример
1. Рассчитать
[ОН–],
если [Н+]
= 10-2
моль/дм3.
Р е ш е н и е
[ОН-]
=
Пример
2. Вычислить
[ОН–]
в растворе, рН которого 2,7.
Р е ш е н и е рН
= -lg
[Н+]
= 2,7 , отсюда
[Н+]
= 210-3
моль/дм3.
Тогда
[ОН– ]
= KB
/
[Н+] =
= 10-14/(2
10-3)
= 5 10-12. Решим
задачу другим способом: рОН
= 14 –
рН
= 14 – 2,7 =
11,3; lg[ОН–]
= –11,3. Тогда
[ОН–]
= 5 10-12.
Пример
3. Рассчитать
рН 0,02 М раствора HCl
.
Р е ш е н и е Соляная
кислота является сильным электролитом,
тогда расчет будем вести через активность.
Определим ионную силу раствора:
I
= 1/2 (0,0212
+ 0,0212)
= 0,02. Коэффициент
активности при этой ионной силе f
= 0,91 (см.
табл. 4).
Тогда
а(Н+)
= 0,02
0,91 = 0,0182. Отсюда
рН = – lg
а(Н+)
= –lg
0,0182 = 1,74.
Пример
4. Вычислить
рН буферного раствора, содержащего
0,02 М раствор СН3СООН
и 0,01 М раствор СН3СООNa
в 1 дм3.
Константа диссоциации уксусной кислоты
равна 1,8
10-5.
Р е ш е н и е рН
= рKк-ты
– lg =
- lg
(1,810-5)
– 0,3 = 4,44.
З А Д А Ч И
1. Вычислить
концентрацию Н+, если [OH–]
= 410-10 моль/дм3.
2. Концентрация
гидроксид-ионов в растворе составляет
10-5 моль/дм3. Определить
концентрацию ионов Н+ и рН раствора.
3. Вычислить
[H+], если [ОH–] равна 1,610-13
моль/л.
4. Определить
рН раствора, в 1 дм3 которого
содержится 2 г гидроксида натрия. Щелочь
в растворе диссоциирует полностью.
5. Вычислить
[OH–], если [H+] составляет
10-8 моль/дм3.
6. Вычислить
рН 0,1 н. раствора HCl (
= 90 %).
7. Вычислить
[OH–], если [H+] равна 210-4
моль/дм3.
8. Вычислить
рН и рОН 0,001 М раствора НСl.
9. Концентрация
ионов водорода в растворе равна 10-4
моль/дм3. Определить концентрацию
ионов ОН– в растворе.
10. Вычислить
концентрацию гидроксид-ионов в растворе,
рН которого равен 11.
11. Вычислить
[OH –], если [H+] равна
0,410-11 моль/дм3.
12. Концентрация
ионов водорода в растворе равна 10-5
моль/дм3. Определить концентрацию
гидроксид-ионов в растворе.
13. Вычислить
рН в 0,006 М растворе H2SO4
при 25 С.
14. Рассчитать
молярность раствора сильной кислоты
Н2А, если рОН равен 11,62.
15. Вычислить
рН раствора, в котором [OH–] =
910-9 моль/дм3.
16. Вычислить
[OH–], если [H+] = 810-7
моль/дм3. 17.
Определить рН в 0,012 М растворе гидроксида
бария при 25 С.
18. Вычислить
рН раствора, в котором [OH–] =
8,710-8 моль/дм3.
19. Определить
рН 0,023 М раствора сильной кислоты НА.
20. Определить
значение рОН 0,037 М раствора сильной
кислоты Н2А.
21. Определить
рН 0,0074 М раствора щелочи МеОН.
22. Вычислить
[OH–] в растворе, рН которого
равен 5,1.
23. Определить
рН 0,0029 М раствора сильного основания
Ме(ОН)2.
24. Рассчитать
молярность раствора щелочи МеОН,
если значение рН равно 11,87.
25. Рассчитать
молярность раствора сильной кислоты
Н2А, если рН = 1,64.
Гетерогенное
равновесие "осадок
насыщенный раствор" подчиняется
правилу произведения растворимости:
в насыщенном растворе труднорастворимого
электролита произведение концентраций
(активностей) ионов, возведенных в
степень стехиометрических коэффициентов,
есть величина постоянная при данной
температуре. Если
малорастворимый электролит диссоциирует
по уравнению
Kn
Am
n K m+
+ m An -,
осадок
насыщенный раствор
тогда
выражение для произведения растворимости
(ПР) имеет вид
ПР(Kn
Am)
= а ПР
разбавленных растворов может быть
выражено через равновесные концентрации
ионов
ПР(Kn
Am)
= [Km+]n
[An
-]m
. Значения
произведения растворимости некоторых
солей приведены в табл. 5 приложения. Если
произведение концентраций ионов в
растворе больше, чем табличное значение
ПРсоли,
то в растворе будет присутствовать
осадок данного вещества. И наоборот,
если произведение концентраций ионов
в растворе оказалось меньше табличного,
то осадок данного вещества растворится. ПРсоли
характеризует растворимость
твердого
электролита при данной температуре:
из двух
однотипных соединений большей
растворимостью обладает то, ПР
которого больше.
Равновесные
молярные концентрации ионов Km+
и An-
пропорциональны растворимости L
(моль/дм3)
вещества Kn Am:
[Km+]
= n L
и
[An-]
= m L
. Отсюда
ПР(Kn
Am)
= (n
L)n
(
m
L)m
и L
=
Пример
1. Определить
ПР фторида магния, если его растворимость
в воде равна 0,001 моль/дм3.
Р е ш е н и е
MgF2(тв)
Mg2+
+ 2F –
ПР(MgF2)
= [Mg2+]
[ F –]2
= L
(2L)2
= 4
L3
= 4
(0,001)3
= 4
10-9.
Пример
2. Рассчитать
равновесную молярную концентрацию
(моль/дм3)
анионов в насыщенном растворе карбоната
серебра (I)
при 25 С,
если ПР = 8,710-12.
Р е ш е н и е
Ag2CO3(тв)
2Ag+
+ CO32-;
ПР(Ag2CO3)
= [Ag+]2
[CO32-
]
= (2
[CO32-
])2
[CO32-
]
= 4
[CO32-
]3;
[CO32-
] =
Пример
3. Определить
рН насыщенного раствора гидроксида
кальция при 25 С,
если ПР = 6,310-6.
Решение
Са(ОН)2(тв)
Са2+
+ 2ОН–
;
рН
= [Са2+]
[ОН–]2
= 1/2[ОН–]
[ОН–]2
= 1/2[ОН–]3;
рН
= 14 – рОН = 14 + lg[ОН–]
= 14 + lg
Пример 4. Выпадет
ли осадок иодида свинца (II)
при 25 С после
сливания 100 см3 0,005 М раствора
нитрата свинца (II) и 200
см3 0,01 М раствора иодида калия,
если ПР (PbI2) =
8,710-9?
Решение
Pb(NO3)2
+ 2KI =
PbI2(тв)
+ 2KNO3; Pb2+
+ 2I–
= PbI2(тв)
;
[Pb2+]
=
где
с1 и с2
– концентрации ионов в растворах до
смешивания; V1
и V2 –
объемы исходных растворов в порядке
их перечисления в условии задачи;
(V1 + V2)
– объем конечного раствора.
При смешивании
равных объемов начальных растворов
концентрации ионов в конечном растворе
уменьшаются в 2 раза по сравнению с с1
и с2.
[Pb2+][I–]2
=
PbI2
осаждается, так как соблюдается
условие выпадения осадка:
7,410-8
> 8,710-9.
З А Д А Ч И
1. Растворимость
AgI равна 1,210-8
моль/дм3. Вычислить ПР(AgI).
2. В 2 дм3
воды при 25 С
растворяется 2,210-4
г бромида серебра. Вычислить ПР(AgBr).
3. Произведение
растворимости PbCl2
равно 1,710-5.
Чему равна концентрация ионов свинца
в насыщенном растворе PbCl2?
4. Произведение
растворимости CaSO4
равно 610-5.
Выпадает ли осадок CaSO4,
если смешать равные объемы 0,2 н. растворов
CaCl2 и Na2CO3?
5. ПР (PbI2)
= 8,710-5.
Выпадет ли осадок, если смешать равные
объемы растворов, содержащих 3 г/дм3
Pb(NO3)2
и 1 г/дм3 KI?
6. Произведение
растворимости AgCl равно
1,610-10. Вычислить
концентрацию насыщенного раствора
AgCl (в моль/дм3 и в
г/дм3).
7. Сколько воды
потребуется для растворения 1 г СаС2О4
при комнатной температуре, если
ПР(СаС2О4) = 2,610-9?
8. Сколько
граммов СаСО3 может раствориться
в 1 дм3 воды при 18 С,
если ПР(СаСО3) = 4,810-9
при той же температуре?
9. Вычислить
концентрацию ионов Ag+
в насыщенном растворе AgBr,
содержащем NaBr концентрации
0,01 моль/дм3.
10. Рассчитать
значение ПР, если растворимость вещества
Ме2А в воде при некоторой
температуре равна 1,210-3
моль/дм3.
11. Рассчитать
значение ПР гидроксида металла Ме(ОН)2,
если рН его насыщенного раствора равен
9,54 при 25 С.
12. Рассчитать
ПР(PbSO4), если массовая
доля PbSO4 в насыщенном
растворе при некоторой температуре
равна 0,057 % (плотность раствора принять
равной 1 г/см3).
13. Определить,
выпадет ли осадок после сливания равных
объемов 0,0023 М растворов AgNO3
и KBr при 25 С.
14. Определить,
выпадет ли осадок после сливания 5 см3
0,004 М раствора CdCl2
и 15 см3 0,003 М раствора NaOH
при 25 С.
15. ПР(Са3(РО4)2)
= 110-25 при 25
С. Рассчитать
концентрацию ионов Са2+ и РО43-
в насыщенном растворе при этой же
температуре.
16. Насыщенный
при комнатной температуре раствор
PbSO4 объемом 3 дм3
содержит 0,132 г соли. Вычислить ПР(PbSO4).
17. При 18 С
ПР(PbF2) составляет
3,210-8. Какое
количество свинца содержится в 0,4 дм3
насыщенного раствора?
18. Насыщенный
раствор AgIO3 объемом
3 дм3 содержит в виде ионов 0,176 г
серебра. Вычислить ПР(AgIO3).
19. Раствор
содержит ионы Ва2+ и Sr2+,
концентрации которых соответственно
равны 510-4 и
510-1 моль/дм3.
Какой из осадков будет первым выпадать
в растворе при постепенном прибавлении
раствора K2CrO4?
ПР(SrCrO4) = = 3,610-5.
20. ПР(Ag3PO4)
составляет 1,810-18.
В каком объеме насыщенного раствора
содержится 0,05 г растворенной соли?
21. Выпадет ли
осадок сульфата кальция, если к 0,1 дм3
0,01 М раствора Ca(NO3)2
прибавить 0,4 дм3 0,001 н. раствора
H2SO4?
Степень диссоциации Ca(NO3)2
и H2SO4
равна 95 %; ПР(CaSO4) =
6,110-5.
22. Рассчитать
ПР(Ni(NO3)2),
если массовая доля Ni(NO3)2
в насыщенном растворе при некоторой
температуре равна 0,205 % (плотность
раствора принять равной 1 г/см3).
23. Рассчитать,
какой объем воды (в дм3) потребуется
для растворения 0,0158 г
SrCO3 при 25 С,
если ПР(SrCO3) =
5,310-10 (объем
воды принять равным объему раствора).
24. Рассчитать
равновесную молярную концентрацию
(моль/дм3) катионов в насыщенном
растворе солей AgMoO4
(ПР = 2,810-12) и
TlC2O4
(ПР = 2,010-4)
при 25 С.
25. Рассчитать
равновесную молярную концентрацию
анионов в насыщенном растворе солей
BaF2 (ПР = 1,710-6)
и Ca(IO3)2
(ПР = 1,910-6) при
25 С.
Гидролизом соли
называется взаимодействие
ионов соли с молекулами воды,
сопровождающееся изменением рН раствора.
Гидролиз
протекает только тогда, когда при
взаимодействии ионов и воды образуются
малодиссоциированные вещества (слабые
кислоты или основания, а также комплексные
ионы). Соли, образованные сильным
основанием и сильной кислотой, гидролизу
не подвергаются.
Возможны следующие
случаи гидролиза солей.
Соли сильного
основания и слабой кислоты гидролизуются
с увеличением концентрации гидроксид-ионов
в растворе, т. е. реакция среды щелочная
(рН > 7), например:
СН3СООNa
СН3СОО – + Na+;
Na+
+ HOH
реакция практически не идет;
СН3СОО –
+ HOH
СН3СООН + ОН –, рН >
7. Молекулярное
уравнение гидролиза
СН3СООNa
+ HOH
СН3СООН + NaОН . Если
анион многозарядный, то в числе продуктов
могут быть кислые соли, например:
Na2CO3
+ HOH
NaHCO3
+ NaOH;
I ступень
гидролиза: CO
II ступень
гидролиза: НCO
+ HOH
H2CO3
+ NaOH . Накапливающиеся
в растворе ионы ОН –
препятствуют протеканию II
ступени гидролиза, поэтому чаще всего
гидролиз идет только по I
ступени. Соли
слабого основания и сильной кислоты
гидролизуются с увеличением концентрации
катионов водорода в растворе, т. е.
реакция среды кислая (рН < 7),
например: (NH4)2SO4
2NH4+
+ SO
;
SO
+ HOH
реакция практически не идет;
NH4+
+ HOH
NH4OH
+ H+,
рН < 7. Молекулярное
уравнение гидролиза:
(NH4)2SO4
+
HOH
NH4OH
+ NH4HSO4
. При этом
гидролиз не доходит до конца, так как
накопление в растворе ионов водорода
препятствует образованию свободной
кислоты.
В
реакции участвуют и катион, и анион
соли. Реакция среды определяется
относительной силой образующихся
слабой кислоты и слабого основания.
Если Kдис
(кисл) >
Kдис
(осн), то
рН < 7; если Kдис
(кисл) <
Kдис
(осн), то
рН > 7, а когда Kдис(кисл)
= Kдис
(осн), то
рН
7.
Например:
NH4COOH
+ HOH
NH4OH
+ HCOOH, рН
= 7,
так
как Kдис(HCOOH)
= Kдис(NH4OH)
= 1,76
10-5.
Если кислота и
основание, образующие соль, являются
не только слабыми электролитами, но и
малорастворимы или неустойчивы и
разлагаются с образованием газообразных
продуктов, то гидролиз, как правило,
протекает практически необратимо,
например: Al2S3
+ 6HOH
2Al(OH)3
+ 3H2S
;
2Al3+
+ 3S2–
+ 6HOH
2Al(OH)3
+ 3H2S
. Количественно
гидролиз соли характеризуется степенью
гидролиза h
и константой
гидролиза Kг.
Степень
гидролиза
h
показывает,
какая часть
соли находится в гидролизованном
состоянии и выражается в долях единицы
или в процентах:
h
= Сг
/
Собщ
,
где
Сг
– концентрация гидролизованной части
соли; Собщ
– общая
концентрация растворенной соли. Расчет
константы гидролиза Kг
и степени гидролиза h
ведут по
формулам: 1)
гидролиз
по аниону:
Kг
=
где
Kк-ты
– константа
диссоциации слабой кислоты. Изменение
рН раствора соли, происходящее в
результате ее гидролиза, может быть
вычислено по формуле:
Kг
=
рН
= 14 – рОН = 14 + lg
2)
гидролиз
по катиону:
Kг
=
где
Kосн
– константа
диссоциации слабого основания.
[H+]
=
;
[H+]
= h
СМ;
рН = -lg[H+]
= -lg
. 3)
гидролиз
по катиону и аниону одновременно:
Kг
=
Для
этого случая концентрация раствора
соли практически не влияет на h:
h
=
Кроме
того, [H+]
=
Согласно
принципу Ле Шателье: 1)
чем слабее кислота или основание,
образующиеся при гидролизе соли, тем
сильнее эта соль гидролизуется; 2)
разбавление раствора соли усиливает
гидролиз; 3)
гидролиз по катиону (аниону) усиливается
при добавлении к раствору соли основания
(кислоты); 4)
при повышении температуры гидролиз
усиливается.
Пример
1. Определить
рН водного раствора бората натрия.
Р е ш е н и е
Na3BO3
+ HOH
H3BO3
+ NaOH . Гидролиз
соли, образованной сильным основанием
NaOH
и слабой
многоосновной кислотой H3BO3
определяется ступенчатым характером
диссоциации борной кислоты и обратного
процесса – соединения ионов BO Процесс
гидролиза бората натрия можно выразить
уравнениями:
I ступень:
ВO
II
ступень: НВO
+ HOH
H2ВO
+ OH– ;
III
ступень: H2ВO
+ НOH
H3BO3
+ OH– . Как
правило, гидролиз заканчивается на I
ступени. Тогда молекулярное уравнение
гидролиза имеет вид:
Na3BO3
+ HOH
Na2НBO3
+ NaOH, рН
> 7.
Пример
2. В какую
сторону сместится гидролитическое
равновесие при смешивании растворов
карбоната натрия и сульфата алюминия?
Р е ш е н и е
Al2(SO4)3
+ 3Na2CO3
+ 6HOH
2Al(OH)3
+ 3H2O
+ 3CO2
+ 3Na2SO4 . В
результате смешивания растворов катионы
Н+,
образующиеся при гидролизе Al2(SO4)3,
соединяются с анионами ОН–,
образующимися при гидролизе Na2CO3,
что приводит к смещению равновесия
реакции в сторону образования продуктов
гидролиза. Смещение усиливается за
счет разложения образующихся молекул
Н2CO3
и выделения малорастворимого основания
Al(OH)3,
поэтому реакция идет практически до
конца. В ионной форме уравнение реакции
имеет вид 2Al3+
+
3CO
+ 6HOH
2Al(OH)3
+ 3H2O
+ 3CO2
Пример
3. Вычислить
константу гидролиза, степень гидролиза
и рН 0,02 М раствора СН3СООK.
Р е ш е н и е Соль
СН3СООK
образована
сильным основанием КОН
и слабой
кислотой СН3СООН.
Ионное уравнение гидролиза:
СН3СОО–
+ НОН
СН3СООН
+ ОН– .
Kг
=
=
h
=
=
[ОН–]
= h
СМ
= 1,6710-40,02
= 3,3410-6;
рОН = –lg
3,3410-6
= 5,48;
рН = 14 – рОН = 14 –
5,48 = 8,52.
З А Д А Ч И
1. Вычислить
константу и степень гидролиза KCN
в 0,1 М растворе.
2. Написать
уравнение гидролиза в сокращенном
ионном виде и указать рН среды для
солей: а) NaClO; б) (NH4)2SO4;
в) СH3COOK.
3. Указать,
какие из приведенных солей будут
подвергаться гидролизу: а) NaBr;
б) NaClO4; в) NaCN. Написать сокращенные
ионные уравнения, указать рН среды.
4. Написать
сокращенное ионное уравнение и вычислить
константу и степень гидролиза 0,05 М
раствора СН3СООNa.
5. Написать
уравнение гидролиза в сокращенном
ионном виде и указать рН среды для
солей: а) CuCl2; б) Ca(CH3COO)2;
в) Pb(NO3)2. 6.
Написать уравнение гидролиза в
сокращенном ионном виде и вычислить
константу и степень гидролиза 0,2 М
раствора Na2CO3
по первой ступени. 7.
Указать, какую реакцию среды будут
иметь растворы приведенных солей,
подтвердив это соответствующими
уравнениями гидролиза: а) NaNO2;
б) CoCl2;
в) Ba(NO2)2.
8.
Написать уравнение гидролиза в
сокращенном ионном виде и вычислить
степени гидролиза по катиону и аниону
в 0,3 М растворе (NH4)2S. 9.
Указать, какие из приведенных солей
будут подвергаться гидролизу, написать
сокращенные ионные уравнения, указать
рН среды: а) K2CO3;
б) (NH4)2SO4;
в) CsNO3.
10. Рассчитать
константу и степень гидролиза в 0,1 М
растворе фосфата натрия по первой
ступени.
11. Написать
уравнение гидролиза в сокращенном
ионном виде и указать рН среды
для солей: а) NaHS; б) (NH4)2S;
в) K2SO4. 12.
Вычислить константу гидролиза и степень
гидролиза сульфита натрия в 0,1 М
растворе.
13. Указать,
какую реакцию среды будут иметь растворы
следующих солей, подтвердив это
соответствующими уравнениями гидролиза:
а) NH4NO3; б) Mg(CH3COO)2;
в) SnCl2.
14. Написать
молекулярно-ионные формы уравнений
гидролиза (отдельно для катиона и
аниона) и указать рН среды для солей:
а) Na3AsO4; б) CoSO4; в)
AlCl3. 15.
Рассчитать константу и степень гидролиза
гипохлорита калия в 0,1 М растворе соли.
16. Написать
уравнение гидролиза в сокращенном
ионном виде и указать рН среды для
солей: а) KH2PO4; б) Pb2S;
в) KNO2.
17. Написать
уравнения гидролиза и указать реакцию
среды растворов следующих солей:
а) Ba(HCOO)2; б) Al(CH3COO)3;
в) Mn(ClO4)2 .
18. Написать
уравнения гидролиза в сокращенном
ионном виде и указать рН среды для
солей: а) ZnCl2; б) Na2HPO4;
в) Ca(HS)2 . 19.
Написать уравнения гидролиза и указать
реакцию среды растворов следующих
солей: а) ZnSO4;
б) NaHS; в) CrI3
.
20. Написать
уравнение гидролиза в сокращенном
ионном виде и указать рН среды
для солей: а) СuSO4; б) Fe(НSO3)2;
в) KHCО3 . 21.
Указать, какие из приведенных солей
будут подвергаться гидролизу, написать
сокращенные ионные уравнения, указать
рН среды: а) K2CO3;
б) Ca(CH3COO)2;
в) AlCl3. 22.
Написать уравнения гидролиза и указать
реакцию среды растворов следующих
солей: а) NH4NO3;
б) Al(CH3COO)3;
в) ZnCl2.
23. Вычислить
степень гидролиза и рН в 0,1 М растворе
NaHS.
24. Вычислить
рН 1 М раствора сульфата цинка,
гидролизующегося по первой ступени.
25. При смешении
растворов Al(НSO4)3
и K2S
в осадок выпадает Al(OH)3.
Указать причину этого и составить
соответствующие молекулярные и
ионно-молекулярные уравнения.
ПРИЛОЖЕНИЕ
Таблица
1
C
Р, Па
С
Р, Па
С
Р, Па
0
610,4
14
1598,5
28
3780,0
1
657,2
15
1705,2
29
4005,0
2
705,2
16
1817,2
30
4242,2
3
757,3
17
1937,1
32
4753,0
4
813,3
18
2065,1
34
5318,0
5
871,9
19
2197,1
36
5940,0
6
934,6
20
2338,4
38
6623,0
7
1001,2
21
2486,4
40
7374,0
8
1073,2
22
2643,7
50
12334,0
9
1147,8
23
2809,1
60
19920,0
10
1227,9
24
2983,7
70
31160,0
11
1311,9
25
3167,7
80
43360,0
12
1402,5
26
3361,0
90
70100,0
13
1497,2
27
3565,0
100
101325,0
Таблица
2
Растворитель
К
Е
Растворитель
К
Е
Вода
1,86
0,52
Этиловый спирт
--
1,16
Бензол
5,10
2,57
Ацетон
2,40
1,50
Анилин
5,87
3,69
Хлороформ
4,90
3,89
Таблица 3
Электролит
Уравнение
диссоциации
Кдис
Азотистая
кислота
HNO2
H+
+ NO2-
4,010-4
Борная
кислота
H3BO3
H+
+ H2BO3-
H2BO3-
H+
+ HBO32-
HBO32-
H+
+ BO33-
6,010-10
1,810-13
1,610-14
Вода
H2O
H+ + OH-
1,810-16
Муравьиная
кислота
HCOOH
H+ + HCOO-
1,810-4
Сернистая
кислота
H2SO3
H+ + HSO3-
HSO3-
H+
+ SO32-
1,310-2
5,010-6
Сероводородная
кислота
H2S
H+ + HS-
HS-
H+
+ S2-
5,710-8
1,210-15
Синильная
кислота
HCN
H+ + CN-
7,210-10
Плавиковая
кислота
HF
H+ + F-
7,410-4
Угольная кислота
H2CO3
H+ + HCO3-
HCO3-
H+
+ CO32-
4,310-7
5,610-11
Уксусная
кислота
CH3COOH
H+
+ CH3COO-
1,810-5
Фосфорная
кислота
H3PO4
H+
+ H2PO4-
H2PO4-
H+
+ HPO42-
HPO42-
H+
+ PO43-
7,510-3
6,210-8
2,210-13
Щавелевая
кислота
H2C2O4
H+
+ HC2O4-
HC2O4-
H+
+ C2O42-
5,910-2
6,410-5
Гидроксид
аммония
NH4OH
NH4+
+ OH-
1,810-5
Гидроксид
свинца
Pb(OH)2
PbOH+
+ OH-
PbOH+
Pb2+
+ OH-
9,610-4
3,010-8
Гидроксид
цинка
Zn(OH)2
ZnOH+
+ OH-
ZnOH+
Zn2+
+ OH-
5,010-5
1,510-9
Таблица
4
Ионная сила
раствора
Коэффициенты
активности ионов
однозарядных
Двухзарядных
Трехзарядных
0,01
0,92
0,63
0,52
0,02
0,89
0,53
0,44
0,05
0,81
0,44
0,33
0,10
0,78
0,33
0,18
Таблица 5
Электролит
ПР
Электролит
ПР
AgBr
6,010-13
CaC2O4
2,010-9
AgCl
1,810-10
CaSO4
1,310-4
AgI
1,110-16
Ca3(PO4)2
1,010-29
BaCrO4
1,610-10
Cd(OH)2
2,010-14
CaCO3
5,010-9
PbI2
8,010-9
1. Угай Я.А.
Общая и неорганическая химия. М.: Высш.
шк., 1997.
2. Ахметов Н.С.
Общая и неорганическая химия. М.:
Высш. шк., 1998.
3. Коровин Н.В.
Общая химия. М.: Высш. шк., 1998.
4. Гольбрайх
З.Е., Маслов Е.И. Сборник задач и
упражнений по химии. М.: Высш. шк., 1997.
5. Лидин Р.А.,
Молочко В.А., Андреева Л.Л. Задачи по
неорганической химии. М.: Высш. шк., 1990.
6. Романцева
Л.М., Лещинская З.Л., Суханова В.А.
Сборник задач и упражнений по общей
химии. М.: Высш. шк., 1991.
7. Витинг Л.М.,
Резницкий Л.А. Задачи и упражнения
по общей химии. М.: Изд-во МГУ, 1995.
8. Коршунов Б.Г.,
Стефанюк С.Л. и др. Задачник по общей
химии для металлургов. М.: Высш. шк.,
1977.
9. Слета Л.А.
Химия: Справочник. Харьков: Фолио, 1997.
10. Рабинович
В.А., Хавин З.Я. Краткий химический
справочник. СПб.: Химия, 1994.
Способы выражения
состава растворов
3
Свойства разбавленных
растворов неэлектролитов
9
1. Осмотическое
давление
9
2. Давление пара.
I закон Рауля 11
3. Температура
кипения и замерзания. II
закон Рауля 12
Свойства растворов
электролитов 15 Степень
диссоциации и константа диссоциации
слабых
электролитов 15
2. Сильные
электролиты. Активность. Ионная сила
18
Диссоциация воды.
Буферные растворы 22
Произведение
растворимости 26
Приложение
36
Литература 39
Редактор
Н.А. Бачурина Компьютерная
верстка А.М. Бачурина ЛР
№ 021316 от 25 декабря 1998 г.
Сдано в набор
04.06.2001 г. Подписано к печати 29.06.2001 г.
Тир. 25 экз. Уч.-изд.
л. 1,9. Усл. печ. л. 2,33.
Формат 60841/16
. Гарнитура Таймс.
Череповецкий
государственный университет
1
40По дисциплине «химия»
Способы выражения состава растворов
Основные способы выражения состава раствора
![]() =
=
![]() =
=
![]() = 10 % мас.
= 10 % мас.![]()
![]() =
=
![]() =
=
![]() = 0,25.
= 0,25.![]() =
=
![]() =
18,7 см3.
=
18,7 см3.
![]() =
=
![]() .
.
![]() ,
или 2 =
,
или 2 =
![]() .
.![]() =
=
![]() = 5,56 г.
= 5,56 г.![]() =
=
![]()
х =
710 г Н2О.
х =
710 г Н2О.![]()
m2
=
V;
СМ
=
m2
=
V;
СМ
=
![]() ; СН
=
; СН
=
![]() .
.![]() =
=
![]() =
=
![]() = 0,693 моль/дм3;
= 0,693 моль/дм3;![]() =
=
![]() =
=
![]() = 1,386 моль/дм3.
= 1,386 моль/дм3.![]() ,
тогда СН
=
2 = 2
СМ
.
,
тогда СН
=
2 = 2
СМ
.![]() 100
% ,
100
% ,![]() 100
% .
100
% .![]() 100 %
100 %![]() 100 % =
100 % = 1. Осмотическое давление
![]() R
T
= С R
T
или
росм
= СМ
R
T
,
R
T
= С R
T
или
росм
= СМ
R
T
,
![]() R T
. Тогда
формула для расчета молярной массы
растворенного вещества имеет вид
R T
. Тогда
формула для расчета молярной массы
растворенного вещества имеет вид![]() =
=
![]() =
92 г/моль.
=
92 г/моль.![]() =
510-5 моль/дм3.
=
510-5 моль/дм3.![]() =
0,1 моль/дм3.
=
0,1 моль/дм3.2. Давление пара. I закон Рауля
![]() .
Связь между р и р
в случае нелетучего растворенного
вещества устанавливает I
закон Рауля: относительное
понижение давления пара растворителя
над разбавленным раствором неэлектролита
р /p
пропорционально мольной доле растворенного
вещества N2:
.
Связь между р и р
в случае нелетучего растворенного
вещества устанавливает I
закон Рауля: относительное
понижение давления пара растворителя
над разбавленным раствором неэлектролита
р /p
пропорционально мольной доле растворенного
вещества N2:![]() =
=
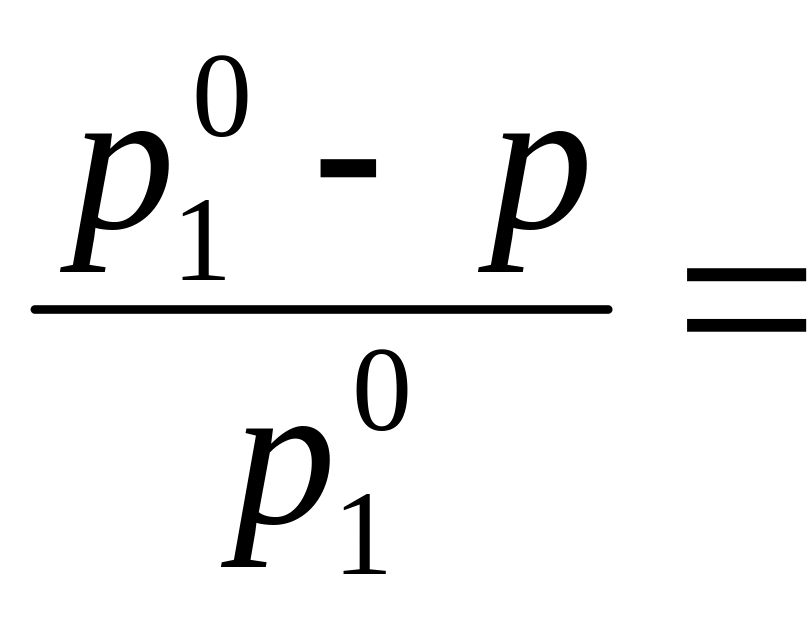 N2 .
N2 .
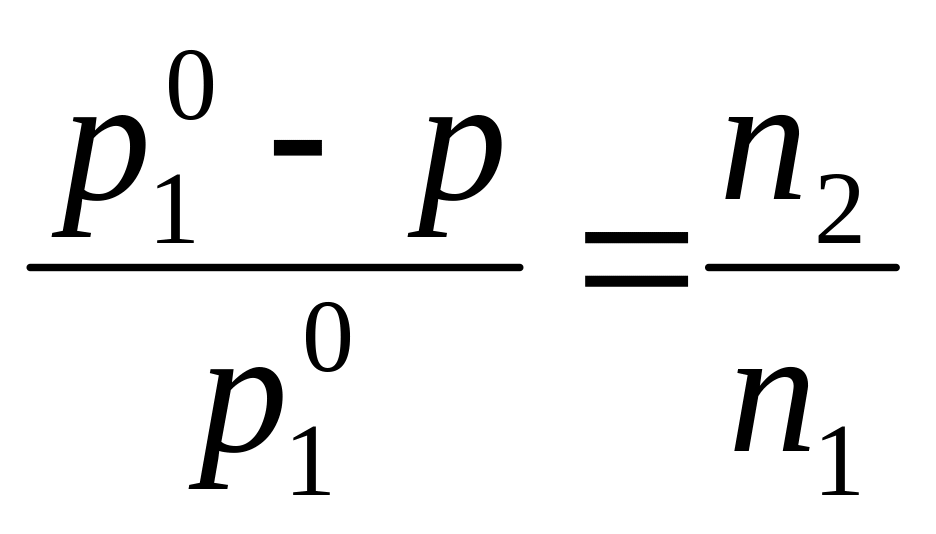 .
.![]() =
р
– р
=
р
– р
![]() ,
,![]() =
3148,2 Па .
=
3148,2 Па .![]() =
=
![]() ,
,
![]() ,
,3. Температура кипения и замерзания. II закон Рауля
![]() = E
b; Tзам
= Tзам –
Т
= E
b; Tзам
= Tзам –
Т ![]() =
K
b,
=
K
b,![]() ;
M2
= K
;
M2
= K
![]() .
.![]() = 2,57
кг
К/моль
= 2,57
кг
К/моль
![]() 2,09
К.
2,09
К.![]() 4,14 К .
4,14 К .Свойства растворов электролитов
![]() 100
%
.
100
%
.1. Степень диссоциации и константа диссоциации слабых электролитов
![]() ,
,![]() ,
,![]() или СМ =
или СМ =
![]() .
.![]() или [ион] =
или [ион] =
![]() .
.![]() ,
Kдис 1 =
7,110-3, 1
= 27 % – для I ступени;
,
Kдис 1 =
7,110-3, 1
= 27 % – для I ступени;![]() ,
Kдис 2 = 6,210-8
, 2 = 0,15 %
– для II ступени;
,
Kдис 2 = 6,210-8
, 2 = 0,15 %
– для II ступени;![]() ,
Kдис 3 =
5,010-13, 3
= 0,005 % – для III ступени.
,
Kдис 3 =
5,010-13, 3
= 0,005 % – для III ступени.![]() =
3,2410-2
=
= 3,24 %.
=
3,2410-2
=
= 3,24 %.![]() = 1,6110-5 моль/дм3.
= 1,6110-5 моль/дм3.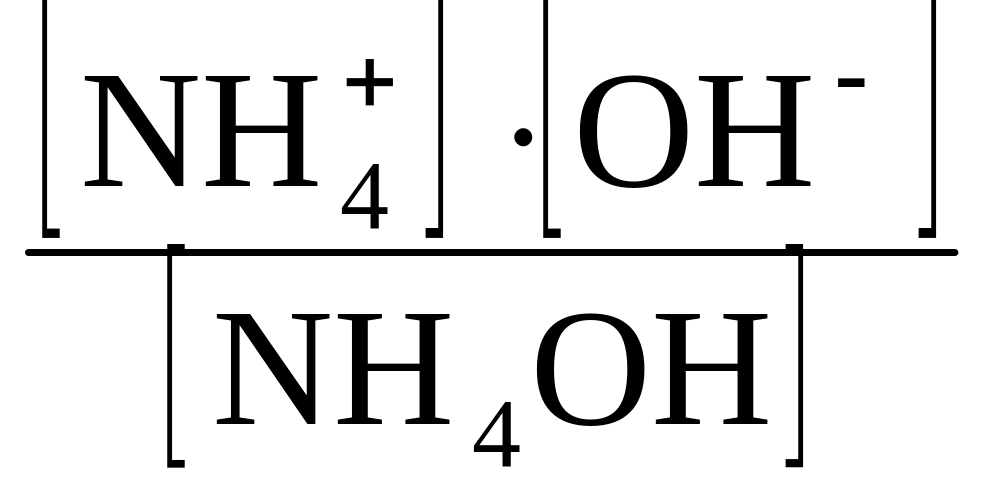 можно получить ОН ˉ
=
можно получить ОН ˉ
=
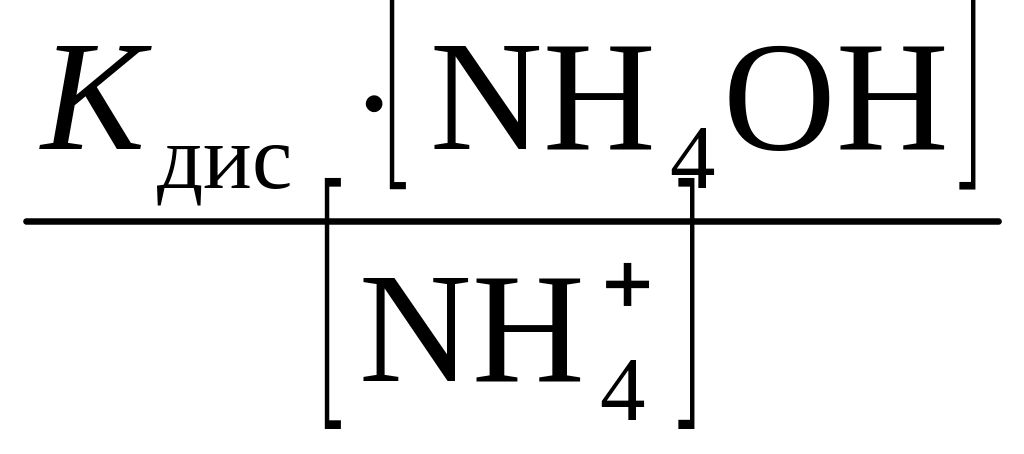 .
.![]() ,
полученной за счет диссоциации слабого
электролита NH4OH,
можно пренебречь. Тогда
,
полученной за счет диссоциации слабого
электролита NH4OH,
можно пренебречь. Тогда![]() = 3,610-6 моль/дм3.
= 3,610-6 моль/дм3.2. Сильные электролиты. Активность. Ионная сила
![]() =
=
![]()
![]() ,
,![]() – активности
катиона и аниона;
– активности
катиона и аниона;
![]() – коэффициенты
активности катиона и аниона; а2
,
f2
– активность
и коэффициент активности электролита
в растворе. Такая константа диссоциации
называется термодинамической.
– коэффициенты
активности катиона и аниона; а2
,
f2
– активность
и коэффициент активности электролита
в растворе. Такая константа диссоциации
называется термодинамической.![]() = (СМ)2
= (СМ)2
![]() .
.![]() ;
f
=
;
f
=
![]() .
.Для электролита KmAn аналогичные выражения имеют вид:
![]() ;
f
=
;
f
=
![]() .
.![]()
![]() ,
,![]() – заряды ионов; I –
ионная сила раствора.
– заряды ионов; I –
ионная сила раствора.![]() .
.![]() ,
,![]() ,
,![]() = i
СМ R T
;
рэксп
= i
p
= i
СМ R T
;
рэксп
= i
p
![]() ;
;
![]() =
I K
b и
Т
=
I K
b и
Т![]() = I E b.
= I E b.![]() .
Следователь-но,
равновесные концентрации ионов равны:
.
Следователь-но,
равновесные концентрации ионов равны:
![]()
= СМ = 0,01 моль/дм3.
= СМ = 0,01 моль/дм3.![]() в 0,06 молярном растворе Sr(NO3)2,
получающемся в процессе выделения
стронция из концентрата целестина?
в 0,06 молярном растворе Sr(NO3)2,
получающемся в процессе выделения
стронция из концентрата целестина?![]() + [
]
z
+ [
]
z![]() )
= 1/2(0,0622
+ 20,0612)
= 0,18.
)
= 1/2(0,0622
+ 20,0612)
= 0,18.![]() =
-0,522
=
-0,522![]() = -0,85,
= -0,85,![]() = -0,21,
= -0,21,![]() = K
b .
= K
b .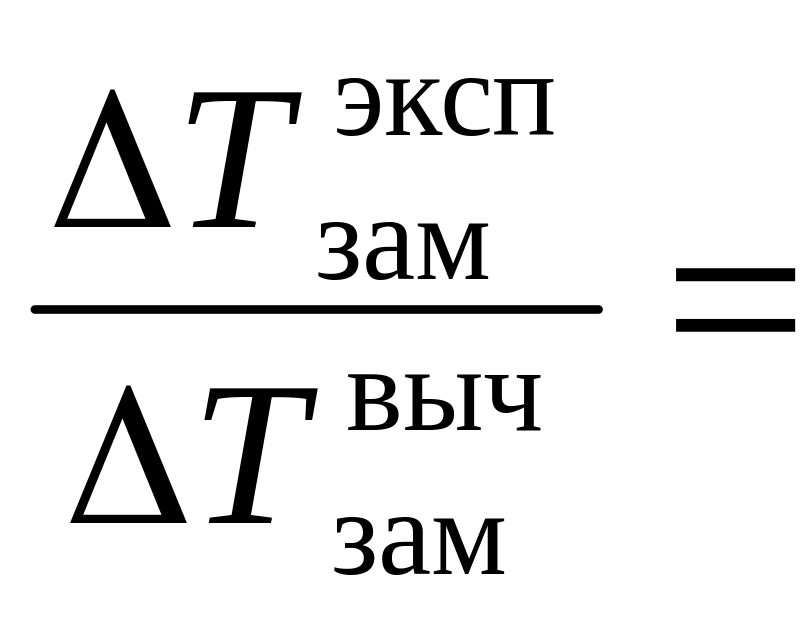
![]()
![]()
Диссоциация воды. Буферные растворы
![]() = 10-14 = KВ
= [Н +][ОН –].
= 10-14 = KВ
= [Н +][ОН –].![]() =
10–7 моль/дм3.
=
10–7 моль/дм3.
![]() ;
рН + рОН = 14.
;
рН + рОН = 14.![]() .
.![]() .
.![]() ,
,![]() =
=
![]() = 10-12
моль/л.
= 10-12
моль/л.![]() = - lg Kк-ты
– lg
(0,02/0,01) =
= - lg Kк-ты
– lg
(0,02/0,01) =Произведение растворимости
![]()
a
a![]() = (f+
[Km+])n
(f–
[An
-]m).
= (f+
[Km+])n
(f–
[An
-]m).![]() .
.![]() 1,310-4
моль/дм3.
1,310-4
моль/дм3.![]() = 14 + lg
= 14 + lg![]() = 12,4.
= 12,4.![]() ;
[I –] =
;
[I –] =
![]() ,
, =
=
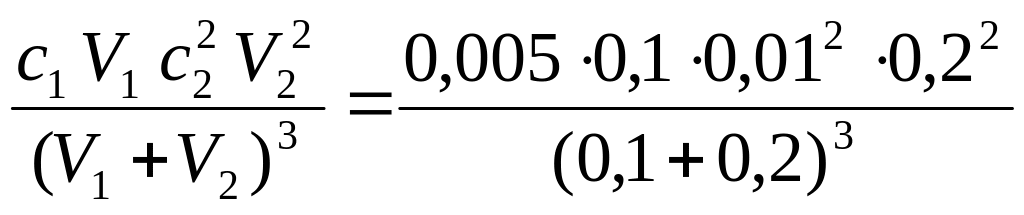 = = 7,410-8
.
= = 7,410-8
.Гидролиз солей
1. Гидролиз по аниону.
![]() + HOH
HCO
+ HOH
HCO![]() + OH –;
+ OH –;2.Гидролиз по катиону.
3. Гидролиз по катиону и аниону одновременно.
4. Необратимый полный гидролиз.
![]() ,
h
=
,
h
=
![]() =
=
![]() ,
,
![]() ;
[ОН –]
=
;
[ОН –]
=
![]() и [ОН –]
= h
СМ ;
и [ОН –]
= h
СМ ;![]() ,
h
=
,
h
=
![]() =
,
=
,
![]() ,
,
![]() =
=
![]() .
.![]() .
.![]() ; рН = -lg
.
; рН = -lg
.![]() с ионами
Н+.
с ионами
Н+.![]() + HOH
HВO
+
OH– ;
+ HOH
HВO
+
OH– ;![]() = 5,5610-10;
= 5,5610-10;
![]() = 1,6710-4;
= 1,6710-4;Давление насыщенного водяного пара при различных температурах
Криоскопические (k) и эбулиоскопические (е) константы некоторых растворителей
Константы диссоциации слабых электролитов при 25 с
Коэффициенты активности ионов
Произведения растворимости малорастворимых электролитов при 25 с
Литература
Содержание
Гидролиз солей 29
162600, Г. Череповец, ул. Луначарского, 5.

2
39
3
38
4
37
5
36
6
35


7
34
8
33
9
32
10
31
11
30
12
29
13
28
14
27
15
26
16
25
17
24
18
23
19
22
20
21
41
48
42
47
43
46
44
45
