
- •Термохімія
- •Молекулярність і порядок реакції
- •Кінетика необоротних реакцій
- •Необоротна реакція першого порядку
- •Необоротна реакція другого поряду
- •3.1 Електрохімічні процеси та їхнє медико-біологїчне значення. Розчини електролітів.
- •3.3 Кондуктометричне визначення ступеня та константи йонізації слабкого електроліту. Закон розведення Оствальда.
- •3.4 Кондуктометричне титрування. Застосування кондуктометрії в медицині.
- •4.1 Електродні потенціали та механізм їх виникнення. Рівняння
- •4.3 Електрохімічні (гальванічні) елементи та електрорушійні сили.
- •4.4. Дифузійні та мембранний потенціали, їхнє біологічне значення. Рівняння Нернста.
- •4 .5 Потенціометрія: потенціометричне визначення рН за допомогою воднево-хлорсрібного та хлорсрібного скляного елемента. Потенціометричне титрування.
- •Ізотерма адсорбції Ленгмюра
- •5.2 Адсорбція на межі поділу рідина - газ та рідина - рідина. Рівняння Гіббса. Орієнтація молекул поверхнево-активних речовин у поверхневому шарі.
- •5.3 Уявлення про структуру біологічних мембран. Адсорбція на межі поділу тверде тіло - газ.
- •5.4 Адсорбція із розчину на поверхні твердого тіла. Фізична та хімічна адсорбція. Закономірності адсорбції розчинених речовин, парів та газів. Рівняння Фрейндліха.
- •6.1 Адсорбція електролітів: специфічна (вибірна) та йонообмінна. Правило Панета- Фаянса.
- •6.2. Йонообмінники природні та синтетичні. Роль адсорбції та йонного обміну в процесах життєдіяльності рослин і організмів.
- •6.3. Хроматографія. Класифікація хроматографічних методів аналізу за ознакою агрегатного стану фаз, техніки виконання та механізму розподілу. Адсорбційна, йонообмінна та розподільча хроматографія.
- •6.4. Застосування хроматографії в біології та медицині. (спрс)
- •7.1 Загальна характеристика дисперсних систем: основні визначення та класифікація.
- •7.3 Електричні властивості колоїдно-дисперсних систем: механізм утворення подвійного електричного шару. Рівняння Гельмгольца-Смолуховського. Електрофоретична рухливість.
- •7.4 Електрокінетичні явища: електроосмос, електрофорез, потенціали перебігу та седиментації. Застосування електрофорезу в дослідницькій та клініко-лабораторній практиці.(спрс)
- •8.1 Стійкість та коагуляція дисперсних систем. Коагуляція гідрофобних золів під дією електролітів. Поріг коагуляції. Правило Шульце—Гарді.
- •9.1 Високомолекулярні сполуки - основа живих організмів. Глобулярна та фібрилярна структура білків. Порівняльна характеристика розчинів високомолекулярних сполук, істинних та колоїдних розчинів.
- •9.3 Аномальна в'язкість розчинів вмс. В'язкість крові. Мембранна рівновага Доннана.
- •9.4 Ізоелекгричний стан білка. Ізоелєктрична точка та методи її визначення. Йонний стан біополімерів в водних розчинах.
- •9.5 Значення високомолекулярних сполук (вмс) у медицині та фармації. (спрс).
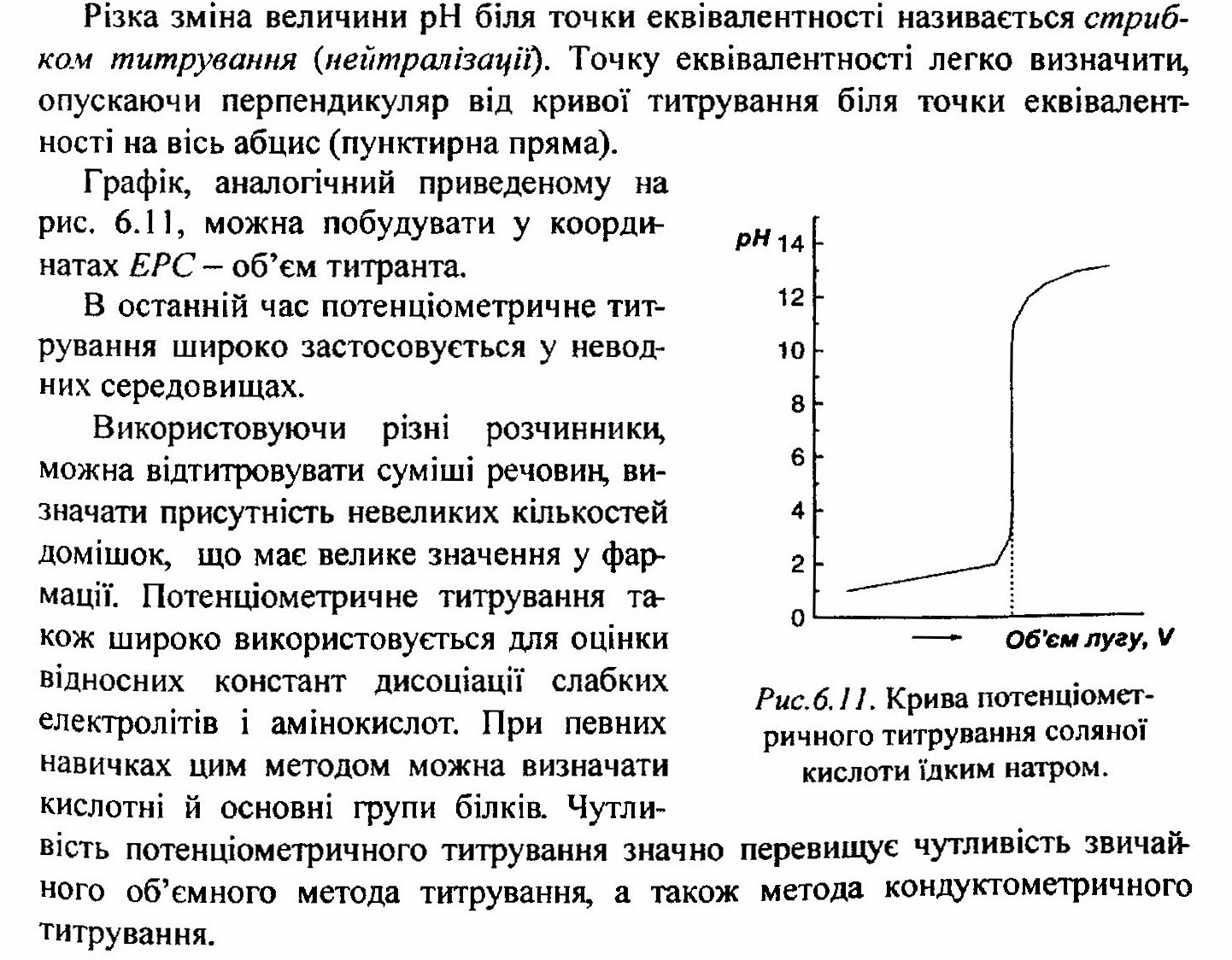
4 .5 Потенціометрія: потенціометричне визначення рН за допомогою воднево-хлорсрібного та хлорсрібного скляного елемента. Потенціометричне титрування.



Потенціометричне титрування.


Самостійна робота : Розв’язування задач з тем «Вчення про розчини» та Електрохімія»
Тема. Как определить массу испарившейся жидкости ?
Пример . Сосуд вместимостью 1,000 дм3 содержит воздух при 1,01 .105 Н. м -2 и 00С. После введения в сосуд 1,000 г воды температуру подняли до 900С. Найдите массу испарившейся воды. Давление насыщенного пара воды при 900С равно 6,99.105 Н. м-2.
Решение . Воспользуемся уравнением состояния идеального газа : PV = nRT . В которое подставим заданные значения : Р = 6,99.105 Н. м-2 ; R = 8,314 Дж.К-1.мол-1 ; Т = 273 К +900С= 363 К ; V = 1,000 дм3 = 1.10-3 м-3 .
6,99.105 . 1.10-3 = n . 8,314 . 363
Количество воды в пару (n) = 2,32 . 10-2 моль
Масса воды (М) = 18,0 ( Н2О = 1.2 + 16) г.моль-1
Исходя из формулы n(моль) = m(грамм) / M (г.моль-1 ) находим m паров воды : m= n . M
Масса паров воды = 18,0 . 2,32 . 10-2 = 0,417 г
Решите самостоятельно задачу :
Медицинская сестра случайно разбила термометр . Давление насыщенного пара ртути при 20 0С равно 0,160 Па . Если разлитое не убрано сразу, какая масса ртути будет содержаться в 1 см3 воздуха при этой температуре ?
Объёмы газов обычно сравнивают при 00С и 1 атм. – стандартных
температуре и давлении (СТД). Иногда сравнение ведут при КТД –
комнатной температуре (200С) и давлении 1 атм . В системе СИ
давление измеряют в Ньютонах, приходящихся на 1 м2 ( Н.м-2);
называется эта единица Паскаль (Па) :
1атм = 1,01132.105 Н.м-2 = 1,0132.105 Па = 760 мм рт.ст.
Единицей измерения объёма в системе СИ служит 1 м3; используют
также 1 дм3, 1см3 и 1л : 1м3 = 103 дм3 = 106 см3 ; 1дм3 = 1л .
Температура должна измеряться в Кальвинах (К) : (Т) К = t0С + 273.
Тема. Температура замерзания (∆Тз) и криоскопическая постоянная (k)
Растворение 1 моль вещества в 1 кг воды понижает температуру замерзания на 1,86 К.
Тоесть ∆Тз = k . n ( Закон Рауля)
( k Н2О = 1,86 К.кг. моль-1)
Понижение
температуры криоскопическая количество вещества, моль(n) 1 m 1
замерзания (∆Тз) = постоянная (k) х -------------------------------------- = k.n --- = k .---. ----
Масса растворителя, кг (w) w M w
Пример. Чему равна температура замерзания водного раствора глюкозы с массовой долей 3% ?
Дано : W(глюк) = 3% С6Н12О6 = 72+12+96 = 180 г.моль-1
k Н2О = 1,86 К.кг. моль-1
m 1
Решение : Согласно закону Рауля (∆Тз) = k .---. ---- ;
M w неизвестно только - m
m(вещества)
Его мы находим из формулы W(вещества) = ---------------------------------------------- 100%
w(m)(растворителя) + m(вещества)
Х грам
3% = -----------------------------100% путём подбора определили, что Х = 3,09 г
100 г Н2О + Х грамм
3,09 1
(∆Тз) = 1,86 ----------- ------------ = 0,311
0,100 кг
∆Тз = tзам воды - t зам.раствора t зам.раствора = 00 - 0,311= 0,3110
Ответ раствор глюкозы замерзает при t = 0,3110 С
Задача для самостоятельного решения : Какова молекулярная масса вещества Х , если водный раствор его . содержащий 5,12 г в 100 г воды . замерзает при - 0,2800 С; криоскопическая постоянная воды равна k Н2О = 1,86 К.кг. моль-1
( Ответ : М = 340 г. моль-1)
Тема. Определение осмотического давления .
Есть определённа аналогия с давлением газа. 1 моль вещества А , испаряясь, занимает при 00 С и 1,01.105 Н.м-2 объём 22,4 дм3, а моль А, растворённый в 22.4 дм3 растворителя. При 00С развивает осмотическое давление 1,01.105 Н.м-2 . Выражение подобно уравнению для идеального газа
πV = nRT
π- осмотическое давление; V- объём; n- число моль раствора; T- температура, К;
R- газовая постоянная, а именно 8,314 Дж.К-1.моль-1. Это уравнение Вант-Гоффа.
Пример . Можно ли использовать раствор , содержащий хлорид натрия и др. необходимые компоненты, в качестве физиологического раствора при 370 с, если он замерзает при -0,80 С.
Дано : t зам. = - 0,80
t раствора = 370
k Н2О = 1,86 К.кг. моль-1
R- 8,314 Дж.К-1.моль-1 =0,0831 атм/моль K.
-------------------------------------------------------------------
Решение : по уравнению Вант-Гоффа. πV = nRT ∆Тз
Находим n через ∆Тз = k . n ( Закон Рауля) n = -------
K
∆Тз = 00 - (-0,80) = 0,8 Т = 370С + 273К = 310 К
0,8
πV = ----------- 0,083 . 310 = 11,06 атм
1,86
Ответ: Чтобы вводить физраствор он должен быть изотоничен крови. Осмотическое давление крови в норме 7,7 -8 атм . А у полученного раствора осмотическое давление больше , тоесть он гипертоничен по отношению к крови и в кочестве физраствора его использовать нельзя .
Задача для самостоятельного решения: В 1 литре раствора содержится 18.4 г глицерина .
Вычислите осмотическое давление раствора при 300 К.
( ответ 4,98 . 105 Па)
Тема Электрохимия. Потенциометрическое титрование.
Пример задачи. Найти рН при титровании 0,001 М раствора СН3СООН едким натром в точках :
А) до титрования ;
В) после нейтрализации 0,9 кислоты ;
С) в момент эквивалентности , если КСН3СООН = 1,76 . 10-5
Дано: КСН3СООН = 1,76 . 10-5
С кислоты = 0,001 моль/л
---------------------------------------------
Решение : 1. Определение рН1 до титрования осуществляем по формуле :
рН1 = ½ рКкисл - ½ lgCкисл
рКкисл = - lgКкисл = 4,7
рН1 = ½ 4,7 - ½ lg10-3 = 2,351 + 1,5 = 3,85
2. рН2 после титрования 0,9 кислоты определяется по формуле
Скисл
рН2 = рКкисл - lg --------
Ссоли
Если обозначить объём кислоты, взятый до титрования через V, то к моменту , когда оттитравано 0,9 всей кислоты Скисл = 0,001. V . 0,1 , а Ссоли = 0,001 . V.0,9 так как вся оттитрованная кислота превращается в соль. Тогда
0,1 1
рН2 = 4,7 - lg -------- = 4,7 - lg -------- = 5,6543
0,9 9
3. рН3 раствора в момент эквивалентности по формуле
рН3 = 7 + ½ рКкисл - ½ lgCсоли так как в момент эквивалентности вся кислота превращается в соль , то Ссоли = Скисл (без учёта разбавления) = 0,001 моль/л
рН3 = 7 + 4,7/2 - ½ lg -3 = 7,85
Ответ : рН1 = 3,85 ; рН2= 5,6543 ; рН3 = 7,85 .
Задача для самостоятельного решения . Вычислите значение рН раствора масляной кислоты (С3Н7СООН) концентрации 1.00.10-2 моль.дм-3 , значение Ка которой равно 1,51.10-5 моль.дм-3 .
(ответ рН = 3,42).
Фізична та колоїдна хімія
Лекція № 5. Адсорбція на рухомій та нерухомій межі
поділу фаз
5.1 Поверхневі явища та їхнє значення в біології й медицині. Поверхневий натяг рідин та розчинів. Ізотерма поверхневого натягу. Рівняння Ленгмюра. Поверхнево-активні та поверхнево-неактивні речовини. Поверхнева активність. Правило Дюкло - Траубе.
5.2 Адсорбція на межі поділу рідина-газ та рідина - рідина. Рівняння Гіббса. Орієнтація молекул поверхнево-активних речовин у поверхневому шарі.
5.3 Уявлення про структуру біологічних мембран. Адсорбція на межі поділу тверде тіло - газ.
5.4 Адсорбція із розчину на поверхні твердого тіла. Фізична та хімічна адсорбція. Закономірності адсорбції розчинених речовин, парів та газів. Рівняння Фрейндліха.
5.5 Фізико-хімічні основи адсорбційної терапії (гемосорбція, плазмосорбція, лімфосорбція, ентеросорбція, аплікаційна терапія). Імуносорбенти. (СПРС)
Самостійна робота : Фізико-хімічні основи адсорбційної терапії .
5.1 Поверхневі явища та їхнє значення в біології й медицині. Поверхневий натяг рідин та розчинів. Ізотерма поверхневого натягу. Рівняння Ленгмюра. Поверхнево-активні та поверхнево-неактивні речовини. Поверхнева активність. Правило Дюкло - Траубе.




Природний мінерал - клиноптилоліт, велике родовище якого знаходиться у Сокирниці (Закарпаття), - був вперше застосований після Чорнобильської аварії для зв'язування радіонуклідів, які могли потрапити з дощовими водами в Прип'ять, а потім в Дніпро та інші річки, які є основним джерелом питної води. Сьогодні клиноптилоліт широко використовується на водоочисних станціях як фільтруючий матеріал практично у всіх великих містах України. Цеоліт також використовують при виробництві поглинаючих сумішей (памперсів) тощо.
Інший природний сорбент - гідрофобізований перліт - застосовується як фільтруючий матеріал у системі оборотного водопостачання атомних електростанцій. Природні адсорбенти (глини, опоки, трепели, діатоміти, вугілля, торфи й ін.) застосовуються безпосередньо або після хімічного і термічного активування.
Ізотерма поверхневого натягу. Поверхнева активність.
