
- •Казахский национальный технический университет имени к.И.Сатпаева
- •Учебная программа дисциплины – Syllabus
- •Данные о преподавателе:
- •Данные о дисциплине:
- •Выписка из учебного плана
- •1.3 Пререквизиты:
- •1.4 Постреквизиты:
- •Краткое описание
- •Перечень и виды заданий и график их выполнения:
- •Виды заданий и сроки их выполнения
- •Список литературы
- •1.8 Контроль и оценка знаний.
- •Распределение рейтинговых баллов по видам контроля
- •Оценка знаний студентов
- •Политика и процедура
- •Содержание Активного раздаточного материала
- •Тематический план курса
- •2.2 Конспект лекционных занятий
- •2.3 Планы практических занятий
- •2.4 Планы занятий в рамках самостоятельной работы студентов под руководством преподавателя (срсп)
- •2.5 Самостоятельная работа студентов (срс)
- •2. 6 Тестовые задания для самоконтроля
- •2.7. Перечень экзаменационных вопросов по пройденному курсу.
- •2.9. Глоссарий
- •Содержание
- •Учебно-методический комплекс дисциплины для студентов
Политика и процедура
Посещение занятий является обязательным для всех студентов; не опаздывать и не пропускать занятий; внимательно отслеживать предлагаемый преподавателем сценарий занятия, активно участвуя в нем; работать в аудитории с отключенными сотовыми телефонами; самостоятельно заниматься в библиотеке, дома.
Практические и самостоятельные работы в виде текущего контроля должны сдаваться своевременно в соответствии со сроком сдачи. При начислении баллов за сданную семестровую работу позднее установленного срока устанавливается коэффициент 0,8.
Будьте толерантны, уважайте чужое мнение. Возражения формулируйте в корректной форме. Самостоятельно выполнять все семестровые задания. Плагиат и другие формы нечестной работы недопустимы. К плагиату относятся: отсутствие ссылок при использовании печатных и электронных материалов, цитат, мыслей других авторов. Недопустимы подсказывание и списывание во время тестов, экзаменов, сдача экзамена за другого студента. За консультациями по выполнению самостоятельных работ, их сдачей и защитой, а также за дополнительной информацией по пройденному материалу и всеми другими возникающими вопросами по читаемому курсу обращайтесь к преподавателю в период его офис-часов.
Содержание Активного раздаточного материала
Таблица 6
Тематический план курса
|
Наименование темы |
Количество академических часов |
|||
№ |
Лекции
|
Практические занятия |
СРСП |
СРС |
|
1
|
Значение проблемы коррозии металлов при эксплуатации нефтегазового оборудования. Классификация и виды коррозионных разрушений. |
2 |
2 |
4 |
4 |
2
|
Способы выражения скорости коррозии. Способы защиты металлов от коррозии |
2 |
2 |
4 |
4 |
3 |
Химическая коррозия. Виды химической коррозии. |
2 |
2 |
4 |
4 |
4 |
Электрохимическая коррозия. Виды электрохимической коррозии. |
2 |
2 |
4 |
4 |
5 |
Механизм образования электрохимической коррозии. |
2 |
2 |
4 |
4 |
6 |
Почвенная коррозия. Катодная, протекторная защита. |
2 |
2 |
4 |
4 |
7 |
Защита нефтепромыслового оборудования от коррозии. Ремонт оборудования. |
3 |
3 |
6 |
6 |
|
Всего |
15 |
15 |
30 |
30 |
2.2 Конспект лекционных занятий
Лекция 1.
Наука о коррозии изучает механизм и закономерности процессов взаимодействия металлов с окружающей средой, разрабатывает способы защиты металлов от коррозии в различных условиях.
Коррозией называется самопроизвольное окисление металлов, уменьшающее долговечность изделий. Среда, в которой металл подвергается коррозии, называется коррозионной или агрессивной.
Защитой металлов от коррозии человечество начало заниматься очень давно, почти одновременно с началом применения металлов. С древнейших времен стальные доспехи и оружие воинов подвергались полированию и воронению не только для улучшения внешнего вида, но и целю защиты их от коррозии.
Начало научного изучения коррозии было положено работами великого русского естествоиспытателя М.В. Ломоносова, которому принадлежит открытие в 1748г закона сохранения массы.
Французский химик А. Лавуазье продолжил работы М.В. Ломоносова и в 1773г. установил, что окисление металла есть соединение его с кислородом.
Важное значение для развития теории коррозии имели работы Э. Холла (1879г.) и Г.Дэви (1824г.) которые показали, что при отсутствии воздуха железо и медь не корродируют.
Исключительное значение для обоснования электрохимического механизма коррозии имели исследования выдающихся ученых установивших закон электролиза (Г. Дэви, М. Фарадей), образование микрогальванических элементов (О. Де ла Рив), вытеснение из растворов одних металлов другими (Н.Н. Бекетов), теория электролитической диссоциации (С. Аррениус), теория электродных и диффузионных потенциалов.
Важными для практики явились работы по разработке стойких красок, по защите стали цинком, по разработке методов защиты оборудования от коррозии.
В комплекс предприятий нефтяной и газовой промышленности включается большое число производств, характеризующихся различной технологией: объекты энергетического, машиностроительного и химических профилей, коммуникации и установки по транспортировке нефти, газа, сжатого воздуха, воды, химических реагентов, морские гидротехнические сооружения промыслов и т.д.
Большое разнообразие технологических процессов, климатических и географических условий, значительные объемы металлозатрат и жесткие условия эксплуатации делают проблему износа оборудования одной из центральных, определяющих темпы роста и технико-экономическую эффективность добычи нефти и газа.
Одним из основных вопросов бурения, добычи и транспортировки нефти и газа является срок службы бурильных, лифтовых, обсадных и нефтепроводных труб. Наличие сероводорода, углекислого газа и некоторых органических кислот в газе и пластовых водах приводит к быстрому выходу труб из строя и сдерживает развитие бурения и добычи нефти и газа.
Процесс коррозии начинается с поверхности металлического сооружения и распространяется в глубь него. При этом изменяется внешний вид металла: на его поверхности образуются углубления (язвы, пятна), заполненные продуктами коррозии,
По характеру коррозионного разрушения металлов различают следующие виды коррозии:
-сплошная (коррозия по всей поверхности металлической конструкции, находящейся под воздействием коррозионной среды);
-местная (коррозия на отдельных участках поверхности металлической конструкции).
Местная коррозия может быть следующих видов:
-пятнами (в виде отдельных пятен, диаметр которых больше глубины прокорродировавшего слоя металла);
-язвенная (в виде отдельных каверн, диаметр которых соответствует их глубине);
-точечная или питтинговая (в виде множества отдельных точек диаметром 0,1-2 мм);
-сквозная (сквозное разрушение металла);
-подповерхностная (коррозия распространяющаяся преимущественно под поверхностью металла и вызывающая вспучивание металла);
-структурно-избирательная (разрушается только одна структурная составляющая сплава, например графитизация чугуна);
- межкристаллитная (распространяется по границам кристаллов металла, при этом внешний вид поверхности металла не меняется.);
- коррозионное растрескивание (образование коррозионных трещин вследствие коррозионной усталости металла).
Классификация коррозионных процессов представлена на рисунке 1.
Рекомендуемая литература: Осн1 [16-20,26-29]; осн 2 [6-14]; осн 3 [8-12].
Контрольные вопросы:
Что такое коррозия, какие вопросы решает наука о коррозии?
Какие исследования выдающихся ученных оказали значение для развития теории коррозии?
Какие виды коррозионного разрушения металлов вы можете называть?
Как подразделяется коррозия по механизму протекания процесса?
Лекция 2.
Скорость коррозии может быть выражена в различных единицах.
-по потере металла, отнесенной к единице поверхности и к единице времени, например, г\ (см2. ч) или г\ (м2. год);
-по глубинному показателю, т.е. по уменьшению толщины металла вследствие коррозии, выраженному в линейных единицах и отнесенному к единице времени, например, мм\год;
-по коррозии, связанной с разрушением кристаллической решетки металла, при этом учитывается механически показатель, т.е. относительное изменение прочности металла за определенный период, например, уменьшение временного сопротивления на разрыв, кг\(см2. год).
Коррозионная стойкость металлов в настоящее время оценивается по десятибалльной шкале с учетом глубинного показателя.
Кроме массовых способов измерения потерь металла нередко используют объемные способы. Это возможно в тех случаях, когда окисление металла сопровождается расходом или выделением газа.
Так, при атмосферной коррозии расходуется кислород, а при кислотной – выделяется водород.
Объем израсходованного кислорода или выделившегося водорода пропорционален массе окислившегося металла.
Измерения объема менее точно, чем взвешивание, но при массовом методе необходимо прервать испытание, удалить продукты коррозии и лишь тогда определять уменьшение массы образца.
За изменением объема газа в некоторой замкнутой системе можно следить не прерывая испытания, что дает более содержательную информацию о кинетике процесса коррозии.
Массовые потери металла (в г) в первом случае определяются по формуле:
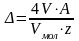 ;
;
во втором:
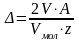 ;
;
где V, Vмол - объем израсходованного кислорода (объем выделившегося водорода) и их молярные объемы в условиях опыта;
А – атомная масса металла;
z- валентность металла в продуктах коррозии.
Массовый показатель скорости коррозии при этом определяется по формуле:
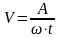 ;
;
где
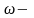 поверхность корродированного участка;
поверхность корродированного участка;
t- время.
Массовый
показатель скорости коррозии
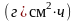 можно
определить также через плотность тока,
используя, законы Фарадея:
можно
определить также через плотность тока,
используя, законы Фарадея:
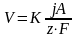 ;
;
где
К- коэффициент, учитывающий в каких
единицах выражена плотность тока (если
j
выражена в А\см2,
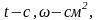 то
К=1)
то
К=1)
j- плотность тока;
F- константа (число Фарадея).
Применение
этих методов оценки массового показателя
скорости иногда затруднительно из-за
того, что неизвестна валентность (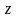 ).
Например, при коррозии железа в воде
или на воздухе в ржавчине могут содержаться
одновременно ионы двух и трехвалентного
железа в разных соотношениях.
).
Например, при коррозии железа в воде
или на воздухе в ржавчине могут содержаться
одновременно ионы двух и трехвалентного
железа в разных соотношениях.
Однако эти методы нашли широкое применение в практике научно- исследовательских работ.
В связи с тем, что коррозия – естественный процесс обусловленный термодинамической нестойкостью металлов в эксплуатационных условиях, срок службы металлических изделий часто бывает относительно коротким. Продлить его можно в основном четырьмя способами, которые широко используются на практике:
-изоляция поверхности металлических изделий от агрессивной среды;
-воздействие на металл с целью повышения его коррозионной устойчивости;
-воздействие на окружающую среду с целью снижения ее агрессивности;
-поддержание такого энергетического состояния металла, при котором окисление его термодинамически невозможно или сильно заторможено.
Первый способ носит название пассивной защиты.
К нему относятся следующие методы:
Нанесение на поверхность металла слоя химически инертного относительно металла и агрессивной среды вещества с высокими диэлектрическими свойствами. Этот метод является наиболее распространенным. Он предполагает использование различного ряда мастик, красок, лаков, эмалей и пластмасс, жидких в момент нанесения, а затем образующих твердую пленку, которая обладает прочным сцеплением (адгезией) с поверхностью металла.
К пассивным способам защиты от коррозии относится способ нанесения на изделия из малостойкого металла тонкого слоя другого металла, обладающего меньшей скоростью коррозии в данной среде (например, оцинкование, хромирование, никелирование стальных изделий), а также обработка изделий специальными окислителями, в результате которой на поверхности металла образуется слой малорастворимых продуктов коррозии (образование окиси алюминия на изделиях из алюминиевых сплавов).
Второй способ защиты - введение в металл компонентов, повышающих его коррозионную стойкость в данных условиях, или удаление вредных примесей, ускоряющих коррозию. Он применяется на стадии изготовления металла, а также при термической и механической обработке металлических изделий.
Легирование металла приводит к образованию сплавов с высокой коррозионной стойкостью, например, нержавеющие стали, легированные хромом и никелем.
Третий способ защиты предусматривает обработку агрессивной среды путем введения ингибиторов (замедлителей) коррозии. Действие ингибиторов сводится, в основном, к адсорбции на поверхности металла молекул или ионов ингибитора, тормозящих коррозию.
Четвертый способ носит название активной защиты.
К нему относятся следующие способы:
- постоянная катодная поляризация изделия, эксплуатирущегося в среде с достаточно большой электропроводностью, осуществляемая от внешнего источника электрической энергии (катодная защита).
При катодной защите изделию сообщается настолько отрицательный электрический потенциал, что окисление металла становится термодинамически невозможным.
- катодная поляризация, вызванная электрическим контактом изделия с металлом, обладающим более отрицательным электродным потенциалом, например стального изделия с магниевой отливкой, лежит в основе протекторной защиты. Более электроотрицательный металл в среде с достаточно высокой электропроводностью подвергается окислению и, следовательно, разрушается.
Такой металл называется протектором, а метод- протекторной защитой.
К четвертому способу можно отнести также мероприятия по борьбе с блуждающими токами, которые ведутся по двум основным направлениям: предупреждение или уменьшение возможности возникновения блуждающих токов на самом источнике тока и проведение специальных работ на защищенном подземном сооружении.
К способам защиты от коррозии часто относят использование неметаллических материалов, обладающих высокой химической стойкостью (асбоцемент, бетон, керамика, стекло, пластмассы и т.д.).
Рекомендуемая литература: Осн2[14-19]; доп 8 [48-50].
Контрольные вопросы:
В каких единицах выражается скорость коррозии?
Какие способы защиты от коррозии вы знаете?
Что относится к способу пассивной защиты от коррозии?
Что относится к способу активной защиты от коррозии?
Лекция 3.
Химической коррозией называют процесс самопроизвольного разрушения металлов при их взаимодействии с сухими газами или жидкими неэлектролитами, происходящий по законам химических реакций. При взаимодействии металла с сухими газами (воздухом, газообразными продуктами горения топлива) при высоких температурах происходит газовая химическая коррозия.
Газовая коррозия возможна и при низких температурах, если при этом на поверхности металла не конденсируется жидкость, проводящая электрическии ток. При взаимодействии металла с жидкостями не проводящими электрический ток (нефть, нефтепродукты, расплавленная сера и т.д.) происходит химическая коррозия в неэлектролитах.
Кинетику протекания химических реакций удобно проиллюстрировать на примере окисления металла кислородом воздуха:

где n-число атомов металла, участвующих в реакции;
z- валентность металла.
С чисто термодинамической точки зрения интенсивность протекания такого вида реакций зависит от химической активности металлов по отношению к кислороду.
Например, алюминий по отношению к кислороду проявляет такую большую химическую активность, что отбирает его даже у воды и разлагает ее если каким–нибудь способом воспрепятствовать образованию на алюминиевой поверхности защитной пленки:
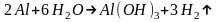
Однако на практике алюминиевые предметы нашли весьма широкое применение. Дело в том, что поверхность соприкасающегося с воздухом алюминия немедленно окисляется и дальнейший процесс окисления зависит от того, в каком физическом состоянии находится его окись: если она рыхлая и порошкообразная, то в дальнейшем окисляются все новые и новые слои алюминия, а предмет быстро разрушается. На практике окись алюминия образует на поверхности сплошной слой, через который не может проникнуть кислород. Таким образом, окись защищает алюминий от дальнейшего окисления, то есть окисление алюминия – это такой химический процесс, который сам себя тормозит.
В общем случае использование металла в качестве конструктивного материала в данной среде возможно только в том случае, если процесс окисления достаточно заторможен.
Для понимания процесса химической коррозии и разработки против нее действенной защиты нужно, в первую очередь изучить механизм окисления металлов и свойства образующейся в результате окисления окисной пленки.
Известно, что активность металлов по отношению к кислороду уменьшается с увеличением температуры. При нагревании окиси металла до соответствующей температуры происходит ее разложение (диссоциация) и реакция протекает до конца справа налево.
Стабильность окиси металла – необходимое условие начала процесса коррозии, но дальнейшее окисление и размер наносимого им ущерба зависят от свойства окиси.
На
процесс коррозии оказывает влияние
также тип образующихся на поверхности
металла окислов. Толщина окисной пленки
колеблется от 5-10 до нескольких тысяч ангстрем. Окисная
пленка может утолщаться только в том
случае, когда через нее диффундирует
кислород. Если ионы металла и принадлежащие
им электроны диффундируют из железа
через окисную пленку намного быстрее
чем кислород, то окисная пленка растет
на границе газа и окисла. В противном
случае зона роста будет находиться под
слоем окисла. Если скорость диффузии
ионов металла и кислорода не очень
отличаются друг от друга, то зона роста
располагается внутри окисной пленки.
Размеры ионов металла меньше, чем
молекула кислорода, поэтому окисная
пленка обычно растет на поверхности,
соприкасающейся с газом. Толщина окисной
пленки зависит от вида металла, характера
среды, температуры и т.д.
до нескольких тысяч ангстрем. Окисная
пленка может утолщаться только в том
случае, когда через нее диффундирует
кислород. Если ионы металла и принадлежащие
им электроны диффундируют из железа
через окисную пленку намного быстрее
чем кислород, то окисная пленка растет
на границе газа и окисла. В противном
случае зона роста будет находиться под
слоем окисла. Если скорость диффузии
ионов металла и кислорода не очень
отличаются друг от друга, то зона роста
располагается внутри окисной пленки.
Размеры ионов металла меньше, чем
молекула кислорода, поэтому окисная
пленка обычно растет на поверхности,
соприкасающейся с газом. Толщина окисной
пленки зависит от вида металла, характера
среды, температуры и т.д.
По толщине окисные пленки можно разделить на три группы:
-тонкие (до 400 ) – невидимые и обнаруживаемые лишь косвенными металлами;
-средние (400-500 )- дают цвета побежалости при нагреве;
-толстые (более 500 )- видимые.
Если окисная пленка сплошная, хорошо сцепляется с металлам и имеет близкий к нему коэффициент объемного расширения, то она способна в той или иной мере защитить металл от дальнейшего окисления.
Основные условия защитного действия окисной пленки против дальнейшего окисления металла – ее сплошность, которая зависит от соотношения объема окисленного металла и объема образовавшегося при этом окисла.
Если:
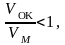
образуются рыхлые окисные пленки со слабыми защитными свойствами.
Если:
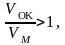
Образуются достаточно сплошные окисные пленки, тормозящие дальнейшее окисление металла.
Наилучшими
защитными свойствами обладают окисные
пленки с соотношением объемов
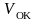 и
и
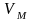 в
следующих пределах:
в
следующих пределах:
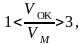
Газовая коррозия – наиболее распространенный вид химической коррозии. Она происходит в результате взаимодействия сплава металла с газом при высоких температурах.
Различают следующие виды газовой коррозии железа, стали и чугуна: окисление, обезуглероживание, водородная хрупкость, «рост» чугуна.
Окисление железа, стали, и чугуна происходит, при нагреве их в среде воздуха или продуктов сгорания топлив. Металл при этом покрывается слоем окалины, состоящей из окислов-соединений металла с кислородом.
Обезуглероживание стали и чугуна происходит при высоких температурах вследствие диффузии углерода из металла к его поверхности, последующего окисления и удаления получающихся при этом газообразных продуктов. В результате близкий к поверхности слой стали, лишается значительной части углерода, снижается твердость и предел усталости стали, уменьшается износоустойчивость её поверхности. Для увеличения стойкости стали и чугуна против обезуглероживания в них добавляют легирующие элементы, небольшое количество алюминия, хрома, вольфрама или марганца.
Водородная хрупкость стали может появиться при нагреве её в среде водорода при высоких температурах (выше 300 0С) и высоких давлениях. При данных условиях происходит растворение водорода в металле и образуется хрупкий непрочный твердый раствор водорода в железе. В результате этого процесса прочность стали снижается, в ней могут появиться трещины.
«Рост чугуна» сопровождается заметным увеличением размеров чугунных изделий и снижением их прочности. Он происходит вследствие межкристаллитного окисления металла по границам зёрен и включений графита. Поскольку объем образующихся окислов больше объема окисленного металла, происходит деформация изделия (вспучивание). Хорошо противостоят «росту» чугуны, легированные кремнием, никелем, хромом и марганцем.
Рекомендуемая литература: Осн2[20-27]; осн 3 [16-18,39-79,121-140].
Контрольные вопросы:
Что такое “химическая коррозия”? По какому механизму протекает химическая коррозия?
Какое влияние оказывает тип окисной пленки на коррозионный процесс?
Что такое “обезуглероживание стали”?
Как проявляется вид коррозии “рост чугуна”?
Объясните вид коррозии “окисление железа, стали и чугуна”.
Лекция 4.
Электрохимическая коррозия представляет собой самопроизвольное разрушение металлов в результате электрохимического взаимодействия с жидкими электролитами, обладающими электропроводностью. Такими электролитами могут быть вода, водные растворы кислот, щелочей, расплавленные соли. Электрохимическая коррозия широко распространена и имеет много разновидностей. Причина электрохимической коррозии-пониженная термодинамическая устойчивость большинства металлов и их стремление переходить в ионное состояние.
При электрохимической коррозии взаимодействие металла с окружающей средой характеризуется анодным и катодным процессами, протекающими на различных участках поверхности металла. Продукты коррозии образуются только на анодных участках.
С электрохимическим механизмом протекают следующие виды коррозионных процессов:
Коррозия в электролитах – коррозия металлов в жидких средах, проводящих электрический ток. В зависимости от вида электролита различают коррозию в растворах кислот, щелочей и солей (кислотная, щелочная, солевая), в морской, речной воде.
Состав электролита определяет механизм процесса коррозии, влияет на его кинетику и скорость. Например скорость коррозии уменьшается, если электролит содержит анионы или окислители, в результате взаимодействия с которыми на поверхности металла образуется пленка труднорастворимых солей.
Растворенный в электролите кислород оказывает тормозящее или ускоряющее воздействие на процесс коррозии металлов.
На процесс коррозии влияет и концентрация электролита. Практически во всех природных средах с ростом концентрации солей в электролите скорость коррозии сначала возрастает до некоторого максимума, а затем уменьшается в результате снижения растворимости кислорода и затруднения катодного процесса.
Температура электролита также оказывает влияние на скорость коррозии. Это обусловлено тем, что с повышением температуры возрастает электропроводность электролита. С ростом температуры электролита скорость коррозии иногда может возрасти в десятки и сотни раз.
Почвенная коррозия – коррозия подземных металлических сооружений под воздействием почвенного электролита. На поверхности металлических изделий, находящихся в контакте с почвенным электролитом, вследствие местных неоднородностей металла или электролита возникает большое количество коррозионных элементов, природа которых аналогично природе гальванических элементов.
Биокоррозия
– частный случай почвенной коррозии,
протекающая под воздействием
микроорганизмов, в результате
жизнедеятельности которых образуются
вещества, ускоряющие коррозионные
процессы. В природе наиболее широко
распространены сульфатвосстанавливающие
анаэробные бактерии, в результате
действия которых образуется сероводород,
который, соединяясь с железом, дает
сернистое железо. Сульфатвосстанавливающие
анаэробные бактерии, обычно обитают в
воде, грязи, сточных водах, нефтяных
скважинах, донных осадках, почве, цементе.
Наиболее благоприятной средой для
развития этих бактерий являются почвы
с
 (оптимально 6-7,5) при 25-300С.
Жизнедеятельность железных аэробных
бактерий сопровождается выделением в
качестве продуктов коррозии нерастворимой
пленки гидроокиси железа.
(оптимально 6-7,5) при 25-300С.
Жизнедеятельность железных аэробных
бактерий сопровождается выделением в
качестве продуктов коррозии нерастворимой
пленки гидроокиси железа.
Атмосферная коррозия – коррозия металлов в атмосфере воздуха или в среде любого влажного газа. При отсутствии влаги в воздухе железо корродирует с незначительной скоростью.
В пустыне, например, стальные изделия очень долго остаются блестящими.
Атмосферы существенно различаются по влажности, температуре и загрязнению, поэтому скорость атмосферной коррозии в различных районах неодинакова, чем ближе к морскому побережью, тем больше воздух насыщен морской солью, в особенности NaCl. В промышленных областях в воздухе появляются значительные количества SO2, который превращается в серную кислоту. При работе двигателей внутреннего сгорания в большом количестве образуется NO, который выделяется в атмосферу. В городах и индустриальных центрах в атмосферу выделяется большое количество H2S.
По агрессивности атмосферы можно разделить на следующие основные типы: морскую, промышленную, городскую, сельскую, арктическую.
Специфическими факторами, влияющими, на агрессивность атмосферы являются (кроме газов) пыль и влага.
Пленки ржавчины, образующиеся в атмосферных условиях, могут иметь защитные свойства, поэтому скорость коррозии со временем снижается.
Электрокоррозия – коррозия подземных металлических сооружений, вызванная проникновением на сооружения токов утечки с рельсов электрифицированного транспорта или других промышленных электроустановок и сооружений (электрифицированные железные дороги, метрополитены, линии передачи постоянного тока, установки катодной защиты подземных металлических сооружений).
Эти токи получили название блуждающих, величина и направление их могут изменяться во времени.
Основной величиной, характеризующей интенсивность процесса электрокоррозии, являются сила тока, стекающего с подземного сооружения в грунт, отнесенная к единице поверхности.
Величина тока утечки с подземного сооружения зависит от многих факторов, в частности:
- удельное сопротивление земли;
- величина блуждающих токов в земле;
- взаимное расположение источников блуждающих токов и подземного сооружения;
- состояние внешнего изолирующего покрытия на подземном сооружении;
- продольное сопротивление подземного сооружения.
Контактная коррозия – коррозия, вызванная электрическим контактом двух металлов имеющих различный электрохимический потенциал.
Коррозия под напряжением возникает при одновременном воздействий коррозионной среды и механических напряжений в металле.
Щелевая коррозия – ускорение коррозионного разрушения металла электролитом в узких зазорах и щелях (в резьбовых и фланцевых соединениях).
Коррозионная эрозия – при одновременном воздействии коррозионной среды и трения.
Коррозионная кавитация возникает при одновременном коррозионным и ударном воздействии окружающей среды (коррозия лопаток рабочих колес центробежных насосов, разрушение лопаток гребных винтов на судах).
Фреттинг – коррозия представляет собой локальное коррозионное разрушение металлов при воздействии агрессивной среды в условиях колебательного перемещения двух трущихся поверхностей относительно друг друга.
Структурная коррозия обусловлена структурной неоднородностью сплава. При этом происходит ускоренный процесс коррозионного разрушения вследствие повышенной активности какого–либо компонента сплава.
Термоконтактная коррозия возникает за счет температурного градиента, обусловленна неравномерным нагреванием поверхности металла.
Рекомендуемая литература: Осн1[170-179]; осн 2[7-8]; осн 3 [372-383,397-403,414-420].
Контрольные вопросы:
1.Что такое “электрохимическая коррозия”?
2. Как вы понимаете выражение “электрохимический механизм”?
3. Какие виды коррозии относятся к электрохимической?
4. Что такое “электролит”?
Лекция 5.
Как говорилось выше, причиной электрохимической коррозии является пониженная термодинамическая устойчивость большинства металлов и их стремление переходить в ионное состояние.
Кристаллическое строение металла характеризуется кристаллической решеткой, в узлах которой находятся атомы металла с ослабленными внутриатомными связями ядра с внешними валентными (полусвободными) электронами. Перенос зарядов (электрический ток) в металлах осуществляется полусвободными электронами. Различную степень электропроводности металлов (во всех случаях очень высокую) можно объяснить различным кристаллическим строением их и, следовательно, различным количеством полусвободных электронов, сосредоточенных в узлах кристаллической решетки металла. При обычных условиях полусвободные электроны не могут выйти за пределы атома, но при затрате дополнительной энергии можно создать условия для направленного движения электронов. (нагревание, электрическое поле и.т.д.).
При соприкосновении с водой поверхностные атомы твердого тела подвергаются воздействию силового поля молекул воды, которые как бы внедряются в кристаллическую решетку твердого тела. Это взаимодействие, которое называется гидратацией, может быть настолько сильным, что ослабленные связи атома металла со своими внешними (валентными) электронами нарушаются и атом металла получает возможность покинуть узел кристаллической решетки и перейти в воду. Так образуется ион-атом, несущий положительный заряд. При этом оставшиеся в металле электроны являются носителями отрицательного заряда. Таким образом, у поверхности металла образуется двойной электрический слой, характеризирующийся разностью (скачком) потенциалов между поверхностью металла и слоем раствора, прилегающему к поверхности металла. При достижении определенной величины скачка потенциалов дальнейший переход ион – атомов металла в раствор прекращается. Очевидно, что способность металла отдавать в раствор свои ион – атомы под воздействием силового поля молекул воды определяет различную величину скачка потенциалов в двойном электрическом слое.
Силовое
поле двойного электрического слоя,
образующегося на границе раздела фаз,
препятствует переходу ионов металла
из металла в раствор. Таким образом,
когда ионы металла переходят из металла
в раствор они должны совершать работу
против сил поля, создаваемое двойным
электрическим полем. Переход ионов
может продолжаться до тех пор, пока
разность потенциалов в двойном слое не
достигнет той величины, которая
соответствует разности между свободными
энергиями ионов металла в металле и в
растворе. Затем устанавливается
равновесие. Этому состоянию соответствует
равновесный электродный потенциал(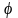 ).
Равновесный электродный потенциал
зависит от свойств ионов, определяющих
его и от их концентрации в растворе.
).
Равновесный электродный потенциал
зависит от свойств ионов, определяющих
его и от их концентрации в растворе.
Зависимость потенциала электрода от концентрации ионов в растворе электролита определяется уравнением В.Нернста:
=
0+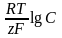 ,
,
где R- универсальная газовая постоянная;
T-температура;
F-число Фарадея.
С-
концентрация ионов в растворе
электролита(при концентрации С, равной
1 моль собственных ионов в 1 л раствора,
потенциал электрода равен
 ).
).
Наибольшая трудность, связанная с уравнением Нернста, обусловлена, невозможностью измерить потенциал одного электрода, поскольку при помощи измерительного прибора можно определить не потенциал одного электрода, а разность потенциалов между двумя электродами. Поэтому при расчетах электродных потенциалов выбран некий электрод, потенциал которого принят равным нулю. Он представляет собой платиновый электрод, погруженный в раствор, содержащий ионы водорода. Водородный электрод, электролит которого в расчете на 1000 г воды содержит 43,18 г соляной кислоты, а обтекающий его поток водорода имеет давление 0,1 МПа (1кгс\см2) называется нормальным водородным электродом. Его электродный потенциал, по соглашению, принимается равным нулю.
Равновесные потенциалы различных электродов, погруженных в раствор собственной соли, в котором активность (концентрация) ионов данного металла равна единице (1 моль\л), измеренные относительно нормального водородного электрода, называются нормальными потенциалами. Они образуют электрохимический ряд напряжений по которому можно предсказать какой металл из выбранной пары будет разрушаться, т.е. служить анодом, а также степень опасности коррозионного процесса.
В 1800г. итальянский физик А. Вольта обнаружил появление электрического тока при погружении в раствор двух различных металлов, соединенных проводником. Это система является прообразом современных гальванических элементов. Электродами гальванического элемента называются металлы или сплавы, погруженные в электролит и снабженные проводниками для отвода тока во внешнюю цепь.
Система электродов, погруженных в электролит, по которому проходит ток от внешнего источника образует электролитическую ячейку. Процесс разложения электролита и превращения вещества на электродах называют электролизом.
Для процесса электролиза и разряда гальванического элемента характерны следующие электродные реакции.
На катоде - реакция восстановления (присоединение электрона)
2Н++2е-=Н2 (водородная
деполяризация);
(водородная
деполяризация);
О2+2Н2О+4е-=4(ОН)- (кислородная деполяризация);
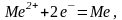 (освобождение
электрона, поступающего во внешнюю
цепь).
(освобождение
электрона, поступающего во внешнюю
цепь).
На аноде (реакция окисления):
Ме2=Ме22++2е-;
4(ОН)-=О2+2Н2О+4е.
Количественное соотношение между химическим превращением вещества на электродах и электрической энергией определяется законами Фарадея.
Первый закон Фарадея – масса вещества, подвергшегося восстановлению на катоде или окислившегося на аноде, прямо пропорционально количеству электричества прошедшего через раствор.
Второй закон Фарадея – масса вещества, окислившегося на аноде при пропускании через раствор одного и того же количества электричества, прямо пропорциональна его химическому эквиваленту.
Оба закона Фарадея можно выразить общей формулой:

где электрический
эквивалент вещества;
электрический
эквивалент вещества;
I- сила тока;
t-время.
Рекомендуемая литература: Осн 1 [22-26]; осн2[28-37]; осн 3 [149-188].
Контрольные вопросы:
Назовите причину возникновения электрохимической коррозии.
Чем определяется электропроводность металлов?
Какие реакции характерны для процесса электролиза?
Что определяют законы Фарадея?
Лекция 6.
Почвенная коррозия является наиболее распространенным видом электрохимической коррозии, оказывающей воздействие на подземные металлические сооружения. Почвы и грунты чрезвычайно разнообразны не только в пределах больших регионов, но даже и в пределах одного небольшого участка. Между почвой, самым поверхностным слоем земли, и грунтом четкой границы нет.
На коррозионную характеристику грунтов и почв, как почвенно–грунтового электролита большое влияние оказывает ее структура, от которой зависит содержание влаги и газов в почве.
Влажность оказывает большое влияние на коррозионную активность почвы и грунта. В воздухопроницаемых почвах и грунтах скорость коррозии стали максимальна при содержании влаги 30 – 50% их влагоемкости.
При дальнейшем повышении влажности скорость коррозии снижается и становится равномерной. Такое явление можно объяснить условием протекания анодной и катодной реакций на стальной поверхности, находящейся в контакте с капиллярно – пористой средой, каковой является грунт.
Процесс анодного растворения железа во влажных грунтах начинается с перехода в почвенный электролит ион–атома металла, несущего положительный заряд. В дальнейшем происходит гидратирование ион– атома полярными молекулами воды и превращение его в нейтральную частицу. При недостатке полярных молекул воды происходит накапливание положительных ион–атомов в приэлектродном слое, т.е. сдвиг потенциала в положительную сторону (анодная поляризация).
На поверхности металлических изделий, находящихся в контакте с почвенным электролитом, вследствие местных неоднородностей состава металла или электролита возникает большое количество коррозионных элементов, природа которых аналогична природе гальванических элементов. При этом коррозионному разрушению подвергаются анодные участки, имеющие более отрицательный электрохимический потенциал по сравнению с близрасположенными катодными участками, имеющими более положительный потенциал.
Электрохимическая
коррозия-результат работы гальванических
элементов. Она происходит следующим
образом: на анодных участках протекает
реакция окисления с образованием ионов
металла Fe2+,
а на катодных участках под влиянием
кислорода образуется гидроокись. Ионы
Fe2+
и
OH-
направляются друг к другу и образуют
нерастворимый осадок Fe(OH)2
который может разлагаться на окись
железа и воду (Fe(OH)2 Fe2O3+H2O).
Высвобождающиеся при реакции окисления
электроны от анодного участка по металлу
изделия перетекают к катодному участку
и участвуют в реакции восстановления.
Fe2O3+H2O).
Высвобождающиеся при реакции окисления
электроны от анодного участка по металлу
изделия перетекают к катодному участку
и участвуют в реакции восстановления.
Основными условиями возникновения почвенной коррозии металлов являются:
- наличие разности потенциалов двух разноименных металлических изделий или их деталей, а также отдельных участков поверхности одного и того же металла;
- наличие контакта двух металлов или двух участков металла с электролитом;
- соединение анода и катода металлическим проводником, которым является металл сооружения, если на его поверхности возникли анодные и катодные участки;
- наличие в электролите диссоциированных ионов.
Такие условия всегда наблюдаются на поверхности любого металла, находящегося в контакте с почвенным электролитом.
Коррозионная активность грунта, характеризуется показателем удельного электрического сопротивления почвы.
Под
удельным электрическим сопротивлением
почвы принято понимать сопротивление
протеканию электрического тока в
условном почвенном проводнике площадью
поперечного сечения 1м2
и длиной 1м (
,Ом
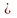 м2).
м2).
Удельное электрическое сопротивление почвы находится в зависимости от её влажности и содержания водорастворимых солей в почвенном электролите. Практически удельное электрическое сопротивление почвы изменяется в широких пределах (от десятых долей до тысяч омметров).
Между удельным электрическим сопротивлением почвы и опасностью коррозии существует прямая зависимость: чем меньше , тем больше возможность коррозии.
Для предотвращения разрушения оборудования и, в частности, трубопроводов применяют защиту.
Катодная защита заключается в создании отрицательного потенциала на поверхности трубопровода, благодаря чему предотвращается возможность выхода электрического тока из трубы, сопровождаемое её коррозионным разъеданием.
С этой целью трубопровод превращают в катод путем подключения трубопровода к отрицательному полюсу постороннего источника постоянного тока, положительный полюс которого (анод) присоединяют к специальному электроду-заземлителю, установленному в стороне от трассы трубопровода. В результате достигается, так называемая катодная поляризация, при которой токи входят из грунта в трубу, так как она является в данном случае катодом по отношению к грунту. Под воздействием электрического поля источника начинается движение свободных валентных электронов в направлении- анодное заземление-источник тока-защищаемое сооружение.
В результате вместо трубопровода разрушается анодный заземлитель.
Принципиальная схема катодной защиты и механизм действия представленый на рисунке 2 и 3
1-вдольтрассовая ЛЭП;
2- трансформаторный пункт;
3-станция катодной защиты;
4-защищаемый трубопровод;
5-анодное заземление;
6-кабель.
Протекторная защита имеет те же основы, что и катодная защита. Разница заключается лишь в том, что необходимый для защиты ток создается крупным гальваническим элементом, в котором роль катода играет металлическая поверхность сооружения, а роль анода -более электроотрицательный металл.
Принципиальная схема протекторной защиты представлена на рисунке 4.
Рекомендуемая литература: Осн 1 [215-224]; осн2[39-49,113-125,157-160]; осн 3 [384-392]; доп 8 [52-73,239-284]; доп 9 [27-29].
Контрольные вопросы:
Как вы понимаете термин “почвенная коррозия”?
Назовите основные условия возникновение почвенной коррозии
Что определяет удельное электрическое сопротивление грунта?
Объясните принцип работы катодной защиты
Объясните принцип работы протекторной защиты.
Лекция 7.
Как говорилось выше, в комплекс предприятий нефтяной и газовой промышленности включается большое количество производств, характеризующихся различной технологией: объекты энергетического, машиностроительного профилей, коммуникации и установки по транспортировке нефти, газа, сжатого воздуха, химических реагентов, морские гидротехнические сооружения промыслов и т.д.
Главные специфические объекты – разнообразное промысловое хозяйство, включающее бурящиеся и эксплуатационные скважины, промысловые коммуникации и оборудование по приготовлению и снабжению глинистыми растворами, водой и газом скважин и технологической обработке добытого газа, нефти и пластовой воды (сепарация, очистка, деэмульсация, обессоливание нефти и газа, сбор, хранение и их транспортировка).
Большое разнообразие технологических процессов, климатических и географических условий, значительные объемы металлозатрат и жесткие условия эксплуатации делают проблему износа оборудования одной из центральных, определяющих темпы роста и технико-экономическую эффективность добычи нефти и газа.
Одним из основных вопросов бурения, добычи и транспортировки нефти и газа является срок службы бурильных, лифтовых, обсадных и нефтепроводных труб. Наличие сероводорода, углекислого газа и некоторых органических кислот в газе и пластовых водах приводит к быстрому выходу труб из строя и сдерживает развитие бурения и добычи нефти газа.
Открытие и разработка новых месторождений, которые во многих случаях характеризуются повышенным содержанием самых агрессивных различных компонентов (сероводород, углекислота, органические кислоты), повышенными физическими параметрами (температура и давление), ставит вопросы коррозии оборудования на первое место. Особенно интенсивно разрушаются металлические элементы нефтепромыслового оборудования. Причины коррозионного разрушения разные. Атмосферная коррозия (эстакады, провода, опоры ЛЭП, поверхности промыслового оборудования и конструкций), действие морской воды (подводные трубопроводы, промысловый флот), абразивный коррозионный износ (лифтовое хозяйство скважин), кавитационное разрушение (лопатки турбин и рабочие колеса центробежных насосов), почвенная коррозия(кабели, подземные трубопроводы), коррозионно-усталостные явления (бурильные трубы, глубиннонасосные штанги). Сильно корродируют все внутренние поверхности теплообменной аппаратуры, труб скважин, насосов под действием морской, пресной и пластовых вод, особенно в присутствии сероводорода и соляной кислоты.
Наиболее опасна коррозия подземного оборудования скважин. Высокие нагрузки, наличие агрессивных коррозионных реагентов приводят к частым поломкам, трудностям ремонта подземного оборудования, потере добычи при остановках для ремонта, к большим.
экономическим потерям и требует осуществления эффективных противокоррозионных мероприятий.
Для протекания процесса электрохимической коррозии обязательным условием является контакт металла с электролитом, роль которого в скважинах играет вода (нефтяных) или водный конденсат (газовые, газоконденсатные) с растворенными в них агрессивными составляющими.
Агрессивное воздействие на металл промыслового оборудования растворенной в воде двуокиси углерода-основная причина интенсивного коррозионного разрушения оборудования на месторождениях, в продукции которых отсутствует сероводород.
Действие углекислого газа в процессе коррозии металла может быть объяснено хорошей растворимостью СО2 в воде, в связи с чем резко возрастает кислотность среды и активизируется процесс электрохимической коррозии, роль электролита в котором играет водная фаза газожидкостного потока. С другой стороны, образовавшаяся в воде углекислота может вызывать разрушение металла путем непосредственного взаимодействия с ним:
Fe+H2CO3 FeCO3
Fe+H2CO3 Fe (HCO3)2
Интенсивность развития процесса углекислотной коррозии оборудования зависит от целого ряда факторов: концентрации СО2, его парциального давления, температуры, скорости движения потока газа.
Сероводородная коррозия промыслового оборудования зависит от коррозионного состава среды, т.е. наряду с присутствием сероводорода большое значение для коррозионной агрессивности имеют такие факторы как, влажность транспортируемого потока, температура и давление его и как следствие, наличие водной и углеводородной фаз, присутствие агрессивного газа, например, окиси углерода и.т.д.
Основные направления по которым может быть осуществлена защита внутренней поверхности оборудования нефте- и газопромыслов следующие:
- применение коррозионностойких легированных сталей;
- защита с помощью металлических и неметаллических покрытий, наносимых на основной металл, подлежащий защите;
- изменение технологии добычи и конструкции оборудования;
- использование ингибиторов коррозии и различных нейтрализаторов.
В настоящее время для оборудования нефтяных, газовых и газоконденсатных скважин применяются, углеродистые стали разных марок легированные для увеличения коррозионной стойкости различными элементами (Cr, Mn, Mo, Ni, и.т.д.).
Одним из эффективных способов защиты от коррозии является способ-ингибирование. Ингибиторы используют для борьбы с коррозией подземного и стального наземного оборудования скважин, емкостей для отстоя и хранения нефти и газа, устранения внутренней коррозии нефти и газопроводов.
Выбор ингибиторов и способов ингибирования для конкретных коррозионных условий весьма сложная задача. Предварительный подбор ингибитора в средах, аналогичных промысловым, осуществляется в лабораторных условиях. При этом определяется марка, защитная концентрация, растворитель, физико-химические свойства ингибиторавлияние его на продуктивность скважин. Выявляется, также, продолжительность сохранения защитного эффекта ингибитора. Подбору режима ингибирования придается серьезное значение.
Для ввода ингибиторов в скважины применяют разнообразные методы, оборудование и устройства.
Как отмечалось выше, коррозия металла является основной причиной многочисленных аварий и ограниченного срока службы нефтепромыслового оборудования.
В настоящее время в промышленности утвердилась система планово-предупредительного ремонта (ППР), заключающаяся в выполнении совокупности организационных и технических мероприятий по уходу, надзору, обслуживанию и ремонту оборудования.
Правильная организация ремонта оборудования удлиняет сроки службы оборудования, исключает аварии.
Система планово-предупредительного ремонта (ППР) позволяет поддерживать оборудование в состоянии, обеспечивающем его нормальную производительность, предотвратить случаи аварийного выхода оборудования из строя, снижение расходов на его ремонт.
Объем текущего ремонта обычно не превыгнает 20% капитального, а среднего ремонта-50% .
При среднем ремонте заменяют и восстанавливают изношенные детали.
Наибольший по объему ремонт – капитальный. При капитальном ремонте производится полная разборка, ремонт и замена всех износившихся узлов. Этот вид ремонта может сочетаться с полной или частичной модернизацией оборудования.
Рекомендуемая литература: Осн 1 [269-274]; осн4[2-64]; доп 6 [84-100]; доп 9 [116-144].
Контрольные вопросы:
1. Назовите основные специфические объекты нефтегазовой отрасли и их оборудование, которые подвергаются коррозионным процессом.
2. Назовите возможный состав агрессивной среды промыслов, определяющий коррозионные процессы оборудования.
3. Назовите основные способы защиты от коррозии внутренней поверхности промыслового оборудования.
4. Что такое “ингибитор”? Какие требования предъявляются к ингибиторам?
5. Какие виды ремонтов оборудования вы можете назвать?
