
- •Лекция 4. ( Вариант 2) Структура и свойства металлов и сплавов
- •2. Атомно-кристаллическая структура металлов
- •3. Дефекты кристаллической решетки металлов
- •4. Кристаллизация металлов и полиморфные превращения в них
- •2. Гетерогенное образование зародышей
- •3. Строение металлического слитка
- •4. Полиморфные превращения
- •3. Фазы и структура в металлических сплавах
- •3.1. Твердые растворы
- •3.2. Химические соединения
- •3.3. Структура сплавов
- •3. Фазы и структура в металлических сплавах Вопросы для самопроверки
3.3. Структура сплавов
Строение металлических сплавов зависит от того, в какие взаимодействия вступают компоненты, их образующие. Под структурой, как уже указано ранее, понимают форму, размеры и характер взаимного расположения фаз в сплаве. Структура сплава выявляется микроанализом (рис. 19). При полной взаимной растворимости компонентов в твердом состоянии микроструктура всех сплавов представляет собой зерна твердого раствора. При ограниченной растворимости, которая характерна для многих сплавов, структура состоит из смеси двух фаз. Если в сплаве растворимый компонент присутствует в количестве, превышающем предельную растворимость его в основном металле при данной температуре, то образуется структура, состоящая из матрицы и выделившихся частиц другого твердого раствора, чаще на базе химического соединения. Такую структуру называют матричной, или гетерогенной. При медленном охлаждении эти фазы выделяются в основном по границам твердого раствора (матрицы) в виде достаточно крупных и нередко равноосных частиц. Форма выделения избыточных фаз может быть пластинчатой, игольчатой или сфероидальной. Структура сплавов, их фазовый состав, а следовательно, и свойства зависят от состава сплава и той обработки, которую он прошел. Ниже будут рассмотрены формирование различных структур сплавов и влияние структуры (фазового состава) на свойства сплавов. При так называемой перетектической кристаллизации образуется смесь из двух фаз, в которой фаза, образующая первоначально, окружена фазой, кристаллизующей позднее. В сплавах нередко образуется структурная составляющая, получившая название эвтектика. Эвтектика состоит из двух и более фаз, имеющих форму пластинок, равномерно чередующихся между собой, которые образуют колонии.
3. Фазы и структура в металлических сплавах Вопросы для самопроверки
Что такое твердый раствор? Какие виды твердых растворов Вы знаете?
Какие условия полной взаимной растворимости двух компонентов?
Какие Вы знаете интерметаллические (металлические ) соединения?
Что такое матричная структура?
Вопросы для самопроверки
Что такое твердый раствор? Какие виды твердых растворов Вы знаете?
Какие условия полной взаимной растворимости двух компонентов?
Какие Вы знаете интерметаллические (металлические ) соединения?
Что такое матричная структура?
Вариант 2 ( о процессе кристаллизации).
При переходе из жидкого состояния в твердое образуются кристаллы; этот процесс называют кристаллизацией. Процесс кристаллизации начинается с зарождения мельчайших кристаллов, называемых зародышами, или центрами кристаллизации. Упорядоченность расположения атомов в жидком металле при температурах, близких к температуре кристаллизации, и наличие наружных поверхностей и поверхностей раздела, образованных примесями, облегчает образование зародышей кристаллов.
Процесс кристаллизации состоит из двух одновременно протекающих процессов: 1) зарождения в жидком металле центров
кристаллизации (образование зародышей) и 2) роста кристаллов из этих центров.
Образование центров кристаллизации и их рост можно видеть на следующей схеме (рис. 4.7). Предположим, что в жидком металле в течение 1 с возникает пять зародышей кристаллов, которые растут с определенной скоростью. К концу второй секунды эти зародыши выросли до некоторых размеров и возникли еще пять новых зародышей кристаллов. Этот процесс кристаллизации продолжается до тех пор, пока не исчерпается вся жидкая фаза металла (см. рис. 4.7). Пока зародыши растут свободно, они имеют геометрически правильную форму и отли-
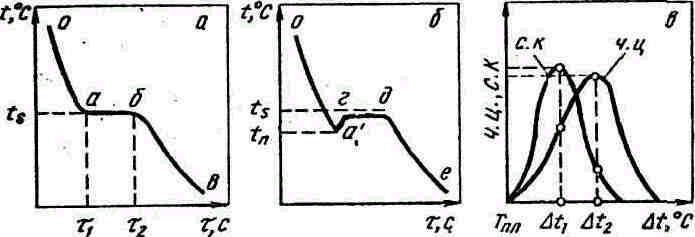
Рис. 4.8. Кривые охлаждения чистого металла при кристаллизации (а, 6) и кривые изменения числа центров (ч. ц) кристаллизации и скорости роста кристаллов (с. к) (в) в зависимости от степени переохлаждении
чаются друг от друга размерами и различной ориентировкой. Когда растущие кристаллы соприкасаются, их правильная форма нарушается. В результате полученные кристаллы металла при правильном внутреннем строении имеют различную внешнюю форму, зависящую от условий кристаллизации.
Процесс кристаллизации жидкого металла графически изображен на рис. 4.8. Охлаждение жидкого металла происходит по линии оа (рис. 4.8, а). При температуре кристаллизации металла ts образуется горизонтальный участок аб, который продолжается от τ1 до τ2 (пока весь жидкий металл не закристаллизуется). При зарождении и росте кристаллов выделяется скрытая теплота кристаллизации, благодаря чему температура сохраняется постоянной. После затвердевания металла процесс его охлаждения на диаграмме отмечен линией бв.
Температуру, при которой происходит какое-либо превращение в металле (например, переход из жидкого состояния в твердое), называют критической температурой, а точки, обозначающие начало и конец этого превращения (а и б), называют критическими точками.
В реальных условиях в процессе кристаллизации жидкий металл обычно переохлаждается, т. е. металл остается жидким
ниже теоретической температуры затвердевания ts, (точка а’ рис. 4.8, б) и процесс кристаллизации начинается при температуре переохлаждения tп. Разность ts,— tп называют степенью переохлаждения Δt ..
Некоторые металлы имеют большую степень переохлаждения (для сурьмы Δt ==41 °С), и при температуре переохлаждения tп процесс кристаллизации начинается бурно, в результате чего температура металла скачкообразно повышается почти до ts. Затем процесс кристаллизации протекает при постоянной температуре (по линии гд), а процесс охлаждения затвердевшего металла по кривой де.
Основными параметрами процесса кристаллизации являются скорость зарождения центров кристадлизации (число центров — ч. ц.) и скорость роста кристаллов (скорость кристаллизации—с. к.). Установлено, что ч. ц. и с. к. определяются степенью переохлаждения (рис. 4.8, в).
Увеличение скорости кристаллизации и числа центров при малых степенях переохлаждения обусловлено тем, что вблизи точки ts подвижность жидкости велика и ускорение кристаллизации вызывается увеличением разности свободных энергий жидкого и кристаллического состояний. Наоборот, снижение скорости кристаллизации и числа центров при больших степенях переохлаждения вызвано тем, что подвижность атомов небольшая, следовательно, уменьшена и способность системы к превращению, так как разность свободных энергий жидкого и кристаллического состояний мала.
Размер образовавшихся кристаллов зависит от соотношения скорости кристаллизации и числа центров. При большом значении скорости кристаллизации и малом числе центров (например, при Δt1, рис. 4.8, в) образуются немногочисленные крупные кристаллы. При малом значении скорости кристаллизации и большом числе центров (при Δt2, рис. 4.8, в) образуется большое число мелких кристаллов.
У некоторых металлов превращения происходят и в твердом состоянии. При таком превращении атомы в кристаллической решетке из одного вида элементарной ячейки перестраиваются в другой. Это явление называют полиморфизмом, или аллотропией, а процесс — полиморфным, или аллотропическим превращением.
.Различные кристаллические формы одного элемента называют полиморфными, или аллотропическими модификациями. Их обозначают греческими буквами α, β, γ и δ, начиная с той формы, которая существует при более низкой температуре.
Превращение одной модификации в другую при охлаждении сопровождается выделением тепла, а при нагреве—поглощением тепла и протекает при постоянной температуре. На кривой охлаждения чистого железа при температурах, отвечающих полиморфным превращениям, можно видеть горизонтальные площадки (рис. 4.9). Полиморфные превращения металлов представляют собой процесс вторичной кристаллизации, или перекристаллизации. Последняя осуществляется аналогично кристаллизации из жидкого состояния.
При охлаждении жидкого железа кристаллизация происходит при 1539°С с образованием о. ц. к. решетки. Высокотемпературную модификацию железа обозначают Feα (иногда Fеδ). Этот переход совершается без переохлаждения, так как для большинства чистых металлов степень переохлаждения незначительна.
Рис. 4.9. Кривая охлаждения чистого железа
Дальнейшее охлаждение до 1392°С характеризуется понижением температуры без каких-либо изменений кристаллической решетки.
При 1392 °С на кривой охлаждения появляется площадка, свидетельствующая о вторичной кристаллизации или полиморфном (аллотропическом) превращении Feα → Feγ. При этом образуется новая модификация железа, имеющая г. ц. к. решетку. Понижение температуры до 911°С вызывает новое аллотропическое превращение Feγ → Feα с образованием новой о. ц. к. решетки. Дальнейшее понижение температуры с 911 °С до комнатной не изменяет тип элементарной кристаллической ячейки. Однако при 768 °С происходит остановка на кривой охлаждения, связанная с изменением магнитных свойств железа. Выше 768°С Feα немагнитно (иногда его обозначают Fеβ), а ниже 768 °С железо ферромагнитно.
Следует отметить, что превращения Feγ → Feα сопровождаются не только перестройкой кристаллической решётки, но и изменением координационного числа К8 ↔ К12 и параметра кристаллической, решетки, что приводит к уменьшению компактности элементарной ячейки. Последнее обусловливает изменение изменение физико-химических свойств металла.
Полиморфное (аллотропическое) превращение, кроме железа, имеют также олово, кобальт, марганец, теллур, титан, цирконий, уран и др.
