
- •Термодинаміка, теплопередача і теплосилові установки.
- •1. Основні вихідні поняття та визначення термодинаміки.
- •2.2 Робоче тіло і термодинамічна система.
- •Основні положення розрахунків суміші ідеальних газів.
- •2. Перший закон термодинаміки.
- •2.1. Внутрішня енергія робочого тіла.
- •2.3. Робота зміни об’єму.
- •2.4. Перший закон термодинаміки.
- •2.6. Ентропія.
- •3. Термодинамічні процеси ідеальних газів
- •3.1. Аналіз рівноважного ізохорного термодинамічного процесу.
- •3.2. Аналіз ізобарного термодинамічного процесу.
- •3.3. Аналіз ізотермічного термодинамічного процесу.
- •3.4. Аналіз адіабатного процесу.
- •3.5. Аналіз політропного процесу.
- •4.1. Оборотні і необоротні термодинамічні процеси.
- •4.2 Прямі і обернені термодинамічні цикли.
- •4.3 Цикл Карно. Теорема Карно.
- •4.4. Другий закон термодинаміки.
- •4.5. Ентропія як теплова характеристика циклу.
- •4.6. Зміна ентропії ізольованої термодинамічної системи.
- •5.1 Поняття стаціонарної і одновимірної течії
- •5.2 Основні рівняння течії газу.
- •1. Рівняння суцільності руху
- •2. Рівняння першого закону термодинаміки для течії або рівняння енергії.
- •5.3. Наявна та технічна роботи течії
- •5.4. Ізоентропійна течія газу
- •5.5. Витікання газу із резервуару необмеженого об’єму
- •5.6.Витікання газу через комбіновані сопла.
- •5.7. Дроселювання
- •6. Стискування газу в компресорі
- •6.1 Призначення, класифікація і сфера застосування компресорів
- •6.2 Термодинамічний аналіз роботи одноступеневого компресора.
- •6.3 Багатоступінчасте стикування газу в компресорі.
- •6.4 Потужність та ккд компресора.
- •7. Цикли двигунів внутрішнього згорання.
- •7.1 Призначення, класифікація і сфера застосування циклів двз.
- •7.2 Аналіз циклу двз із змішаним підведенням теплоти.
- •7.3 Аналіз циклу двз з підведенням теплоти по ізобарі.
- •7.4 Аналіз циклу двз з підведенням теплоти по ізохорі
- •7.5 Порівняння циклів двз
- •8. Цикли газотурбінних двигунів (гтд)
- •8.1 Призначення, класифікація і сфера застосування циклів гтд
- •8.2. Аналіз циклу гтд з підведенням теплоти по ізобарі.
- •8.3 Аналіз циклу гтд з підведенням теплоти по ізохорі (цикл Хемфрі)
- •8.4. Регенерація теплоти як метод підвищення термічного ккд циклів гтд
- •1. Теплопровідність.
- •1.1 Температурне поле, градієнт температури, тепловий потік.
- •1.2 Закон Фур’є
- •1.3 Теплопровідність плоскої стінки
- •1.4. Теплопровідність циліндричної стінки.
- •1.4. Теплопровідність циліндричної стінки.
- •2.1 Природна і вимушена конвекція
- •2.2 Рівняння тепловіддачі Ньютона-Ріхмана.
- •2.3 Диференціальні рівняння теплообміну.
- •2.4 Основи теорії подібності
- •2.5 Критерії подібності конвективного теплообміну
- •2.6 Умови подібності процесів конвективного теплообміну
- •2.7 Тепловіддача (конвекція) при природному русі теплоносія в необмеженому об’ємі.
- •2.8 Тепловіддача при турбулентному русі теплоносія в трубі
- •2.9 Тепловіддача при поперечному обтіканні труби та жмутків труб
- •2.10 Інтенсифікація процесів конвективного теплообміну
- •3. Теплообмін випромінюванням.
- •3.1. Основні визначення променистого теплообміну.
- •3.2 Основні закони випромінювання чорних і сірих тіл
- •3.3 Променистий теплообмін між сірими тілами.
- •4 Теплопередача
- •4.1 Основне рівняння теплопередачі. Коефіцієнт теплопередачі
- •4.2 Теплопередача через плоску одношарову і багатошарову стінки.
- •4.3 Передача теплоти через циліндричну одношарову і багатошарову стінки
- •4.4 Інтенсифікація процесів теплопередачі
- •4.5 Теплова ізоляція
- •5 Теплообмінні апарати.
- •5.1 Призначення класифікація і область використання теплообмінних апаратів
- •5.2 Основи теплового розрахунку теплообмінників
3.3. Аналіз ізотермічного термодинамічного процесу.
Рівноважний термодинамічний
процес, який протікає при незмінній
абсолютній температурі називається
ізотермічним. Отже для
цього процесу
![]() .
Запишемо рівняння Клапейрона для
початкового та кінцевого станів у
процесі
.
Запишемо рівняння Клапейрона для
початкового та кінцевого станів у
процесі
![]() ;
;
![]() .
Прирівнявши одне рівняння до другого
отримаємо рівняння зв’язку між
параметрами в процесі:
.
Прирівнявши одне рівняння до другого
отримаємо рівняння зв’язку між
параметрами в процесі:
![]() або
або
![]() -
закон Бойля-Маріотта.
-
закон Бойля-Маріотта.
Зобразимо ізобарний процес в робочій та тепловій діаграмах стану У всіх діаграмах стану якщо процес іде зліва на право то теплота або робота підводиться і навпаки.
З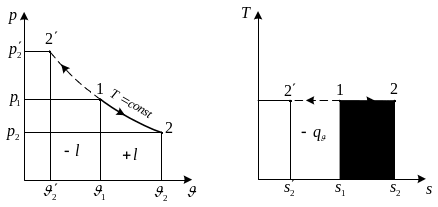 апишемо
перший закон термодинаміки
апишемо
перший закон термодинаміки
![]() оскільки
оскільки
![]() ,
то і
,
то і
![]() тоді
тоді
![]() .
З рівняння слідує що вся теплота іде на
виконання роботи, що є дуже важливим в
теплових машинах.
.
З рівняння слідує що вся теплота іде на
виконання роботи, що є дуже важливим в
теплових машинах.
Теплота та робота ізотермічного
процесу визначається:
![]() або
або
![]()
Зміна внутрішньої енергії
ізотермічного процесу
![]() .
.
Зміна ентальпії ізотермічного
процесу
![]() .
.
Теплоємність буде
![]()
Зміна ентропії ізотермічного
процесу
![]() або
або
![]() .
.
3.4. Аналіз адіабатного процесу.
Рівноважний термодинамічний процес який протікає за умови відсутності теплообміну між робочим тілом та довкіллям називають адіабатним.
І деальний
адіабатний процес – коли відсутній
зовнішній та внутрішній теплообмін.
деальний
адіабатний процес – коли відсутній
зовнішній та внутрішній теплообмін.
![]() - необхідна умова, але не
достатня.
- необхідна умова, але не
достатня.
А от
![]() -
достатня умова адіабатного процесу.
-
достатня умова адіабатного процесу.
Виведемо рівняння адіабатного процесу.
Запишемо рівняння першого закону термодинаміки:
![]() де
де
![]()
де
![]() Оскільки
то
Оскільки
то
![]()
![]() Поділимо одне рівняння на
інше:
Поділимо одне рівняння на
інше:
![]() . Перетворимо рівняння
. Перетворимо рівняння
![]() -
показник адіабати.
-
показник адіабати.
![]()
 .
Про інтегруємо
.
Про інтегруємо
![]() .
Отримаємо
.
Отримаємо
![]() - логарифмічна форма рівняння адіабатного
процесу. А провівши потенціювання
отримаємо
- логарифмічна форма рівняння адіабатного
процесу. А провівши потенціювання
отримаємо
![]() рівняння Пуассона або рівняння адіабатного
процесу.
.
рівняння Пуассона або рівняння адіабатного
процесу.
.
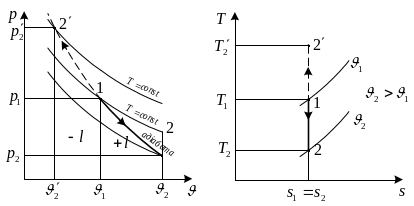
Зобразимо адіабатний процес в робочій та тепловій діаграмах стану.
Теплоємність адіабатного
процесу
![]() .
.
Рівняння зв’язку між змінними
параметрами стану:
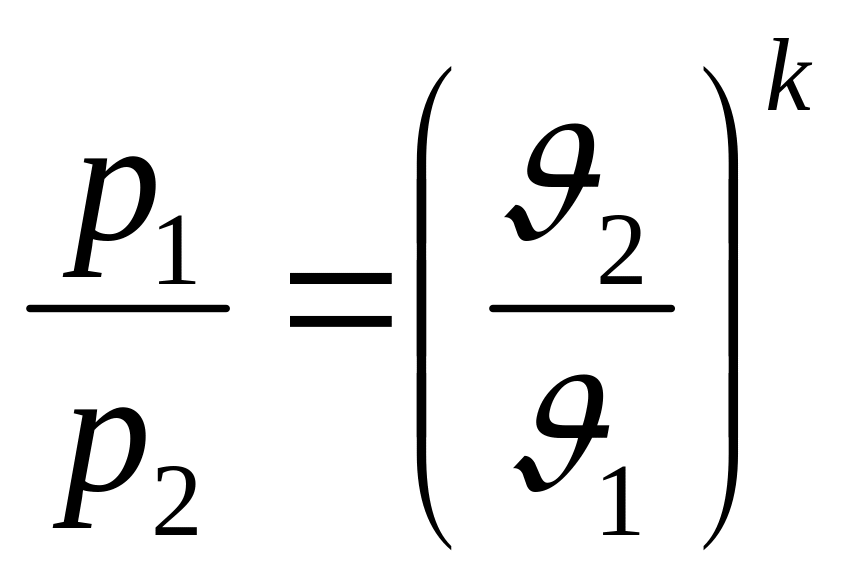 -
-
![]() ;
;
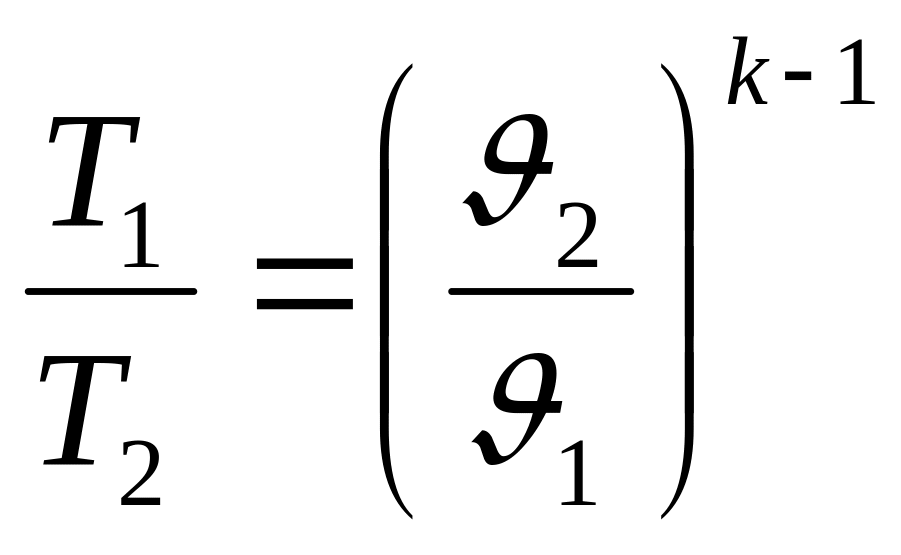 -
-
![]() ;
;
 -
-
![]() .
.
Запишемо перший закон
термодинаміки:
,
оскільки
![]() то
то
![]() .
.
Робота адіабатного процесу:
![]() або
або
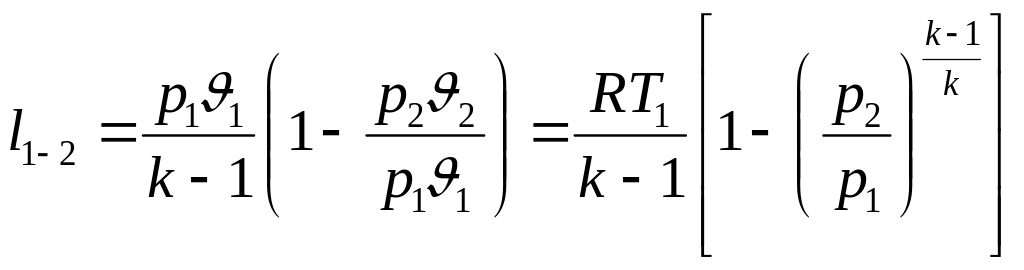 .
.
Зміна внутрішньої енергії ізобарного процесу .
Зміна ентальпії ізобарного процесу .
Оскільки
![]() тому
тому
![]() .
.
3.5. Аналіз політропного процесу.
Рівноважний термодинамічний процес, який протікає за умови незмінної теплоємності робочого тіла протягом всього процесу називається політропним.
![]() - питома масова політропна
теплоємність.
- питома масова політропна
теплоємність.
![]() виходячи з поняття теплоємності
в політропному процесі
виходячи з поняття теплоємності
в політропному процесі
![]() .
.
Тоді
![]()
![]() - розподіл теплоти яка іде на виконання
роботи і на зміну внутрішньої енергії
є величиною незмінною протягом всього
процесу.
- розподіл теплоти яка іде на виконання
роботи і на зміну внутрішньої енергії
є величиною незмінною протягом всього
процесу.
Політропна теплоємність може
бути
![]() - в сімействі політропних процесів.
- в сімействі політропних процесів.
Аналогічно як для адіабатного процесу можна вивести рівняння політропного процесу в логарифмічній формі та .
Величина
,
яка залежить від теплоємності політропного
процесу називається показником політропи
![]() .
Може приймати значення
.
Може приймати значення
![]() .
.
Тоді політропна теплоємність
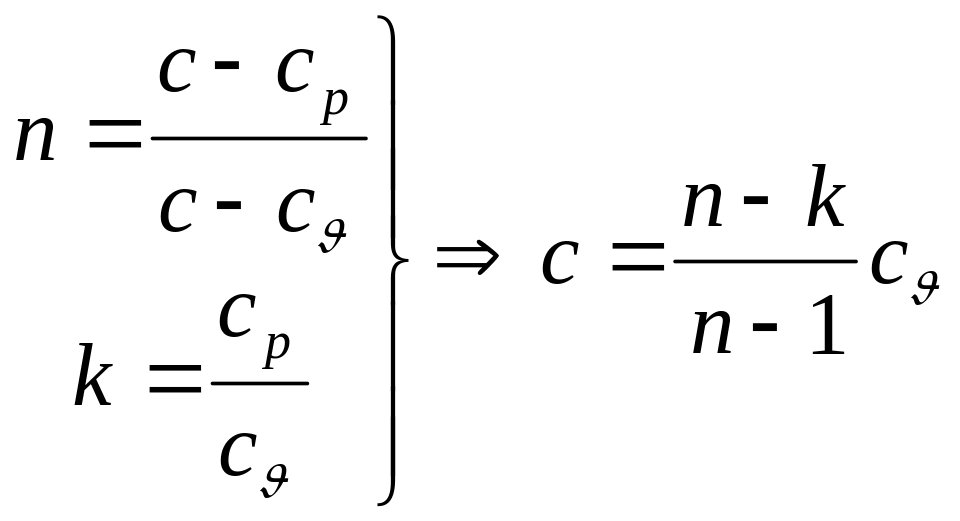 .
.
Теплота політропного процесу
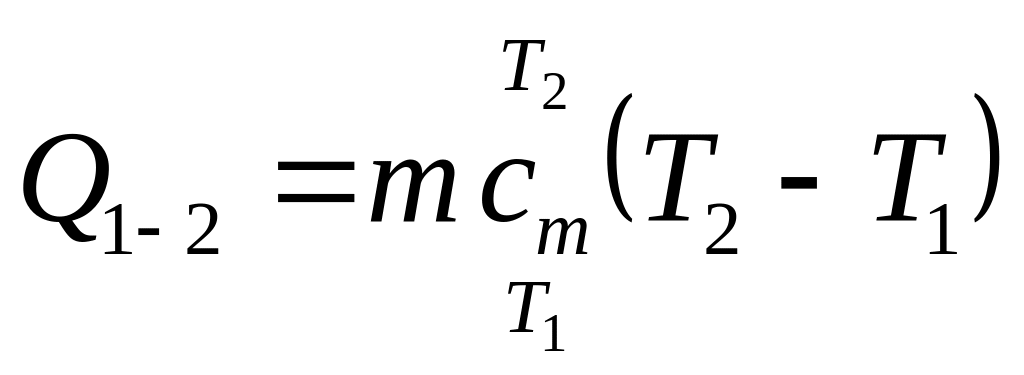 .
Робота політропного процесу
.
Робота політропного процесу
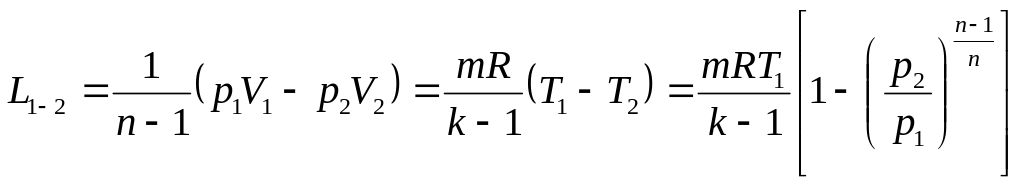 .
.
Зміна ентропії політропного
процесу
![]() .
.
Зміна внутрішньої енергії ізобарного процесу .
Зміна ентальпії ізобарного процесу .
П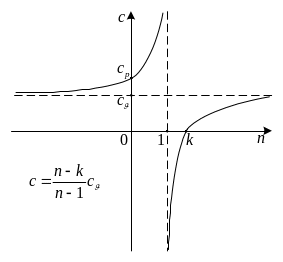 олітропний
процес є узагальнюючим. Легко показати,
що всі розглянути вище процеси – його
похідні випадки.
олітропний
процес є узагальнюючим. Легко показати,
що всі розглянути вище процеси – його
похідні випадки.
Дійсно, рівняння чотирьох основних термодинамічних процесів можна отримати з рівняння політропного процесу при наступних значеннях показника політропи:
![]()
![]() -
ізобарний процес;
-
ізобарний процес;
![]() - ізотермічний процес.
- ізотермічний процес.
![]()
![]() - адіабатний процес.
- адіабатний процес.
![]()
![]() - ізохорний процес.
- ізохорний процес.
Залежність політропної
теплоємності
![]() від показника політропи
.
від показника політропи
.
Енергетичний аналіз (баланс енергії)
1. Якщо політропа розташована вище адіабати, яка розпочинається з тієї ж точки що і політопний процес то теплота в політропному процесі до робочого тіла підводиться, під адіабатою відводиться.
2. Над ізотермою – внутрішня енергія збільшується, під ізотермою – внутрішня енергія зменшується.
З алежність політропної теплоємності від показника політропи .
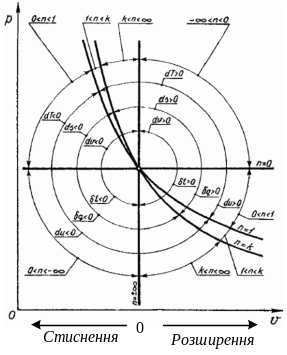
Малювати в наступному порядку:
ізобарний
![]() ,
ізохорний
,
ізотермічний
,
ізохорний
,
ізотермічний
![]() ,
адіабатний
,
адіабатний
![]() .
Отже щоб зобразити процес треба знати
його показник політропи. І відносно
центральної точки – направо процес
розширення (РТ виконує роботу), наліво
– стиснення РТ (робота виконується над
РТ). Приклад
.
Отже щоб зобразити процес треба знати
його показник політропи. І відносно
центральної точки – направо процес
розширення (РТ виконує роботу), наліво
– стиснення РТ (робота виконується над
РТ). Приклад
![]() і процес стискування як виглядає.
Наступний приклад
і процес стискування як виглядає.
Наступний приклад
![]() і процес розширення.
і процес розширення.
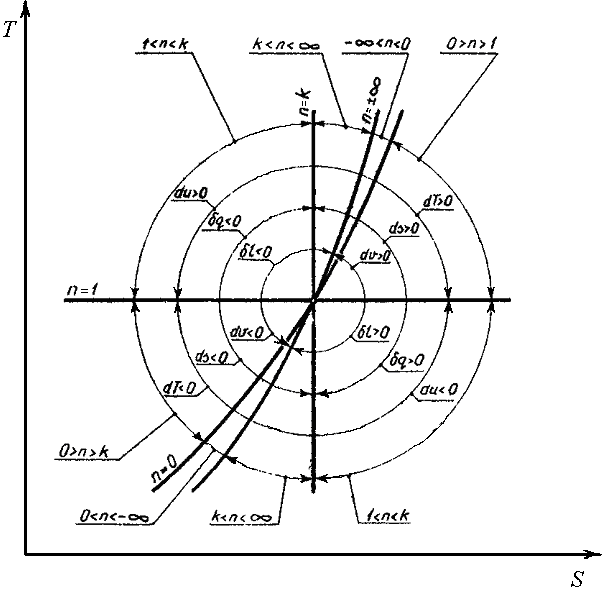
Важливо вміти робити енергетичний аналіз термодинамічного процесу (баланс енергії)
1. Якщо політропа розташована вище адіабати, яка розпочинається з тієї ж точки що і політопний процес то теплота в політропному процесі до робочого тіла підводиться, під адіабатою відводиться.
2. Над ізотермою – внутрішня енергія збільшується, під ізотермою – внутрішня енергія зменшується.
Розділ 4. Другий закон термодинаміки
