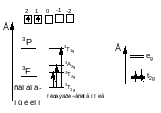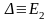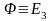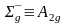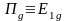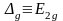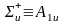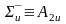- •Многоэлектронный атом
- •Лекция 2
- •2 Приближения
- •Среди состояний с одной двухэлектронной конфигурацией наименьшей энергией обладает состояние с наибольшей мультиплетностью.
- •Среди состояний с одной двухэлектронной конфигурацией и мультиплетностью наименьшей энергией обладает состояние с наибольшим l
- •Лекция 3
- •Строение молекул
- •Атом водорода
- •Лекция 4
- •Лекция 5
Лекция 5
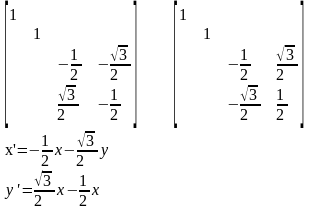
Представление операций симметрии в виде матрицы преобразований

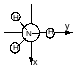
Таблица 1 полное представление и его характеры
-
С3v
E
2С3
3v
Г
4
1
2
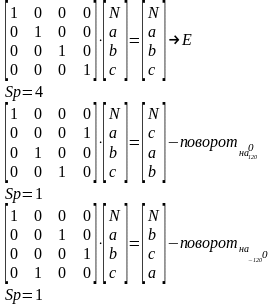
Для того, чтобы преобразование симметрии, выполняемое с любой молекулой характеризовать с помощью конечного числа матриц, необходимо исходные матрицы преобразовать к блочно-диагональному виду. (ненулевые элементы только на диагонали)
Преобразование подобия – математическое преобразование, которое не меняет смысла матрицы, шпура но приводит ее к блочно-диагональному виду.

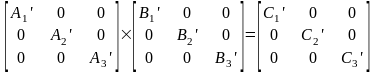
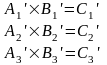
Число подблоков конечно. Полное представление не меняется, шпур также остается прежним.
Непреводимые представления – набор сумм диагональных элементов подматриц, получаемых после исчерпывающего преобразования подобия, выполняемого из исходного состояния матриц операциями симметрии.
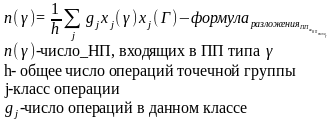
Класс операции – операции одного типа с одним и тем же характером представления

Таблица 2 Таблица характеров (выделены НП)
С3v |
E |
2С3 |
3v |
А1 |
1 |
1 |
1 |
А2 |
1 |
1 |
-1 |
Е |
2 |
-1 |
0 |
Г |
4 |
1 |
2 |
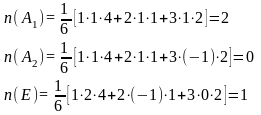
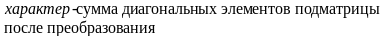

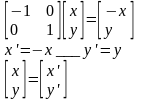
Элементы движения тоже описываются элементами симметрии
Н20: (ось высшего порядка вдоль оси z)
С2v |
E |
C2 |
v(yz) |
v(xz) |
A1 |
1 |
1 |
1 |
1 |
A2 |
1 |
1 |
-1 |
-1 |
B1 |
1 |
-1 |
1 |
-1 |
B2 |
1 |
-1 |
-1 |
1 |


Символы, обозначающие НП
Невырожденное НП, симметричное отклонение главной оси, обозначается А
Невырожденное НП, антисимметричное относительно главной оси, В
2х вырожденное НП – Е
3х вырожденное НП – Т
(4х вырожденное представление – икосаэдр)
Индексы:
1 – симметрично относительно какого-то другого элемента
2 – антисимметрично
Чтобы отличить одноименные НП по отношению к разным элементам симметрии используются индексы 3, 4, 5…
В точечных группах с горизонтальной плоскостью используются индексы ‘ и ‘’
‘ – симметрия относительно горизонтальной плоскости
‘’ – антисимметрия
Где есть центр инверсии ставят индексы g и u:
g – симметрия
u – антисимметрия
Бесконечные точечные группы CV и Dh
CV |
E |
2C |
V |
|
1 |
1 |
1 |
|
1 |
1 |
-1 |
|
2 |
cos |
0 |
|
2 |
cos |
0 |
|
2 |
|
|
….. |
…. |
… |
.. |
Dh |
E |
2C |
i |
2S |
V |
|
1 |
|
|
|
|
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
2 |
|
|
|
|
|
1 |
|
|
|
|
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
2 |
|
|
|
|
Вторая система обозначений связана с для линейных молекул
Лекция 6
Классификация МО по симметрии
В теории МО многоатомная молекула трактуется так же как и многоэлектронный атом, с той разницей, что молекула создает сложнее поле, зависящее от ядер и их геометрии в пространстве
Геометрию ядер можно отнести к точечной группе симметрии, а поскольку электроны движутся по всей молекуле, то и МО можно характеризовать по симметрии.
С2v |
E |
C2 |
v(yz) |
v(xz) |
A1 |
1 |
1 |
1 |
1 |
A2 |
1 |
1 |
-1 |
-1 |
B1 |
1 |
-1 |
1 |
-1 |
B2 |
1 |
-1 |
-1 |
1 |
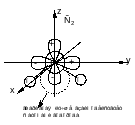
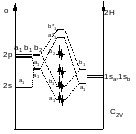
Групповые орбитали – линейная комбинация одноименных орбиталей разных атомов, которая выполняется для построения орбиталей , обладающих симметрией. Это промежуточный этап построения МО.
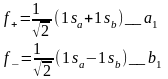
Гибридизация – математический прием, при котором берется линейная комбинация атомных орбиталей одного и того же атома с одинаковой симметрией
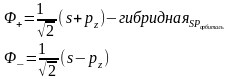
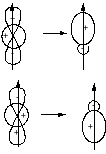
У гибридной орбитали нет собственного значения энергии.
Канонические МО – делокализованы, имеют конкретную энергию, являются решением уравнения Шредингера
Локализованные МО – используются для некоторых целей (для наглядности).
Не обладают симметрией, не имеют конкретной энергии.
Для определения терма
Записать электронную конфигурацию
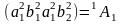
Каждое НП возводим в степень количества электронов и меремножаем
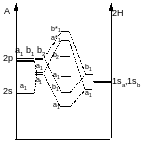
Переносим 1 электрон с верхней b2 на a1:
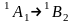
Переносим 1 электрон с верхней b2 на b*1
-
*
b1
1
-1
1
-1
b2
1
-1
-1
1

A2
1
1
-1
-1
С3v |
E |
2С3 |
3v |
|
А1 |
1 |
1 |
1 |
SN PZ |
А2 |
1 |
1 |
-1 |
|
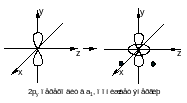
Е |
2 |
-1 |
0 |
(Px, Py) |
-
E
C13
C23
’V
’’V
’’’V
Sa
Sb
Sc
Sa
Sc
Sb
Sb
Sc
Sa
Sc
Sb
Sa
Sc
Sa
Sb
Sb
Sa
Sc
После опраций симметрии берем по очереди характеры и умножаем на результаты проведения опраций симметрии, складываем произведения, отбрасываем коэффициенты, нормируем.

Для построения МО нужен набор независимых функций (ортогональных)
Ортогонализация по Шмидту:

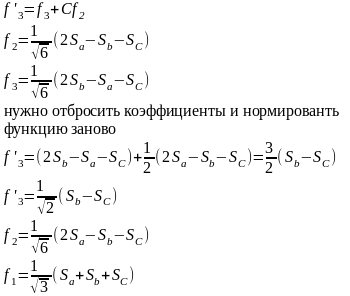
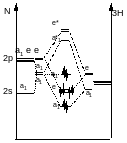

Диаграммы Уолша и геометрия молекул
Диаграммы Уолша показывают изменение относительных орбитальных энергий в зависимости от симметрии молекулы
Молекулы AH2: LiH2+, BeH2, .BH2, :CH2, .NH2, H20
Dh |
E |
2C |
C2 |
i |
2S |
V |
|
1 |
1 |
1 |
1 |
1 |
1 |
|
1 |
1 |
-1 |
1 |
1 |
-1 |
|
2 |
2cos |
0 |
2 |
-2cos |
0 |
|
2 |
2cos2 |
0 |
2 |
2cos2 |
0 |
|
1 |
1 |
1 |
-1 |
-1 |
-1 |

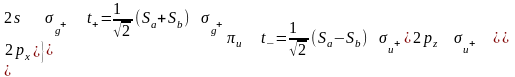
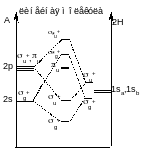
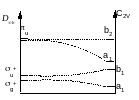
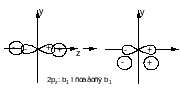
LiH2+ - 2 электрона на нижней a1 – угловая молекула
BeH2 – 4 электрона на 2х нижних +g и +u - линейная
BH2 - угловая
:CH2 – синглетный угловой, триплетный тоже угловой
Дальше молекулы всегда угловые
Лекция 7
Основы теории строения координационных соединений
Теория кристаллического поля (ТКП) (CFT)
Теория поля лигандов (ТПЛ) (LFT)
СFT
взаимодействие между ионом комплексообразователя и лигандами чисто электростатическое
лиганды рассматриваются как точечные отрицательные заряды, расположенные определенным образом и создающие поле определенной симметрии
у иона комплексообразователя взаимодействуют только только d-орбитали,
При взаимодействиях лиганд-комплексообразователь в явном виде участвуют только волновые функции d-орбиталей.
Характерные симметрии комплексов:
октаэдр Оh
тетраэдр Td
плоский квадрат или искаженный октаэдр D4h
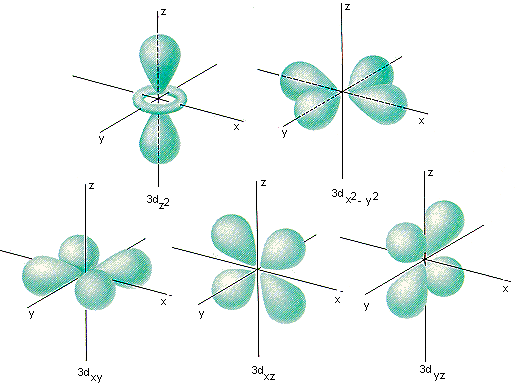
Все d-орбитали четные
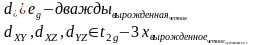
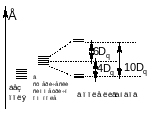
10Dq – энергия расщепления кристаллическим полем d – уровней
Теорема центра тяжести:
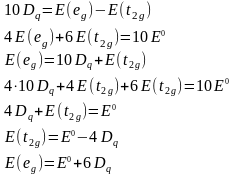
ЭСКП – энергия стабилизации кристаллическим полем (CFSE)
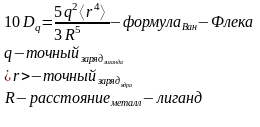
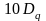 чаще всего определяют из спектров
чаще всего определяют из спектров
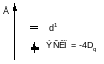
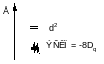
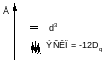
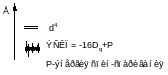
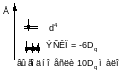
Во всех случаях реализуется конфигурация с более низкой энергией
Комплексы с более чем 3-мя электронами делятся на высокоспиновые и низкоспиновые.
Высокоспиновые = комплексы слабого поля
Низкоспиновые = комплексы сильного поля
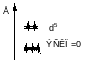
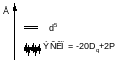
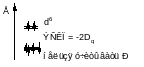
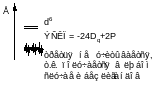
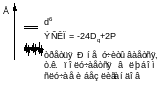
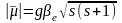 - для чисто спинового магнитного момента
- для чисто спинового магнитного момента
Орбитальный вклад у электронов 1го переходного периода почти отсутствует
Величина зависит от заряда центрального иона и от природы лиганда. ТКП не может это объяснить. (обнаружено в спектрах поглощения)
Оказалось, что лиганды можно расположить в ряд по увеличению
Спектрохимический ряд лигандов:
I-<Br-<SCN-<Cl-<NO3-<F-<OH-<H2O<NH3<Py<En<NO2-<CN-<CO
В NO2-,CN-,CO сильное поле в октаэдрческих комплексах двухзарядных ионов.
Для трехзарядных – до аммиака.
Расщепление состояний ионов переходных элементов в октаэдрическом поле лигандов