
НАРУШЕНИЯ РИТМА И ПРОВОДИМОСТИ
Фибрилля́ция предсе́рдий (ФП, синоним: мерцательная аритмия) — разновидность наджелудочковой тахиаритмии с хаотической электрической активностью предсердий с частотой импульсов 350—700 в минуту, что исключает возможность их координированного сокращения[1]. Это одна из наиболее распространённых аритмий[2]. Часто ФП может быть обнаружена при определении пульса и обнаружении, что сердцебиения происходят с нерегулярным интервалом. Однако окончательный диагноз выставляется по ЭКГ-признакам: отсутствие зубцов P, которые присутствуют при нормальном ритме сердца и характеризуют электрическую активность при сокращении предсердий. Вместо них появляется множество волн f, которые характеризуют фибрилляцию (то есть мерцание, дрожание) предсердий.
Частота сокращений желудочков при мерцательной аритмии зависит от электрофизиологических свойств предсердно-желудочкового узла, уровня активности симпатической и парасимпатической нервной системы, а также действия лекарственных препаратов. Риск возникновения ФП увеличивается с возрастом. Данная аритмия нередко связана с органическими заболеваниями сердца. Нарушение гемодинамики и тромбоэмболические осложнения, связанные с фибрилляцией предсердий, приводят к значительному повышению заболеваемости, смертности и стоимости медицинского обслуживания. Хроническое течение ФП приводит к увеличению риска смерти примерно в 1,5—2 раза[3][4].
]Эпидемиология
Фибрилляция предсердий — одна из самых распространённых аритмий. Этим заболеванием страдают 1—2 % общей популяции, и этот показатель растёт в последние годы[5] и вероятно будет увеличиваться в ближайшие 50 лет в связи со старением населения[6]. Число больных ФП в США оценивают более чем в 2,2 миллиона человек, в странах Европейского союза — 4,5 миллиона[7][8]. По данным фрамингемского исследования, риск развития ФП у мужчин и женщин старше 40 лет составляет 26 и 23 % соответственно[9]. ФП выявляется примерно у 6—24 % пациентов с инсультом[10]. Распространённость ФП также увеличивается с возрастом, составляя около 8 % у пациентов старше 80 лет[11].
[править]Классификация
Формы ФП |
Характеристика |
Впервые выявленная |
впервые возникший эпизод ФП |
Пароксизмальная |
приступ длится не более 7 дней (обычно менее 48 ч) и спонтанно восстанавливается в синусовый ритм |
Персистирующая |
приступ длится более 7 дней |
Длительная персистирующая |
приступ длится более 1 года, но принято решение о восстановлении синусового ритма |
Постоянная |
длительно сохраняющаяся ФП (например, более 1 года), при которой кардиоверсия была неэффективна или не проводилась |
Класс EHRA |
Проявления |
I |
Нет симптомов |
II |
Лёгкие симптомы; обычная жизнедеятельность не нарушена |
III |
Выраженные симптомы; изменена повседневная активность |
IV |
Инвалидизирующие симптомы; нормальная повседневная активность невозможна |
Фибрилляция предсердий связана с различными сердечно-сосудистыми заболеваниями, которые способствуют развитию и поддержанию аритмии. К ним относятся[9]:
Артериальная гипертензия;
Сердечная недостаточность II—IV функционального класса по NYHA;
Приобретённые пороки (чаще митральные) клапанов сердца;
Врождённые пороки сердца (дефект межпредсердной перегородки, единственный желудочек, операция Мастарда при транспозиции крупных артерий, операция Фонтейна);
Кардиомиопатии (особенно дилатационная);
Ишемическая болезнь сердца — встречается у 20 % больных с ФП;
Воспаление (перикардит, миокардит);
Опухоль сердца (миксома, ангиосаркома).
Около 30—45 % случаев пароксизмальной ФП и 20—25 % случаев персистирующей ФП возникают у молодых лиц без патологии сердца (изолированная форма ФП)[15].
Также существуют факторы риска, не связанные с патологией сердца. К ним относят гипертиреоидизм, ожирение, сахарный диабет, ХОБЛ, апноэ во сне, хроническая болезнь почек[8][16][17]. Наличие ФП у близких родственников пациента в анамнезе может увеличить риск развития ФП[18]. Исследование более чем 2200 пациентов с ФП показало, что 30 % из них имеют родителей с ФП[19]. Различные генетические мутации могут быть ответственны за развитие ФП[20][21].
ФП также может развиваться при чрезмерном употреблении алкоголя (синдром праздничного сердца), хирургической операции на сердце, ударе электрического тока. При таких состояниях лечение основного заболевания часто приводит к нормализации ритма
Патогенез
Схема проведения импульсов |
||
Синусовый ритм
|
Фибрилляция предсердий
|
|
Существует множество гипотез механизмов развития ФП, но наиболее распространены теория очаговых механизмов и гипотеза множественных мелких волн[23]. Причём эти механизмы могут сочетаться друг с другом. Очаговые механизмы включают в себя триггернуюактивность и циркуляцию возбуждения по типу микрореентри (microreentry). Согласно данной теории, ФП возникает в результате поступления множества импульсов из автономных очагов, которые чаще всего расположены в устьях лёгочных вен или по задней стенке левого предсердия около соединения с лёгочной веной. Ткани в этих зонах обладают более коротким рефрактерным периодом, что приближает их по свойствам к клеткам синусового узла. По мере прогрессирования пароксизмальной формы в постоянную очаги повышенной активности распределяются по всем предсердиям. Согласно гипотезе множественных мелких волн, ФП сохраняется в результате хаотичного проведения множества независимых мелких волн[24].
Изменения в предсердиях происходят и после развития ФП. При этом укорачивается рефрактерный период предсердий за счёт подавления тока ионов кальция через каналы L-типа и усиления поступления ионов калия в клетки. Также снижается сократительная функция предсердий вследствие замедления поступления ионов кальция в клетки, нарушения выделения ионов кальция из внутриклеточных депо и нарушения обмена энергии в миофибриллах. Замедляется кровоток в предсердиях из-за нарушения их сокращения, что приводит к образованиютромбов преимущественно в ушке левого предсердия
[25]Клиническая картина
В зависимости от выраженности гемодинамических нарушений клиническая картина варьирует от бессимптомного течения до тяжёлых проявлений сердечной недостаточности. При пароксизмальной форме эпизоды фибрилляции предсердий иногда протекают бессимптомно[26]. Но обычно больные ощущают учащённое сердцебиение, дискомфорт или боли в грудной клетке. Также возникает сердечная недостаточность, которая проявляется слабостью, головокружением, одышкой или даже предобморочными состояниями и обмороками. Приступ ФП может сопровождаться учащённым мочеиспусканием, что обусловлено повышенной выработкойпредсердного натрийуретического пептида[27].
Пульс аритмичный, может возникать дефицит пульса (ЧСС на верхушке сердца больше, чем на запястье) вследствие того, что при частом желудочковом ритме ударный объём левого желудочка недостаточен для создания периферической венозной волны. У пациентов с бессимптомной ФП или с минимальными проявлениями ФП тромбоэмболия (чаще в виде инсульта) может стать первым проявлением заболевания
[13][22]Диагностика
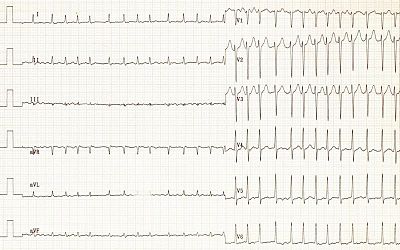
![]()
ЭКГ при фибрилляции предсердий: нет зубцов P, нерегулярные интервалы RR, мелкие волны f
При наличии характерных жалоб собирают анамнез заболевания с целью определения его клинической формы (например, выясняют начало первого приступа или дату обнаружения), причины и факторов риска, эффективности антиаритмических препаратов для данного больного при предыдущих приступах[27].
Для диагностики ФП применяют стандартную ЭКГ в 12 отведениях. При этом обнаруживают следующие ЭКГ-признаки: отсутствие зубцов P, волны фибрилляции f с разной амплитудой и формой, абсолютно неодинаковые интервалы RR (комплексы QRS обычно не изменены)[1]. Также по ЭКГ определяют ассоциированную патологию сердца (инфаркта миокарда в прошлом, других аритмий и др.)[27]. При подозрении пароксизмальной формы и отсутствии ЭКГ во время приступа проводят холтеровское мониторирование[23].
Кроме того, выполняют эхокардиографию для выявления органической патологии сердца (например, патологии клапанов), размеров предсердий. Также этим методом определяют тромбы в ушках предсердий, однако для этого чреспищеводная Эхо-КГ информативнее трансторакальной[25]. При впервые выявленной ФП, трудности контроля ритма желудочков или неожиданном рецидиве после кардиоверсии оценивают функцию щитовидной железы(уровень тиреотропного гормона в сыворотке крови)[22][27].
Осложнения
В норме сокращения предсердий способствуют наполнению желудочков кровью, что нарушается при ФП. Это не отражается на сердце без другой патологии, но у больных с уже сниженным объёмом наполнения желудочков сердечный выброс недостаточен. Поэтому заболевание может осложняться острой сердечной недостаточностью[28].
При фибрилляции предсердий в левом предсердии образуются тромбы, которые могут с током крови попадать в сосуды головного мозга, вызывая ишемический инсульт. Частота развития данного осложнения у пациентов с фибрилляцией предсердий неревматической этиологии в среднем составляет 6 % в год
[28]Лечение
В лечении ФП существует 2 типа стратегий:
Стратегия контроля ритма — с помощью кардиоверсии восстанавливают нормальный синусовый ритм и затем проводят профилактику рецидивов;
Стратегия контроля ЧСС — сохранение ФП с лекарственным урежением частоты сокращений желудочков.
Также для профилактики тромбоэмболий проводят антикоагулянтную терапию[28].
Антикоагулянтная терапия
Антикоагулянтная терапия необходима для профилактики самого грозного осложнения ФП — тромбоэмболии. С этой целью применяют пероральные непрямые антикоагулянты (как правило, варфарин) или ацетилсалициловую кислоту (или клопидогрел). Показания для антикоагуляции и выбор препарата определяются риском тромбоэмболии, который рассчитывают по шкалам CHADS2или CHA2DS2-VASc[23]. Если сумма баллов по шкале CHADS2 ≥ 2, то при отсутствии противопоказаний показана длительная терапия пероральными антикоагулянтами (например, варфарином с поддержанием МНО 2-3). Если сумма баллов по шкале CHADS2 0—1, рекомендуют более точно оценить риск тромбоэмболии по шкале CHA2DS2-VASc[29]. При этом, если ≥ 2 баллов, — назначают пероральные непрямые антикоагулянты, 1 балл — пероральные непрямые антикоагулянты (предпочтительно) или ацетилсалициловую кислоту 75—325 мг в сутки, 0 баллов — антикоагулянтная терапия не требуется (предпочтительно) либо ацетилсалициловая кислота в той же дозе.
Однако антикоагулянтная терапия опасна кровотечениями. Для оценки риска данного осложнения разработана шкала HAS-BLED[30]. Сумма баллов ≥ 3 указывает на высокий риск кровотечения, и применение любого антитромботического препарата требует особой осторожности[31].
Стратегия контроля ритма
Восстановление синусового ритма осуществляют с помощью электрического разряда (электрическая кардиоверсия) или антиаритмических препаратов (фармакологическая кардиоверсия)[28]. Предварительно при тахисистолической форме урежают ЧСС до примерно 80—100 в минуту пероральным приёмом β-адреноблокаторов (метопролол) или недигидропиридоновых антагонистов кальция (верапамил). Известно, что кардиоверсия повышает риск тромбоэмболии. Поэтому перед плановой кардиоверсией, если ФП длится более 48 часов или продолжительность неизвестна, обязательно проводят антикоагулянтную терапию варфарином в течение трёх недель и в течение четырёх недель после процедуры[32]. Неотложную кардиоверсию проводят, если ФП длится менее 48 часов или сопровождается тяжёлыми гемодинамическими нарушениями (гипотония, декомпенсациясердечной недостаточности), лишь под прикрытием нефракционированного или низкомолекулярного гепарина[25].
Электрическая кардиоверсия
Электрическая кардиоверсия эффективнее фармакологической, однако болезненна и поэтому требует введения седативных препаратов (например, пропофол, мидазолам) или поверхностной общей анестезии. В современных кардиовертерах-дефибрилляторах разряд автоматически синхронизируется с зубцом R, чтобы не допустить электрической стимуляции в фазе желудочковой реполяризации, что может спровоцировать фибрилляцию желудочков. При двухфазном разряде начинают со 100 Дж, при необходимости силу каждого следующего разряда повышают на 50 Дж. Однофазный разряд требует в 2 раза больше энергии, то есть начинают с 200 Дж, с последующим увеличением на 100 Дж, пока не будет достигнут максимальный уровень 400 Дж. Таким образом, двухфазный импульс имеет преимущества, так как эффект достигается при меньшей энергии[28].
Фармакологическая кардиоверсия
Для фармакологической кардиоверсии применяют антиаритмические препараты IA, IC и III классов. К ним относят прокаинамид, амиодарон, пропафенон, нитрофенилдиэтиламинопентилбензамид (нибентан)[25].
Прокаинамид выпускают в ампулах по 5 мл, содержащих 500 мг препарата (1 % раствор). Его вводят струйно или капельно в дозе 500—1000 мг однократно внутривенно медленно (в течение 8—10 мин или 20—30 мг/мин). В Европейских рекомендациях 2010 года исключён из списка препаратов для кардиоверсии. Однако в Российской Федерации благодаря невысокой стоимости он весьма распространён. К побочным эффектам прокаинамида относят артериальную гипотензию, слабость, головную боль, головокружение, диспепсию, депрессию, бессоницу, галлюцинации, агранулоцитоз, эозинофилию, волчаночноподобный синдром[23][25].
Пропафенон выпускают в ампулах по 10 мл, содержащих 35 мг препарата, и в таблетках по 150 и 300 мг. Вводят в дозе 2 мг/кг внутривенно в течение 10 мин (ожидаемый эффект от 30 мин до 2 ч) или перорально в дозе 450—600 мг (ожидаемый эффект через 2—6 ч). Препарат малоэффективен при персистирующей форме ФП и трепетании предсердий. Не следует использовать у пациентов со сниженной сократительной способностью левого желудочка и ишемией миокарда. Вследствие наличия слабого β-блокирующего действия противопоказан пациентам с выраженной ХОБЛ[33].
Амиодарон выпускают в ампулах по 3 мл, содержащих 150 мг препарата (2 % раствор). Его вводят внутривенно струйно в дозе 5 мг/кг в течение 15 мин, затем продолжают капельно в дозе 50 мг/ч в течение 24 ч. Восстанавливает синусовый ритм медленно, его максимальный эффект — через 2—6 часов. Амиодарон рекомендуют использовать у пациентов с органическими заболеваниями сердца[33].
Нибентан выпускают в ампулах по 2 мл, содержащих 20 мг препарата (1 % раствор). Вводят внутривенно в дозе 0,065—0,125 мг/кг в течение 3—5 минут. При отсутствии эффекта — повторные инфузии в той же дозе с интервалом 15 мин (до максимальной дозы 0,25 мг/кг). Его применение допускается только в палатах интенсивной терапии с мониторированием ЭКГ в течение 24 часов после введения, так как возможно развитие проаритмических эффектов в виде полиморфной желудочковой тахикардии типа «пируэт», а также удлинение интервала QT с появлением зубца U[25
]Длительный контроль ритма
С целью предупреждения рецидивов ФП в некоторых случаях назначают антиаритмические препараты на длительный срок. Однако их эффективность для контроля синусового ритма невысока, а побочные эффекты весьма опасные, поэтому выбор конкретного препарата определяется его безопасностью[23][34]. Для этого применяют амиодарон, соталол, диэтиламинопропионилэтоксикарбониламинофенотиазин (этацизин), дронедарон,лаппаконитина гидробромид (аллапинин), морацизин (этмозин), пропафенон[25].
Стратегия контроля частоты сердечных сокращений
При выборе стратегии контроля частоты сердечных сокращений попытки восстановить нормальный ритм сердца не предпринимают. Вместо этого используют различные группы препаратов, способные уменьшать ЧСС: бета-блокаторы (метопролол, карведилол и др.), недигидропиридиновые блокаторы кальциевых каналов (верапамил и дилтиазем), дигоксин[35]. При их неэффективности возможно назначение амиодарона или дронедарона. Контроль ЧСС позволяет уменьшить выраженность симптомов аритмии, однако не останавливает процесс прогрессирования заболевания[23].
Целью данной стратегии является удержание ЧСС в покое <110 в мин. В случае выраженных симптомов заболевания возможен более жёсткий контроль — ЧСС в покое <80 в мин и <110 при умеренной физической нагрузке[23]
Катетерная абляция
При неэффективности вышеописанных методов лечения иногда применяют катетерную абляцию[13]. С целью восстановления и поддержания синусового ритма проводят радиочастотную абляцию. При этом выполняют электрическую изоляцию триггерных участков из устьев лёгочных вен от окружающей ткани левого предсердия. Также существует метод абляции атриовентрикулярного узла: радиочастотным током разрушают АВ-узел или пучок Гиса, вызывая полную поперечную блокаду. Затем имплантируют искусственный водитель ритма, который «навязывает» сердечный ритм, близкий по характеристикам к нормальному. Это паллиативное вмешательство, которое улучшает качество жизни больного, но на смертность не влияет[23].
Прогноз
Прогноз определяется в первую очередь тяжестью патологии сердца, лежащей в основе ФП. Риск развития ишемического инсульта, связанный с ФП, составляет 1,5 % у лиц 50—59 лет и 23,5 % у лиц 80—89 лет[13] или в среднем 5 % в год[27]. Таким образом, фибрилляция предсердий увеличивает риск развития инсульта примерно в 5 раз и в 2 раза риск смерти[36]. Каждый шестой инсульт происходит у больного ФП. При развитии ФП у лиц с ревматическими пороками сердца риск инсульта возрастает в 5 раз по сравнению с больными с неклапанной ФП и в 17 раз по сравнению с лицами без ФП[13].
!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
Экстрасистолия — несвоевременная деполяризация и сокращение сердца или отдельных его камер
Классификация
Монотопные экстрасистолы — один источник возникновения, постоянный интервал сцепления в одном и том же отведении ЭКГ (даже при разной продолжительности комплекса QRS)
Политопные экстрасистолы — из нескольких эктопических очагов, различные интервалы сцепления в одном и том же отведении ЭКГ (различия составляют более 0,02—0,04 с), разные отличающиеся друг от друга по форме экстрасистолические комплексы.
Неустойчивая пароксизмальная тахикардия — три и более следующих друг за другом экстрасистол (ранее обозначались как групповые, или залповые, экстрасистолы). Так же как и политопные экстрасистолы, свидетельствуют о выраженной электрической нестабильности миокарда.
Этиология
Функционального характера: различные вегетативные реакции, эмоциональное напряжение, курение, злоупотребление крепким чаем, кофе, алкоголем.
Органического происхождения: их появление свидетельствует о достаточно глубоких изменениях в сердечной мышце в виде очагов ишемии, дистрофии, некроза или кардиосклероза, способствующие формированию электрической негомогенности сердечной мышцы. Чаще всего экстрасистолия наблюдается при остром инфаркте миокарда, ишемической болезни сердца, артериальной гипертензии, ревматических пороках сердца, миокардитах, хронической сердечной недостаточности. Различные варианты стойкой желудочковой аллоритмии — бигеминии, тригеминии — характерны для передозировки сердечными гликозидами
Клиническая картина
Проявления обычно отсутствуют, особенно при органическом происхождении экстрасистол. Жалобы на толчки и сильные удары сердца, обусловленные энергичной систолой желудочков после компенсаторной паузы, чувство замирания в груди, ощущение остановившегося сердца. Симптомы невроза и дисфункции вегетативной нервной системы (более характерны для экстрасистол функционального происхождения): тревога, бледность,потливость, страх, чувство нехватки воздуха. Частые (особенно ранние и групповые) экстрасистолы приводят к снижению сердечного выброса, уменьшению мозгового, коронарного и почечного кровотока на 8—25 %. При стенозирующем атеросклерозе церебральных и коронарных сосудов могут возникать преходящие нарушения мозгового кровообращения (парезы, афазия, обмороки), приступы стенокардии.
Лечение
Устранение провоцирующих факторов, лечение основного заболевания. Единичные экстрасистолы без клинических проявлений не корригируют. Лечение нейрогенных экстрасистол, соблюдение режима труда и отдыха, диетические рекомендации, регулярные занятия спортом, психотерапия, транквилизаторы или седативные средства (например, диазепам, настойка валерианы).
Показания к лечению специфическими противоаритмическими препаратами: выраженные субъективные ощущения (перебои, чувство замирания сердца и др.), нарушения сна, экстрасистолическая аллоритмия, ранние желудочковые экстрасистолы, наслаивающиеся на зубец Т предыдущего сердечного цикла, частые одиночные экстрасистолы (более 5 в мин.), групповые и политопные экстрасистолы, экстрасистолы в остром периоде ИМ, а также у пациентов с постинфарктным кардиосклерозом. Желудочковая экстрасистолия 1—2 градации по Лауну обычно не требует лечения. 3 градация также может быть оставлена без назначения специальных антиаритмиков при отсутствии органического поражения миокарда. 4 градация требует назначения антиаритмических препатаров 3 группы (амиодарон, соталол), 4 и 5 градации как правило требуют установки дефибриллятора-кардиовертера из-за высокого риска развития желудочковой тахикардии или фибрилляции желудочков.
!!!!!!!!!!!!
Блокада ножек пучка Гиса
Исходя из строения ветвей пучка Гиса различают однопучковые, двухпучковые и трехпучковые блокады. При любом виде однопучковой блокады комплекс QRS расширен незначительно, его ширина остаётся в пределах верхней границы нормы или слегка увеличивается (0,08 — 0,11 сек.) При полной блокаде правой ножки Гиса, однако, он может быть расширен до 0,12 сек. и более.


