
- •Концепция необратимости и термодинамика
- •5.1 Основные понятия и определения
- •5.2 Первый закон термодинамики
- •5.3 Основные термодинамические процессы идеальных газов
- •5.4 Второй закон термодинамики
- •5.5 Энтропия в обратимых и необратимых процессах
- •5.6 Упорядоченность и хаос в природе
- •5.7 Самоорганизация в открытых системах
- •5.8 Примеры
5.7 Самоорганизация в открытых системах
Область науки, исследующая самоорганизацию в сложных открытых неравновесных системах, называется синергетикой(от греч. syn - вместе; crqta - работа). Синергетика трактует процесс возникновения порядка из хаоса как результат самоорганизации материи на основе случайного поиска. Этот процесс составляет сущность эволюции Вселенной. Как объясняется данный процесс современной наукой (синергетикой)?
1. Для этого система должна быть открытой, потому что закрытая, изолированная система в соответствии со вторым законом термодинамики в конечном итоге должна прийти в состояние, характеризуемое максимальным беспорядком или дезорганизацией.
2. Открытая система (неизолированная, не имеющая постоянной энергии) должна находиться достаточно далеко от точки термодинамического равновесия. Если система находится в точке равновесия (т.е. Т1 = Т2), то она обладаетмаксимальной энтропиейи поэтому не способна к какой - либо организации. Если же система расположена вблизи или не далеко от точки равновесия, то со временем она приблизится к ней и в конце концов придет в состояние полной дезорганизации. Например, кусок льда, помещенный в морозильник холодильника, где температуры льда и среды камеры, окружающей лед, равны, будет длительное время оставаться твердым телом. Если же тот же кусок льда поместить в нижнюю часть холодильника, где температуры окружающей среды и льда не одинаковы, то лед, растаяв, превратится в жидкость, а потом - в газ (пар). Таким образом, имеет место процесс перехода от порядка к беспорядку, от организации структуры льда к самоорганизации газа.
3. Отклонения в изолированных системах (флуктуации) подавляют и ликвидируются самими системами. Однако в открытых системах благодаря усилению неравновестности эти отклонения со временем возрастают и в конце концов приводят к “расшатыванию” прежнего порядка и возникновению нового порядка. Таким образом, появление нового в мире всегда связано с действием случайных факторов.
4. Для понимания самоорганизации следует обратиться к принципу положительной обратной связи, согласно которому изменения, появляющиеся в системе, не устраняются, а усиливаются, что приводит в конце концов к возникновению нового порядка и структуры.
5. Самоорганизация может начаться лишь в системах, обладающих достаточным количеством взаимодействующих между собой элементов и, следовательно, имеющих некоторые критические размеры. В противном случае эффекты от взаимодействия будут недостаточны для появления коллективного поведения элементов системы и тем самым возникновения самоорганизации.
5.8 Примеры
ПРИМЕР 1. 1 кг. воздуха (R= 287 Дж/кг К; ср= 996 Дж/кг К; сv= 708 Дж/кг К, к = 1,4), имеющего начальные параметры р1= 100 кПа и Т = 473 К, снижает свое давление до р2= 50 кПа, а) изохорно, v=cоnst; б) изотермически, Т=cоnst; в) адиабатно, dq = 0; q=0.
Определить для всех случаев конечные параметры воздуха, а также тепло, работу, изменение внутренней энергии.
РЕШЕНИЕ
а) процесс Т=cоnst:
1. Определить удельный объем газа в т.1.

Рис. 5.16. К решению примера 1
![]()
![]()
2. Определить температуру в т.2.
![]()
3. Определить
![]()
4. Определить внутреннюю энергию газа
![]() ;
;
б) процесс T=const:
1. Определить удельный объем газа в т.2
![]() ;
;
2. Определить теплоту, поступающую к газу q=2,3RTlg
![]()
3. Определить внутреннюю энергию газа
![]()
4. Определить работу, совершаемую газом
![]()
в) Процесс q=0; dq=0:
1. Определить удельный объем в т.2

2. Определить температуру в т.2.
![]()
3.Определить изменение внутренней энергии газа
U=

или

Сравнение количественных характеристик процессов.
Таблица 5.1.
|
Процесс |
Величины | |||||
|
|
v2,м3/кг |
Т2, К |
q , кДж/кг |
?v, ??ж/кг |
L, кДж/кг |
?i, ??ж/кг |
|
dv |
1?356 |
236 |
-167,442 |
-167,442 |
0 |
-235?554 |
|
dT |
2,712 |
473 |
93,989 |
0 |
93,989 |
0 |
|
dq |
2,218 |
386 |
0 |
60,523 |
60,523 |
-86,652 |
ПРИМЕР 2. 1 кг. воздуха, имеющего начальные
параметры
![]() расширяется
до двойного объема (
расширяется
до двойного объема (![]() ;
;![]() ):
):
а) изобарно, p=const; б) изотермически, T= const; в) адиабатно,
q = 0; dq = 0
Определить для всех случаев конечные
параметры воздуха и члены уравнений
тепла (величины
![]() взять
из примера 1)
взять
из примера 1)
РЕШЕНИЕ
а) процесс p=const;
1. Определить температуру в т. 2.

2. определить теплоту, поступающую к газу
q=cp T=996(946-473)=471,1 кДж/кг
3. Определить изменение внутренней энтропии газа
U= cv T=708(946-473)=334,88 кДж/кг
4. Определить работу в данном процессе
l = q - u = 471,1 - 334,88 = 136,22 кДж/ кг; Определить изменение энтальпииi = cp T = 996(946 - 473) = 471,11кДж/кг.
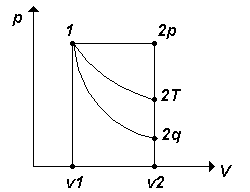
Рис. 5.17. К решению примера 2
б) процесс T = const:Этот процесс полностью совпадает с процессомT = const предыдущего примера.
в) процесс q = 0; dq = 0:
1.Определить давление в точке 2
p2 = p1( v1 / v2)k = 105( 1,357/2,714)1,41= 3,76104Па;
2.Определить температуру в точке 2
T2 = p2 v2 / R = 3,76104 2,714 / 287 = 335,5К;
3.Определить изменение внутренней энергии газа
u = сv T = 708(335,5 - 473) = - 97,35 кДж/ кг ;
4.Определить работу процесса l = - u = 97,35кДж/ кг ;
5. Определить энтальпию ( ее изменение в процессе)
i = cp T = 996(335,5 - 473) = - 136,95кДж/ кг.
Сравнительные количественные характеристики процессов.
Таблица 5.2.
|
Процесс |
Величины | ||||||
|
|
p2,Па |
T2,К |
q, кДж/ кг |
u,кДж/ кг |
l,кДж/ кг |
q,кДж/ кг | |
|
dp=0 |
105 |
946 |
471,11 |
334,88 |
136,22 |
471,11 | |
|
dT=0 |
10105 |
473 |
939,89 |
0 |
939,89 |
0 | |
|
dq=0 |
3,76104 |
335,5 |
0 |
- 97,35 |
97,35 |
- 136,95 | |
ПРИМЕР 3. При исходных данных, указанных в примере 1, определить конечные параметры воздуха, а также тепло, работу и изменение внутренней энергии при расширении газа в абсолютный вакуум.
Расширение газа в абсолютный вакуум является процессом необратимым. Поскольку при адиабатном процессе, согласно условию, D q=0,то: работа газа в процессеl = 0; внешний теплообмен q=0, значит, и изменение внутренней энергииu = 0; При условии, что воздух идеальный газ, тоdT =0; Посколькуu = сv T= 0, тоT2 = T1 = 473K; Давление в точке 2 определится, какp2 = R T2 / v2 = 287 473 / 2,718 = 104 Па, т.е. параметры воздуха таковы, какими они были при T=const.
ПРИМЕР 4. Определить термический КПД цикла 1-2-3 (рис.5.18);
p1 = p2 =12 104 Па; Т1 = 293К;v2 = v3 = v1 ;процесс 3-1 - адиабатный; рабочее тело - воздух( R = 287 Дж/кг К, сv = 708 Дж/кг К.).
РЕШЕНИЕ:

Рис.5.18. К решению примера 4
1. Определить удельный объем в точке 1
v1= T1R/p1= 287293/12104= 0,7м3/ кг .
2. Определить удельный объем в точке 2 v1= v2= 3v3=30,7 = 2,1 м3/кг.
3. Определить температуру газа в точке 2 Т2= Т1v1/v2 = 293 2,1/0,7 = 897К.
Для адиабаты 3-1 имеем p1v1k= p3v3k, откуда
р3= р1(v1/v3)к= 12104(1/3)1,4= 2,25104Па.
Т3= р3v3/R =2,52104 2,1/287 = 184К.
4. Определить подводимое тепло (процесс 1-2)
q1=cp(T2-T1) = 996 (879-293) = 583,66 кДж/кг.
5. Определить отводимое тепло (процесс 2-3)
q2 = cv (T3-T4) =708 (184-179) = - 492,06 кДж/кг.
6. Определить термический КПД
t = q1-q2/q1 = 583,66-492,06/583,66 = 0,175
ПРИМЕР 5. Найти холодильный коэффициент цикла 1-2-3 (рис 5.18);
р1=8104Па ; Т1 = Т3= 293 К; v2= v3=2,5v1; рабочее тело-воздух (данные из примера 3.).
РЕШЕНИЕ: 1. Определить давление газа в точке 3 (процесс Т=const)
p3 = p1v1/v3 = 8 1041/2,5 = 3,2 104 Па
2. Определить давление в точке 2 (адиабаты 1-2) p1v1k = p1v2k, откуда p2 = p1(v1/v2)=8 1041/2,5 = 2,2 104 Па;
4, Определить теплоту, отводимую от нижних источников (процесс 2-3)
q2 =cv(T3-T2) =708(293-201) = 63,72кДж/кг/
5. Определить теплоту, проводимую к верхним источникам (процесс 3-1)
q1 = 2,3RTlgv1/v3 = 2,3 287 lq2,5 =-76,97кДж/кг.
6.Определить работу цикла 1-2-3-1
l =q1- q2 = -76,97+63,72 = -13,25кДж/кг.
7. Определить холодильный коэффициент = q2 / l = 63,72/13,25 = 4,8.
Таблица 5.3
|
Название газа |
Хим. форм. |
Масса, ,г/моль |
Газовая постоянная R,Дж/кгК |
Удельная теплоемк. ср,Дж/кгК |
Удельная теплоемк. сv,Дж/кгК |
Коэфф. Адиабаты, к |
|
1. Воздух |
- |
28,96 |
287 |
1006 |
719 |
1.4 |
|
2.Кислород |
О2 |
32,00 |
260 |
920 |
660 |
14 |
|
3.Водород |
Н2 |
2,01 |
4157 |
14230 |
10073 |
1,41 |
|
4.Азот |
N2 |
28,02 |
297 |
1051 |
754 |
1,4 |
|
5.Окись углерода |
СО |
28 |
297 |
1040 |
743 |
1,4 |
|
6.Гелий |
Не |
4, 003 |
2078 |
5238 |
3155 |
1,66 |
|
7.Аргон |
Аr |
39,9 |
208,3 |
523 |
315 |
1,66 |
|
8.Аммиак |
NH3 |
17,03 |
489 |
2066 |
1577 |
1,31 |
|
9.Водяной пар |
Н2О |
18 |
462 |
2002 |
1540 |
1,3 |
|
10.Углекислый газ |
СО2 |
44 |
189 |
819 |
630 |
1,3 |
|
11.Ацетилен |
С2Н2 |
26 |
320 |
1550 |
1230 |
1,26 |
|
12.Бутан |
С4Н10 |
58 |
143 |
621 |
478 |
1,3 |
|
13.Метан |
СН4 |
16 |
520 |
2196 |
1676 |
1,31 |
|
14.Пропан |
С3Н8 |
44 |
189 |
762 |
573 |
1,33 |
|
15. Этан |
С2Н6 |
30 |
277 |
1116 |
840 |
1,33 |
|
16.Этилен |
С2Н4 |
28 |
297 |
1196 |
900 |
1,33 |
