
- •Введение
- •15.2. Тепловое излучение
- •Спектры атомов
- •Статистическая интерпретация волн деБройля
- •Современные представления о природе света
- •Эффект комптона
- •Статистическая интерпретация волн деБройля
- •Соотношения неопределенностей (Гейзенберга) (1927)
- •Магнитный момент атома водорода (рис.35)
- •Периодический закон Менделеева
- •Химическая связь
- •Физика атомного ядра
- •Нейтрино
- •Квантовая физика твердого тела
- •Сверхпроводимость
- •Эффект Мёссбауэра
- •Эффект Джозефсона
- •Проблема управляемого термоядерного синтеза
- •Лазерный термоядерный синтез
Химическая связь
Фундаментальное достижение квантовой механики: установление физических причин возникновения связи между атомами.
Химическая связь – это понятие характеризующее силы, соединяющие атомы в молекулы вещества.
Согласно современным представлениям химическая связь имеет электрическое происхождение. Электрическое взаимодействие атомов в молекуле складывается из отталкивания ядер и электронов друг от друга и притяжения между электронами и ядрами. Чтобы молекула была стабильной, сумма энергий всех электрических взаимодействий атомов в молекуле должна быть меньше энергии системы отдельных, изолированных атомов, из которых состоит молекула.
При образовании молекулы атомы «исчезают». Молекула состоит не из атомов, а представляет собой новую систему, образованную атомными ядрами и движущимися в их поле электронами, которые становятся общими. Электроны в атомах нельзя считать точечными объектами. Электроны в атомах и молекулах образуют электронной облако, которое можно условно характеризовать понятиями плотность электронов или плотность заряда. Области, где электрон находится с наибольшей вероятностью похожи на траектории частиц, движущихся по орбитам. Такие траектории называют орбиталями. Химики говорят, что при образовании молекулы электроны переходят с атомных орбиталей на молекулярные.
В квантовой механике молекулярные орбитали описывают с помощью волновой функции. При описании химической связи исходят из рассмотрения атомных орбиталей и их пространственных перекрытий. В области перекрывания орбиталей электрон одновременно испытывает притяжение двух или нескольких ядер.
По способу перекрывания орбиталей выделяют три типа химической связи: σ, π и δ. Кроме того возможна ситуация, когда молекулы и кристаллы образуются за счет ионной связи, когда атомные орбитали ионов, образующих молекулу не перекрываются. В случае ионной связи один из атомов так сильно связывает электрон, отобранный у другого атома, что молекула образуется за счет электрического взаимодействия ионов.
При сигма-связи имеется один максимум электронной плотности, лежащей на линии, соединяющей ядра. Причина химической связи заключается в притяжении ядер к этому максимуму электронной плотности, возникающему за счет пространственного перекрытия молекулярных орбиталей.
В случае пи-связи имеется два максимума электронной плотности, расположенных симметрично относительно линии, соединяющей ядра. Эта связь более прочная, кроме того пи –связь делает невозможным поворот частей молекулы относительно указанной линии.
При дельта-связи притяжение частей молекулы обусловлено взаимодействием ядер с тремя или четырьмя максимумами электронной плотности, которые образуются за счет перекрытия молекулярных орбиталей электронов. Реализация кратности связи большей чем 4 неизвестна на практике.
Рассмотрим, например, образование молекулы водорода Н2. При сближении атомов водорода, появляется некоторая область пространства, в которой электрон испытывает притяжение одновременно обоих ядер (см. рис.40). Плотность отрицательного заряда в этой области повышается. Это и приводит к связыванию атомов. Возникает сила притяжения ядер. Однако, ядра не могут сблизиться слишком сильно из-за их взаимного электрического отталкивания (рис.40). Поэтому существует некоторое расстояние, называемое длиной химической связи (d), на котором притяжение максимально (потенциальная энергия системы U при этом минимальна, как показано на рис.). Длина химической связи молекулы водорода (d) равна 74 пм.
Электроны внутри молекулы, естественно, находятся в непрерывном движении, но движутся они так, что относительно большее время находятся в области, расположенной между ядрами симметрично линии их соединяющей. Молекулярная орбиталь описывает распределение электронной плотности в молекуле. Так же, как в атомах на молекулярной орбитали, в соответствии с принципом Паули, не может находиться больше двух электронов.
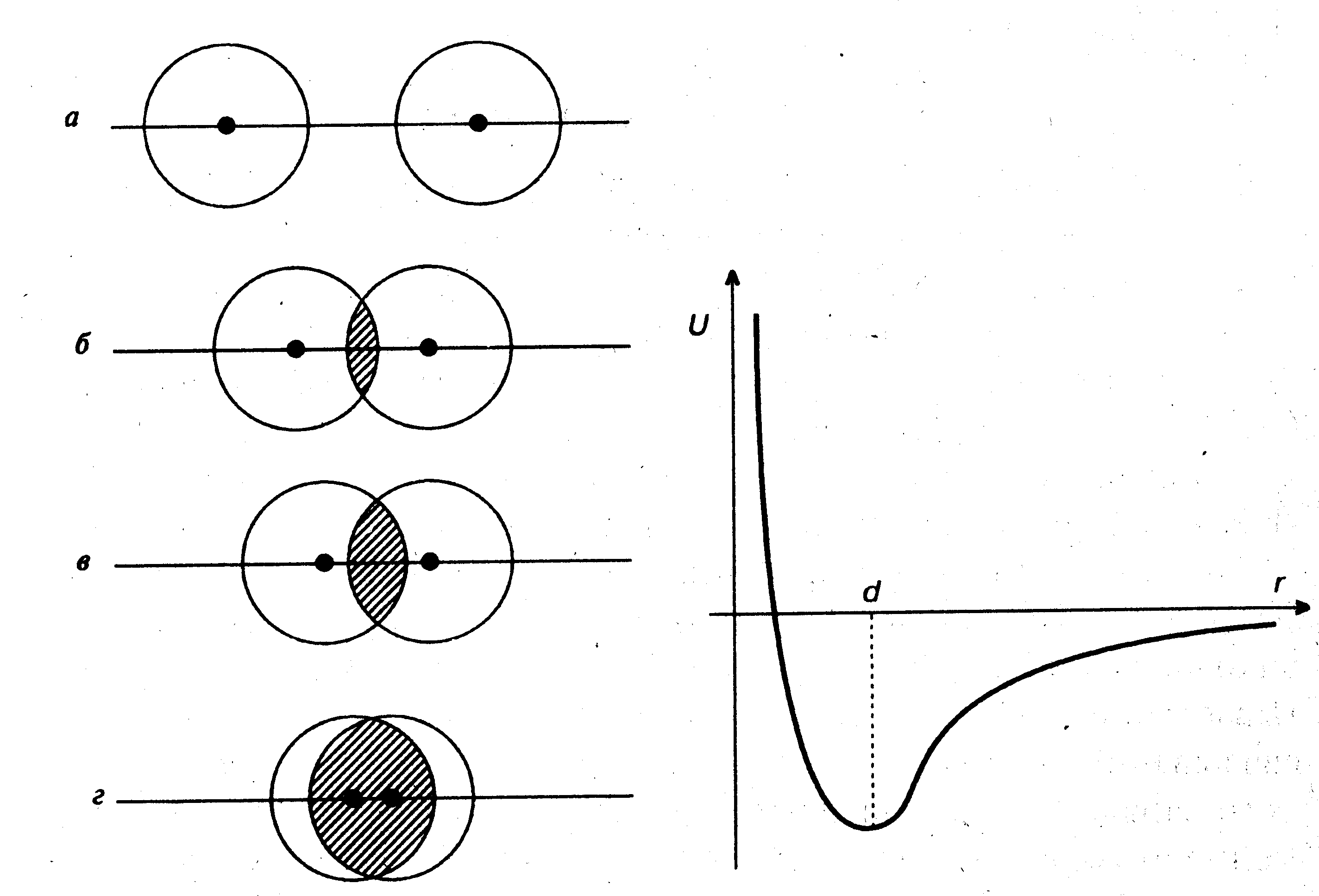
Рис. 40. Образование молекулы водорода.
Длина химической связи конкретных атомов имеет строго определенное постоянное значение. Это позволяет создавать наглядные механические модели сложных химических соединений в виде набора шариков, соединенных проволочками определенной длины, пропорциональной длинам химических связей. Причем, углы между проволочками не произвольны, а имеют значения, определяемые структурой молекулы. Так, в молекуле воды Н-О-Н, имеющей форму равностороннего треугольника, в вершинах которого находятся ядра атмов, межатомное расстояние О –Н равно 0, 0957 нм, а угол Н-О-Н равен 104,5˚. Механическая модель молекулы метана СН4 представляет собой тетраэдр, в вершинах которого находятся ядра водорода, а в центре – ядро атома углерода.
В 1927 г. Гайтлер, Лондон смогли осуществить приближенный расчет молеклы водорода Н2 и простейшей молекулы – иона молекулы водорода Н2+.
Если атомы способны объединяться в молекулу, то при их сближении действуют силы притяжения и потенциальная энергия системы понижается.
Молекула – стабильное сочетание двух или большего числа атомов. Энергия электронного облака молекулы меньше, чем суммарная энергия электронов отдельных, невзаимодействующих атомов. Для разложения молекулы на составляющие ее атомы необходимо затратить энергию.
Энергия химической связи составляет 200... 1000 кДж/моль.
Ионная связь: один или большее число электронов одного атома переходит к другому и возникающие положительный и отрицательный ионы притягиваются друг к другу. ( пример: молекула Nacl).
 а
а
 б
б
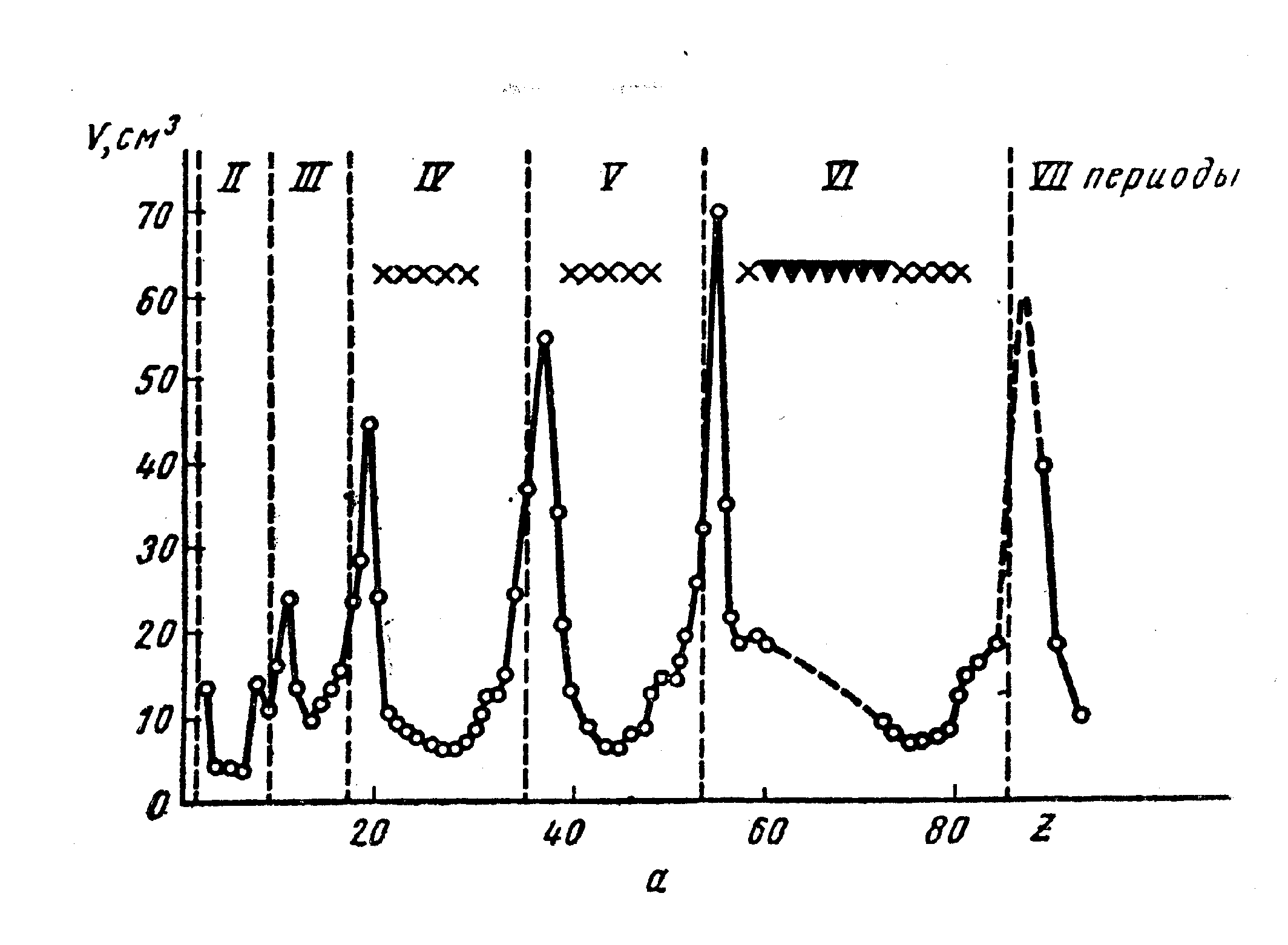
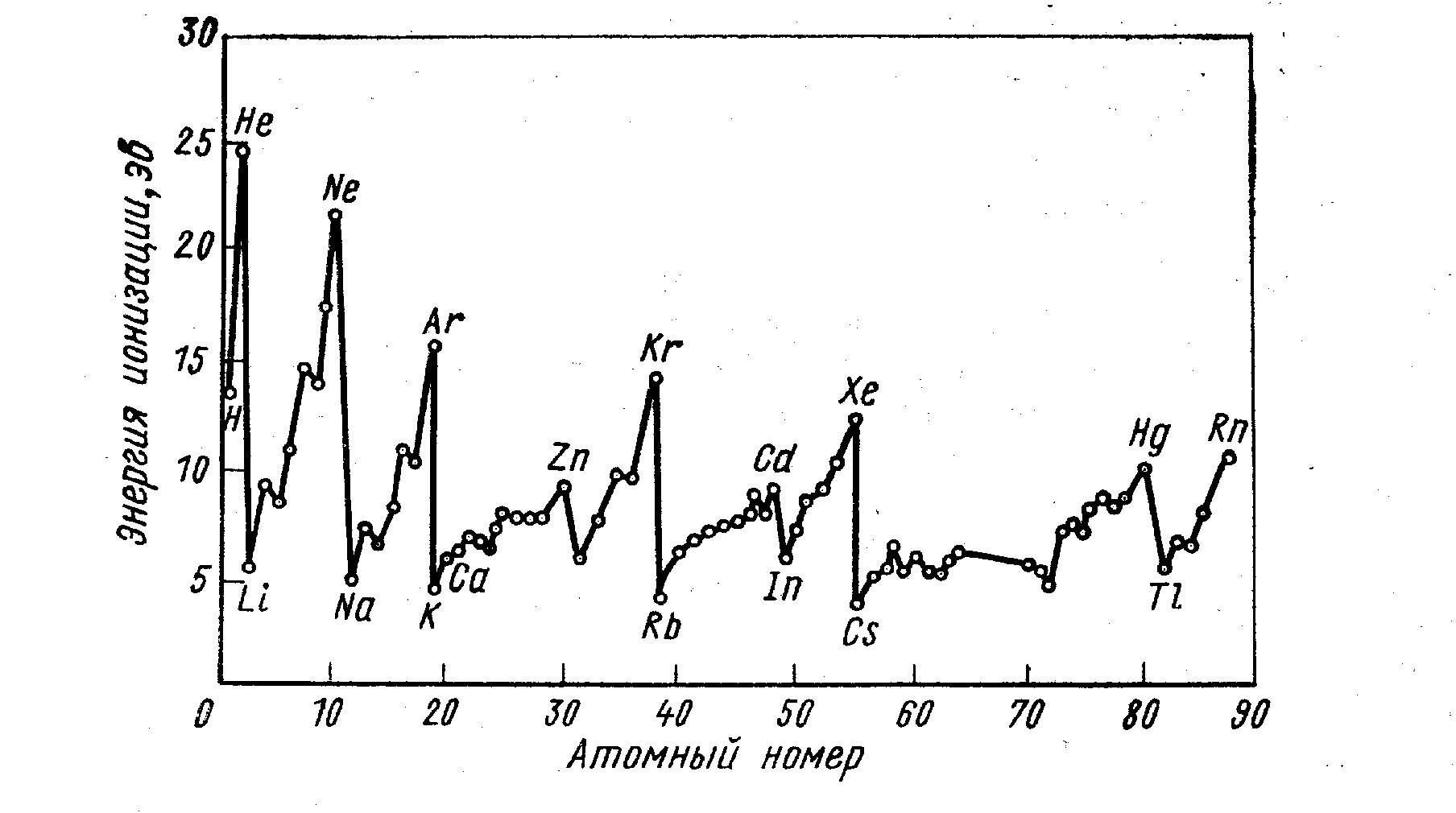
Рис. 41. Зависимость объема, занимаемого грамм-атомом простого вещества (а) и энергии ионизации (б) от порядкового номера элемента. х – элементы побочных групп, - лантаноиды.
Похожие зависимости с ярко выраженными максимумами имеют температуры плавления простых веществ.
Ковалентная связь: одна или большее число пар электронов становятся общими для двух атомов.
Электроны циркулируют между атомами и находятся в промежутке между ними больше времени, чем в других местах. Это создает силу притяжения (пример: молекула водорода).
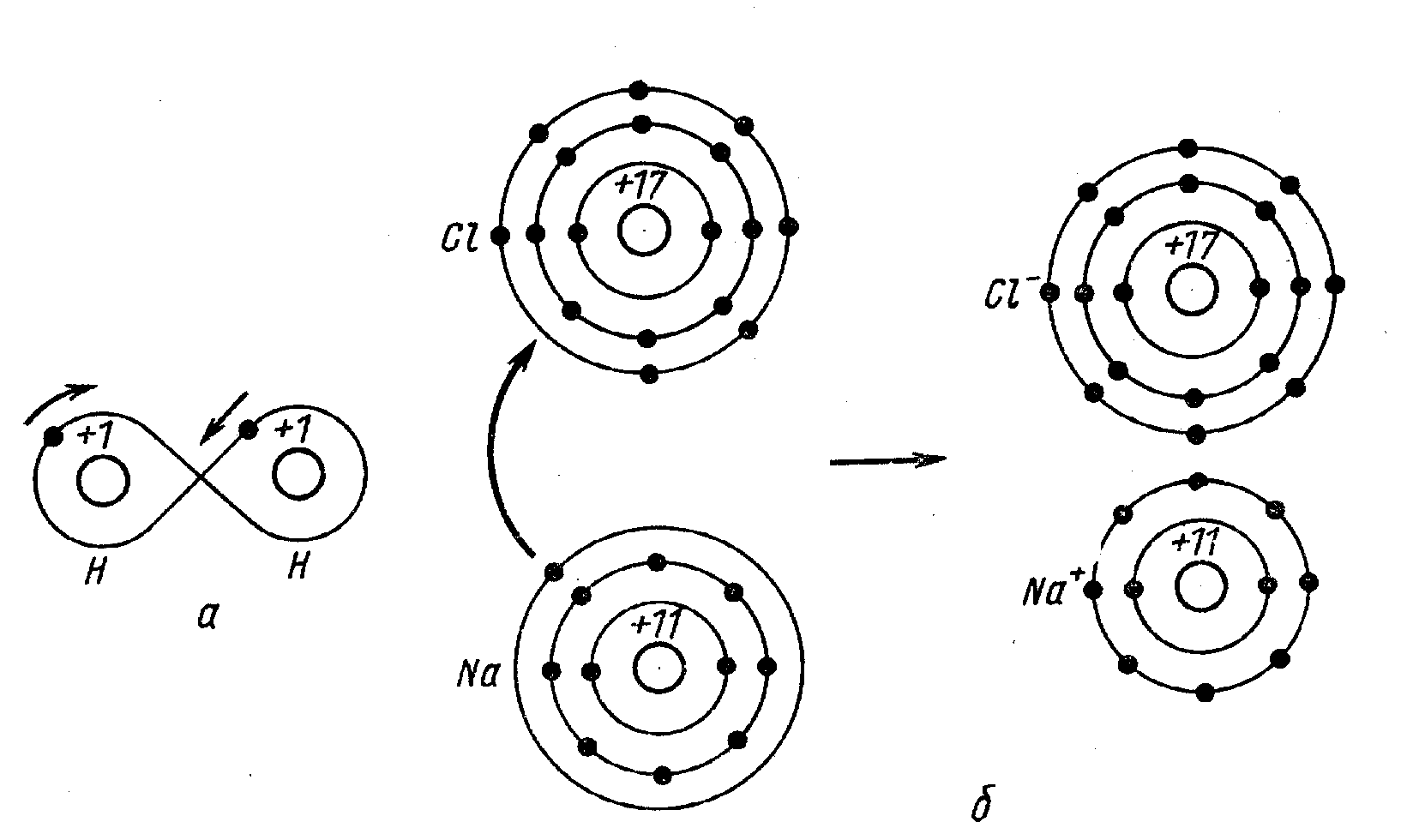
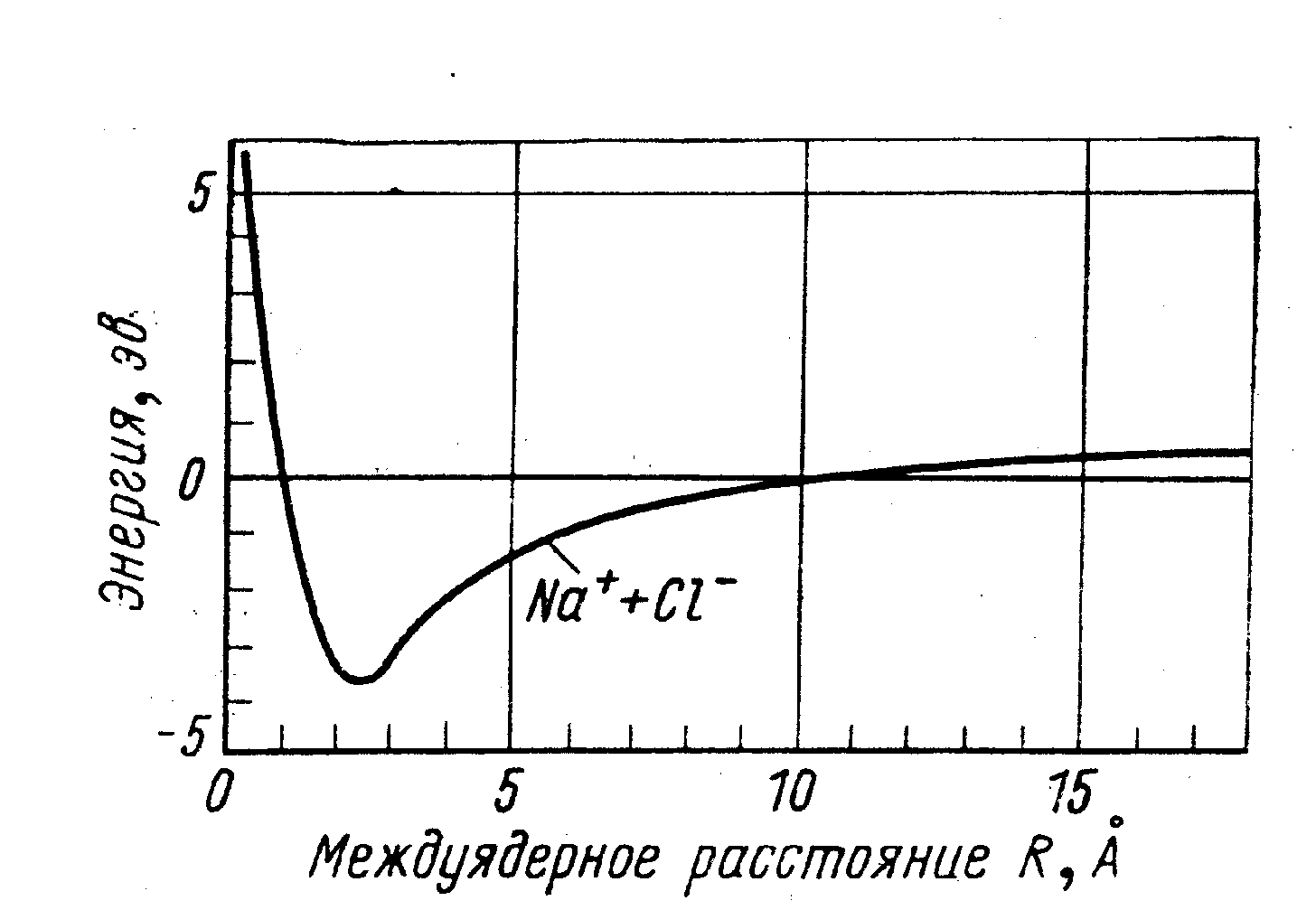
Рис. 42. (а) молекула водорода. (б, в) ионная связь. Молекула поваренной соли NaCl.
В 1960 г. Колос и Рутан получили теоретически радиус и энергию связи для молекулы водорода, которые согласуются с экспериментом.
Теоретически обоснована и направленность химической связи.
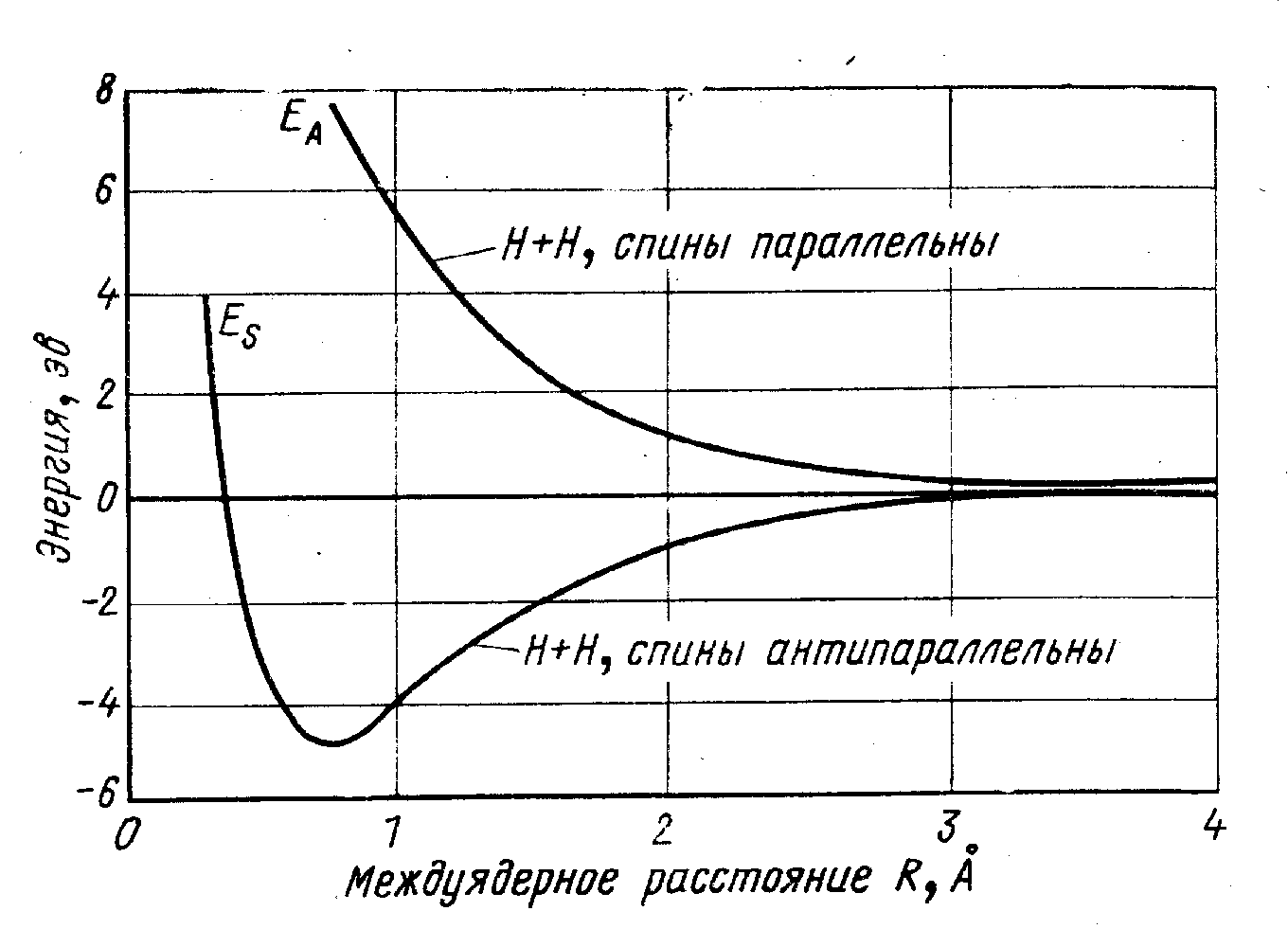
Рис. 43. Зависимость энергии системы из двух атомов водорода от расстояния между атомами.
