- •Введение
- •15.2. Тепловое излучение
- •Спектры атомов
- •Статистическая интерпретация волн деБройля
- •Современные представления о природе света
- •Эффект комптона
- •Статистическая интерпретация волн деБройля
- •Соотношения неопределенностей (Гейзенберга) (1927)
- •Магнитный момент атома водорода (рис.35)
- •Периодический закон Менделеева
- •Химическая связь
- •Физика атомного ядра
- •Нейтрино
- •Квантовая физика твердого тела
- •Сверхпроводимость
- •Эффект Мёссбауэра
- •Эффект Джозефсона
- •Проблема управляемого термоядерного синтеза
- •Лазерный термоядерный синтез
Магнитный момент атома водорода (рис.35)
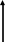
S

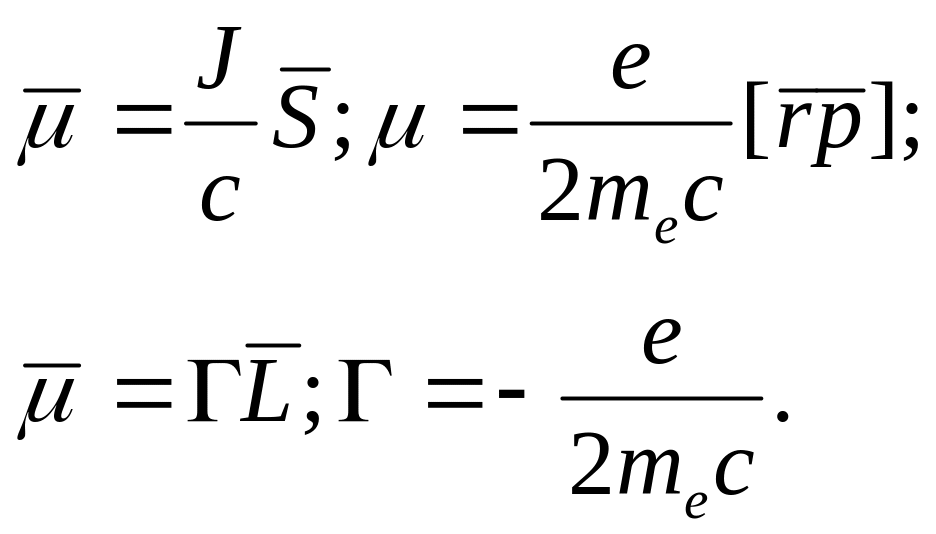
 J
J
Г- гиромагнитное отношение для орбитального движения электрона.

B- Магнетон Бора 9,2740154(31)10-24 Дж Тл.
Магнитный момент электрона e = 9,2847701(31)10-24 Дж Тл.
Опыты Штерна и Герлаха (1921)(рис. 36) – доказали существование у атомов магнитных моментов и их квантование
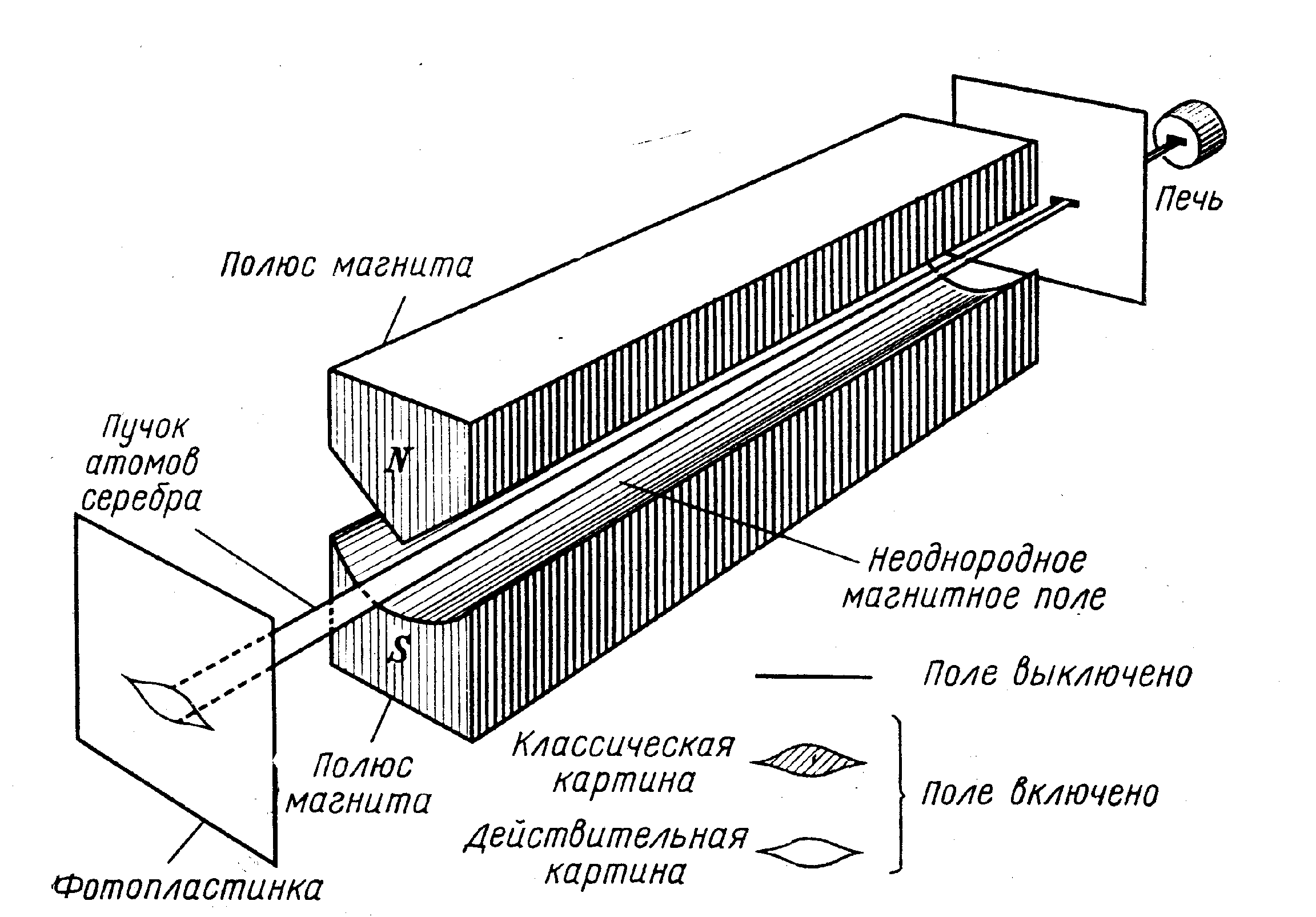
Расщепление пучка на две части для атомов серебра соответствует двум противоположным ориентациям спина валентного электрона серебра в магнитном поле, обусловленным его пространственным квантованием.
Возникновение
новой науки:
радиоспектроскопии
связано с открытием электронного
парамагнитного резонанса (ЭПР,Е.К.Завойский,
1944) и Ядерного магнитного резонанса,
ЯМР (1945, Парселл и 3 других группы ученых
в США): возникновение резонансного
поглощения вещества, помещенного в
магнитное поле, в радиодиапазоне.
![]() .
.
Для Н ~ 104 Гс, ~ 1010 Гц.
Закон Мозли: место элемента в периодической таблице определяет не атомная масса, а атомный номер элемента, равный заряду ядра.

Рис. 37. Расположение энергетических уровни внутренних электронных оболочек всех атомов идентично. Возникновение и простота структуры характеристических линий в рентгеновских спектрах излучения атомов обусловлено переходами между этими уровнями.
Исследуя характеристические спектры рентгеновского излучения для различных химических элементов Мозли экспериментально установил, что для К-серии корень квадратный из частоты данной линии пропорционален заряду ядра.
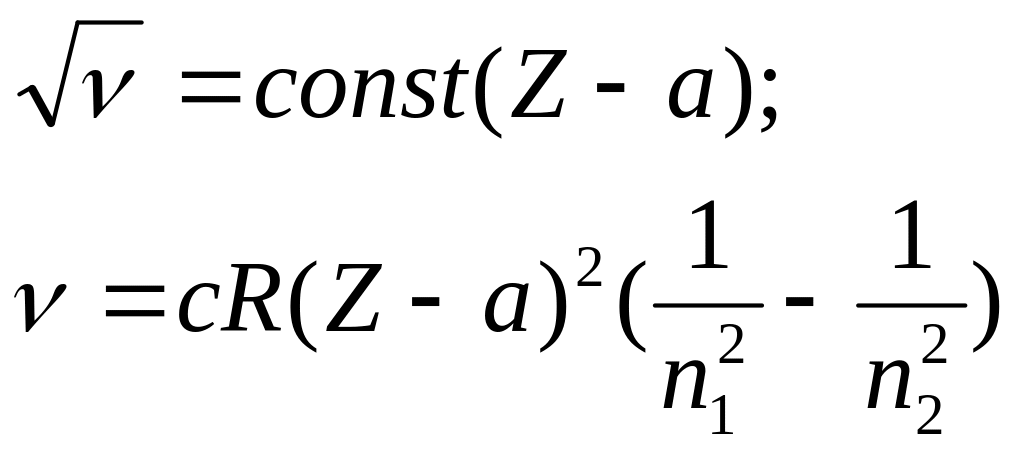 .
.
а – постоянная экранирования.
На рис.38 приведены современные данные для характеристических линий рентгеновского излучения химических элементов.
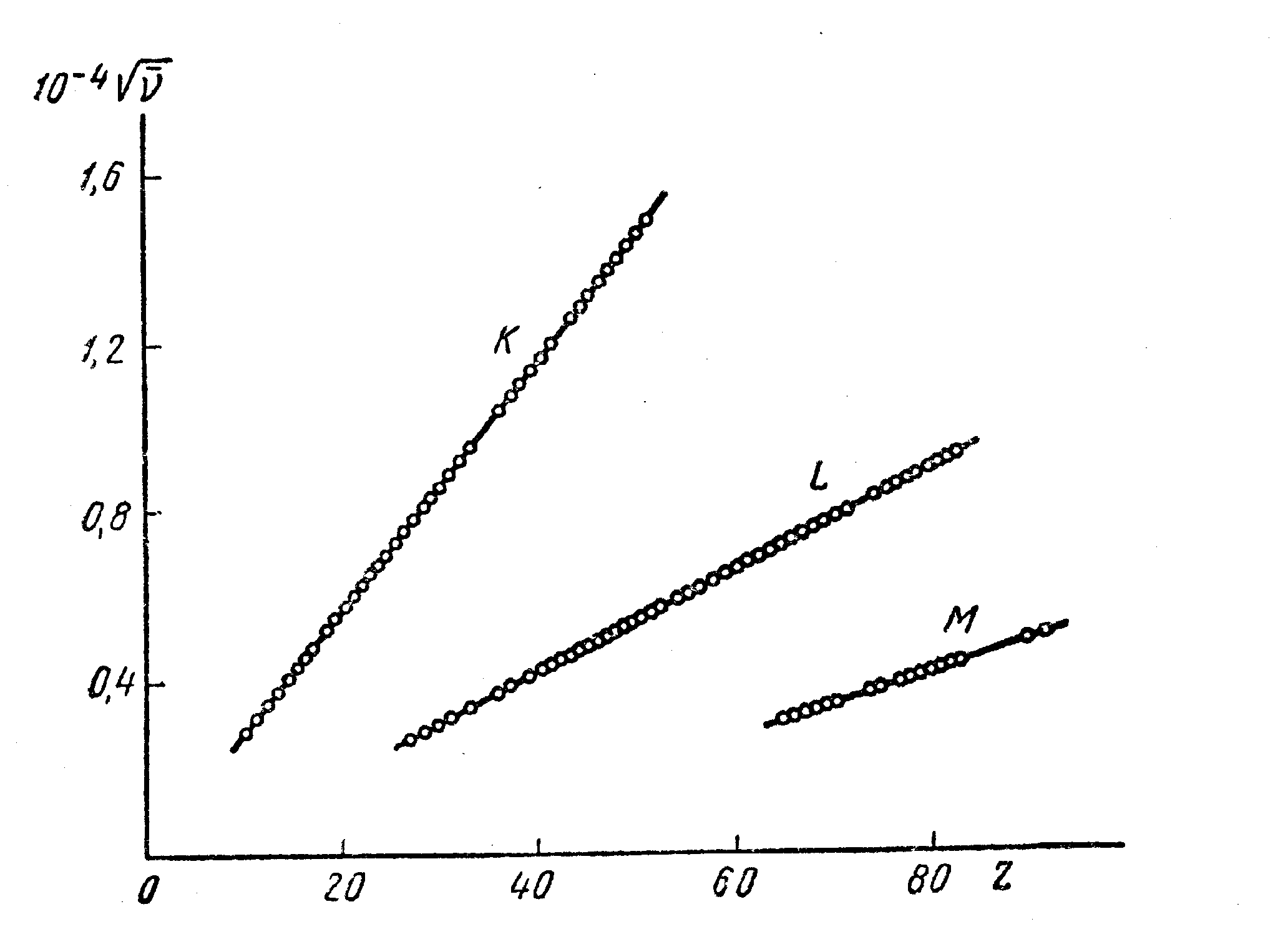 рис.
38.
рис.
38.

Рис. 39. Фотографии К-серии рентгеновского излучения различных элементов, полученные Мозли.
Периодический закон Менделеева
Таблица элементов была создана в 1869 г. Составление таблицы было далеко не тривиальной задачей. Менделееву были известны только 63 элемента из 112, открытых к настоящему времени. Систематизируя данные о химических элементах Менеделеев руководствовался двумя их свойствами: атомным весом и валентностью. В таблице, которую он составил, только 36 элементов подчинялись принципу возрастания атомного веса. Для 20 элеметов этот принцип был нарушен, поэтому для 7 элементов Менделееву пришлось исправить атомные веса на основании своей таблицы. Он настолько верил в открытую им закономерность,что предсказал на ее основе существование еще 5 элементов: скандия, германия, галлия, технеция и рения, оставив для них пустые клетки в своей таблице. Эти элементы и в самом деле были открыты в 1875 – 1885 гг. После этого закон Менделеева и его таблица получили мировое признание.
Значение таблицы заключается не только в систематизации данных о природных элементах, таблица Менделеева – основа современной физики и химии. Закономерность, открытая Менделеевым, отражает также очень глубокие законы природы о строении не только электронных оболочек атомов, которые в основном установлены, но и о структуре атомного ядра, которые не ясны до сих пор.
Периодическая система отражает закон периодического изменения физико-химических свойств элементов от их атомного веса (в современной формулировке от заряда ядра элемента, который равен номеру элемента в периодической системе).
В 1901 г. У. Рамзай дополнил таблицу Менделеева столбцом инертных газов от гелия и неона до радона.
Последующее развитие периодическая система элементов получила после открытия радиоактивности (1896, А. Беккерель), изотопов ( 1913 г. Ф. Содди) и закона Мозли (1913). Оказалось, что последовательность расположения элементов в таблице определяется зарядом ядра (закон Мозли), а периодичность физико-химических свойств связана с тем, что электроны в атоме могут иметь не произволные, а вполне определенные значения энергии.
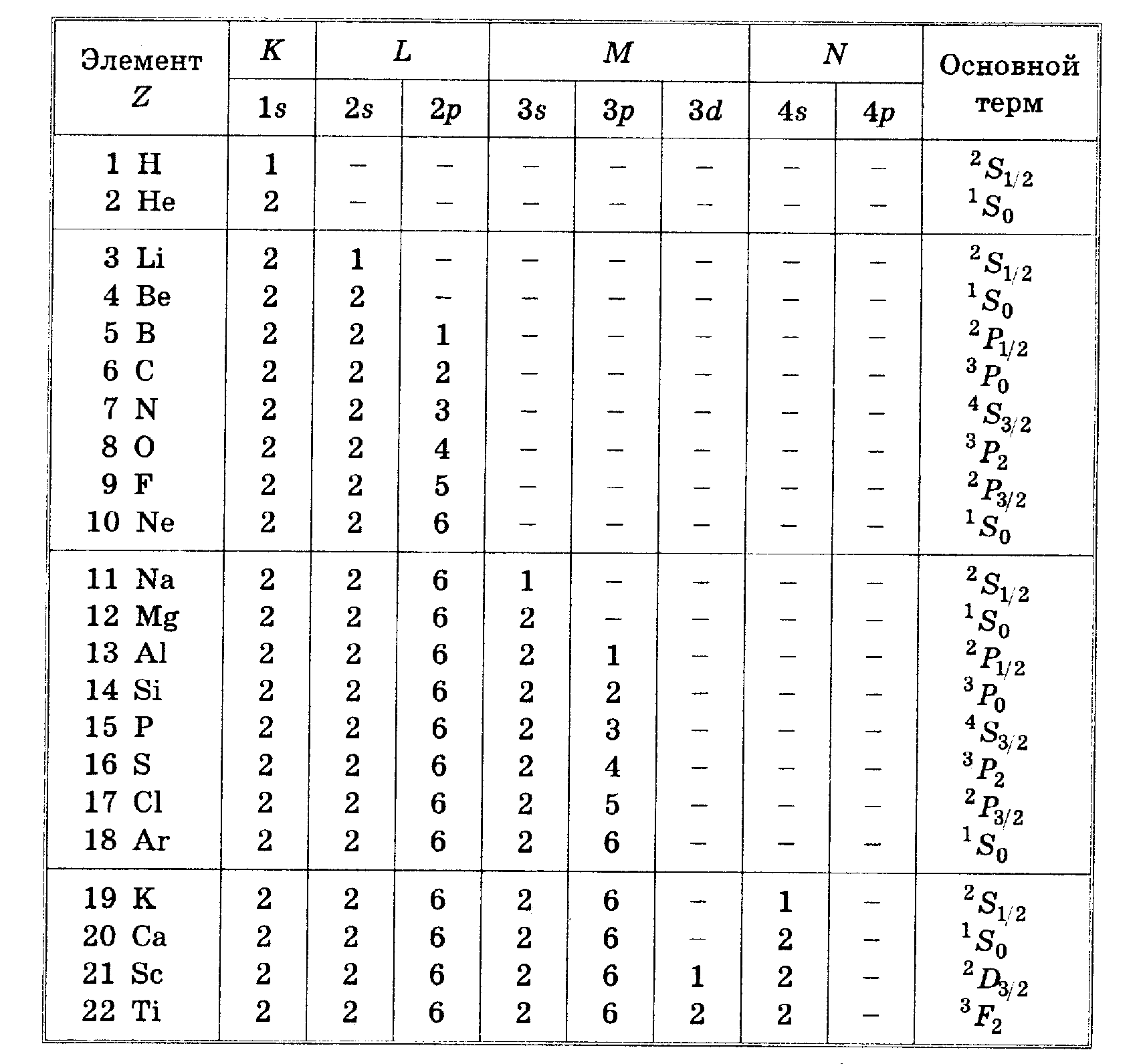
В атоме два электрона не могут принимать состояние с одинаковым набором квантовых чисел (принцип Паули). По мере возрастания атомного номера и числа электронов в атоме электроны вынуждены занимать все более и более высокие энергетические состояния. При этом электроны постепенно заполняют все более высокие орбиты (орбитали) по отношению к ядру.
Таблица построена таким образом, что при переходе от какого-либо элемента к следующему заряд ядра увеличивается на единицу, а в электронной оболочке добавляется один электрон. Составляя свою таблицу, естествено, Менделеев ничего не знал о существовнии электронов, атомного ядре и изотопов .
Все известные элементы образуют 8 вертикальных столбцов, групп, обозначаемых римскими цифрами. Номер группы соответствует высшей валентности элемента. Элементы, входящие в каждую группу имеют одинаковое строение внешних электронных оболочек, которые и ответственны за их химические свойства. В первой группе находятся элементы имеющие один электрон на внешней оболочке; во второй – два и так далее. У элементов интерных газов, составляющих восьмую группу, полностью застроены все оболочки. В отдельные группы (триады) выделены переходные элементы с частично заполненными внутренними оболочками ( группы железа, палладия и платины).
Горизонтальные ряды периодической системы называют периодами. Их всего 7 и их обозначают арабскими цифрами. Разбиение элементов на периоды отражает особенности заполнения электронных оболочек атомов.
В первый период входят два элемента (водород и гелий), у которых застраивается первая оболочка. На ближайшей к ядру оболочке любого атома могут разместиться только два электрона с противоположной ориентацией спинов.
Второй и третий периоды содержат по 8 элементов, у которых застраиваются сначала оболочки, которые условно называют 1s2 и 3 s2 , а затем оболочки p6. Верхний индекс обозначает число электронов, которые могут заполнить эту оболочку.
Периоды с четвертого по шестой занимают в таблице по два ряда; их обычно называют большими. В больших периодах между II и III группами находятся ряды переходных элементов со сходными химическими свойствами, которые называют лантаноидами или редкоземельными элементами. В YII группе также имеется ряд сходных металлов - актиноидов. У всех актиноидов и лантаноидов внешняя электронная оболочка имеет одинаковое строение. При переходе к последующему элементу так же, как у переходных металлов, застраивается внутренняя электронная оболочка, так как это энергетически оказывается более выгодным. Поэтому в одной клетке таблицы размещается целая группа элементов.
Периодическая система не завершена и конечное число элементов в ней не определено. Элементы с атомным номером большим, чем 95, были синтезированы искусственно. Время жизни этих радиоактивных изотопов крайне мало. Попытки синтеза тяжелый элементов, с атомным номером, большим, чем 107 продолжаются.
В современные варианты таблицы элементов Менделеева иногда включают огромный объем информации о физических свойствах элементов, а также о порядке заполнения их электронных оболчек.
После открытия нейтрона стало ясно,что атомное ядро состоит из протонов и нейтронов. Число протонов соответствует заряду ядра и определяет номер элемента в таблице Менделеева. Один и тот же химический элемент может состоять из ядер с разным числом нейтронов – изотопов. С открытием изотопов стало ясно, что почти каждый природный химический элемент состоит из набора изотопов этого элемента, которые имеют одинаковое число протонов (имеют одинаковый заряд ядра), но отличаются массой ядра из-за разного количества нейтронов в ядре. Процентное содержание изотопов у всех элементов, встречающихся на Земле, постоянно. Поэтому в периодической системе приведены значения атомной массы элемента, соответствующие природной, существующей на Земле смеси его изотопов.
Атомное ядро и, соответственно, атом с заданным числом протонов и нейтронов называют нуклидом . Общее обозначение нуклида имеет вид zAЭN , где Э – символ химического элемента, z – число протонов в ядре, N – число нейтронов, A = z + N – массовое число. Нуклиды, обладающие одинаковым зарядом ядра и называют изотопами. Радиоактивные ядра называют радионуклидами. Общее число известных нуклидов превышает 2000. Систематизация свойств нуклидов осуществлена в специальной таблице нуклидов, которую можно найти в справочниках. Болшьшинство радионуклидов, обладающих коротким временем жизни, в природе не встречаются, так как претерпели радиоактивный распад за время, прошедшее после образования Земли. Сохранились лишь природные долгоживущие радионуклиды, период полураспада которых соизмерим со временем существования Земли, например, уран 238 и 235 или калий 40, а также короткоживущие радионуклиды (например радий, полоний, радон), которые непрерывно образуются в результате радиоактивного распада долгоживущих радионуклидов.
После создания ядерных реакторов радионуклиды, научились получать искусственно путем облучения нейтронами в ядерном реакторе образцов, содержащих ядра стабильных элементов. Таким способом были получены радиоактивные трансурановые элементы.
104 элемент (называнный в СССР Курчатовием) альфа-радиоактивен. Период его полураспада равен 65 секунд. 105 и 106 элементы, не имеющие общепризнанных названий, «живут» еще меньшее время: 34 и 5 сек соответственно.
Физическое объяснение закона Менделеева основано на представлениях об оболочечной структуре электронного облака атомов.
Закономерности заполнения электронами энергетических состояний в атомах объясняют на основе двух правил:
Принцип Паули (1940): в любом квантовом состоянии не может находиться более одного электрона. Состояния электрона в атоме определяются 4 квантовыми числами.
Правило Хунда: минимальной энергией данной электронной конфигурации обладает терм с наибольшими возможными значениями спина S и с наибольшим возможным значении L.
Таблица 4.Порядок заполнения электронами электронных оболочек для атомов легких элементов.