
Синтез.
Хотя в Англии в лаборатории Бартона в 1968 г. осуществили синтез молекулы тетрациклина, а в Москве под руководством профессора Шемякина – синтез окситетрациклина, получение природных тетрациклинов осуществляется в промышленности путем биологического синтеза, так как тетрациклины неустойчивы в щелочной и кислой средах и имеют большое число асимметрических центров.
Этапы промышленного биосинтеза те же, что и у других антибиотиков.
Выделение тетрациклинов из культуральной жидкости проводят осаждением в виде труднорастворимых соединений, экстракцией различными р-лями, либо адсорбцией и т.д.
Так как все тетрациклины близки по химической структуре, то они имеют и одинаковые химические свойства.
Химические свойства.
Тетрациклины – полифункциональные соединения, они содержат фенольный гидроксил (С10), енольные гидроксилы (С3 и С12), диметиламиногруппу (С4), карбоксамидную группу (С2), метильную группу (С6), спиртовые гидроксилы (С5, С6, С12а), полусинтетические отличаются от окситетрациклина заместителями у С6 (=СН2; -СН3 гр.).
Все они оптически активны, имеют 5 (4, 4а, 5а, 6 и 12а – в тетрациклине) или 6 (4, 4а, 5, 5а, 6 и 12а – в окситетрациклине) асимметричных центров. Их р-ры в 0,1н HCl вращают плоскость поляриз. луча влево. Для подтверждения подлинности измеряют удельное вращение [α]20D (-).
Все тетрациклины – амфотерные соединения, способные образовывать соли с органическими и неорганическими кислотами за счет диметиламиногруппы у С4, а также проявляют основные свойства, взаимодействуя с гидроксидами и карбонатами щелочных металлов за счет фенольного гидроксила у С10 и енольных гидроксилов у С3 и С12. У енола при С3 наиболее сильные кислотные свойства. Соли с кислотами непрочные и легко гидролизуются. Р-ры солей тетрациклинов при стоянии мутнеют, вследствие выпадения в осадок основания (гидролиз).
Растворение тетрациклинов в кислотах и щелочах можно представить следующи образом:

Кроме того, тетрациклины образуют окрашенные хелатные комплексы с солями Cu2+, Zn2+ (и другими катионами поливалентных (тяжелых) металлов) за счет кислотных свойств.
Наличие в молекуле тетрациклинов двух систем сопряженных двойных связей (I и II), включающих кето- и енольные группы, обуславливает окраску этих соединений и интенсивное поглощение в УФ и видимой области спектра.
За счет фенольных и енольных гидроксилов используется реакция с FeCl3 с образованием окрашенных в буро-красный цвет фенолятов и енолятов железа, кроме того на фенольный гидроксил можно провести реакцию образования азокрасителя:
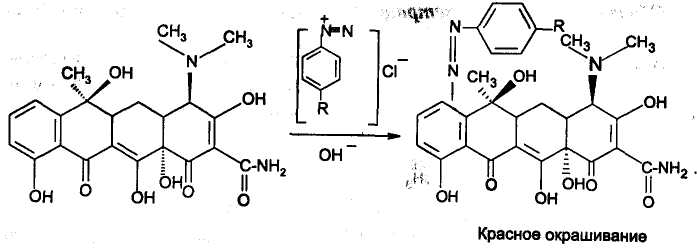
Тетрациклины вследствие наличия частично гидрированных алициклических колец А, В и С и фенольного гидроксила в кольце D, неустойчивы к действию щелочей, карбонатов щелочных металлов, сильных минеральных кислот (рН<2,0), света и влаги. В процессе хранения могут образовываться неактивные или токсичные продукты: 4-эпитетрациклины, ангидротетрациклины, 4-эпиангидротетрациклины, которые необходимо учитывать при оценке качества препаратов.
В щелочной среде тетрациклины разлагаются до биологически неактивных изотетрациклинов, что сопровождается усилением желтой окраски и появлением голубой флюоресценции после нагревания, что используется для подтверждения подлинности и количественного определения СФ (λmax=380 нм)
В сильнокислой среде (конц. HCl, конц. H2SO4) тетрациклины превращаются в ангидротетрациклины, которые имеют темно-желтую окраску (λmax=437 нм) и желто-зеленую флюоресценцию в УФ-свете (общегрупповая реакция на подлинность) с конц. HCl.

Ангидропроизводные обладают очень слабой антимикробной активностью, они устойчивы в кислых и щелочных р-рах
Реакцией с конц. HCl отличают тетрациклин от окситетрациклина:
-тетрациклин – желтое окрашивание и желто-зеленая флюоресценция
-окситетрациклин – оранжево-красное окрашивание и желто-зеленая флюоресценция в УФ свете.
Реакции отличия при взаимодействии с конц. H2SO4 при нагревании:
-тетрациклин – фиолетовое окрашивание
-окситетрациклин – вишнево-красное, затем пурпурно-красное окрашивание. Сначала образуется ангидротетрациклин, а затем протекает реакция его окисления с образованием продуктов различной окраски.
-хлортетрациклин – кобальтово-синий > зеленый > оливковый > +вода > золотисто-оранжевое окрашивание.
Тетрациклины при определенных значениях рН могут подвергаться обратимой изомеризации, связанной с изменением конфигурации асимметричного атома С4, такие изомеры называются эпитетрациклины:

Наиболее легко эпимеризуются тетрациклин и хлортетрациклин; окситетрациклин наиболее устойчив.
Эпимеры более стабильны и в кислой, и в щелочной среде, лучше р-римы в воде, значительно менее биологически активны и токсичны, слабее поглощают свет в УФ-области, имеют большую отрицательную величину удельного вращения.
Реакции отличия.
Хлортетрациклин:
на органически связанный хлор – проба Бельштейна.
+ NaOH до рН = 7,0-9,0 и нагрев ---> голубая флюоресценция в УФ-свете.
Реакции отличия с конц. H2SO4 и с р-вом Эрлиха (р-р п-ДМАБ в разб. HCl), но эта реакция идет медленно (6-8 часов).
[α]20D в разб. HCl – левовращ.
Примеси
4-эпитетрациклины, ангидротетрациклины, изотетрациклины и 4-эпиангидро-тетрациклины – определяют методом ТСХ с применением соответствующих стандартных образцов (СОВС).
Ангидропроизводные определяют по поглощению света при λmax=437 нм.
Кислотность или щелочность водных растворов или суспензий – потенциометрически.
Потеря в весе при высушивании – в вакуумном сушильном шкафу или по Фишеру.
Испытание на токсичность – на белых мышах.
Количественное определение.
По ГФ биологический метод диффузии в агар с тест-микроорганизмом. У всех препаратов 1 мкг = 1 ЕД химически чистого вещества (1 г = 1 000 000 ЕД).
СФ в УФ области.
ФЭК (с FeCl3, азокраситель).
Флюориметрия.
Применение. Хранение.
Все препараты относятся к сп. Б.
Хранят в сухом, защищенном от света месте, при комнатной температуре, в стеклянных банках темного стекла с навинчивающимися крышками, залит. парафином.
При хранении в-ва темнеют, так как превращаются в ангидро- и 4-эпиангидротетрациклины (так как они имеют слабокислую среду) – более токсичные вещества.
Выпуск.
-тетрациклин – таб., покрытые оболочкой розового цвета; глазная мазь (для лечения инфекционных заболеваний глаз), кожная мазь.
-тетрациклина г/хл – таб., покрытые оболочкой красного цвета, капсулы по 0,25; порошок во флаконах по 0,1 г (100 000 ЕД) в/м на 0,5-1% р-ре новокаина. Мазь тетрациклиновая применяется при заболеваниях кожи, глазная мазь.
-окситетрациклина дигидрат – мазь глазная (в алюминиевых тубах по 3, 5, 10, 30, 50 г), таб. по 0,25 г.
-окситетрациклина гидрохлорид – мазь «Гиоксизон» (с гидрокортизона ацетатом 1% и окситетрациклина гидрохлоридом 3%) и аэрозольные препараты с преднизолоном и гидрокортизоном.
-метациклина г/хл (рондомицин) – капс. по 0,15 и 0,3 г.
-доксициклина г/хл (вибрамицин) – капс. по 0,05 и 0,1 г, таб, покрытые оболочкой; лиофилизированный порошок в амп. по 0,1 г.
Тетрациклины применяются при лечении различных инфекционных заболеваний – бронхит, плеврит, пневмония, коклюш, гонорея, сыпной и возвратный тиф, бактериальная и амебная дизентерия, инфекционные заболевания глаз (блефарит, конъюнктивит), кожные заболевания (фурункулез).
Полусинтетические препараты быстрее всасываются при приеме внутрь и дольше сохраняются в крови.
По механизму антибактериального действия тетрациклины подавляют биосинтез белка микробной клетки на уровне рибосом
С солями Ca2+, Mg2+, Al3+ и др поливалентных металлов (Fe и др.) образуют нерастворимые комплексные соли, поэтому из нельзя принимать вместе с молоком и молочными продуктами, антацидами, содержащими соли Ca2+, Mg2+, Al3+ и с препаратами Fe3+.
