
- •Алгебраическая форма стехиометрических уравнений
- •Стехиометрически независимые уравнения
- •Сложная реакция
- •Если воздействовать на систему, находящуюся в химическом равновесии, то состояние системы изменяется таким образом, что это воздействие ослабляется.
- •5. Удаление компонента продукта. В процессе с реакцией
- •Равновесие в технологических расчетах
- •2. Скорость превращения и скорость реакции
- •3. Кинетическое уравнение.
- •Химические процессы
- •Хп в непористом зерне
Химические процессы
Химический процесс – явление взаимодействия химической реакции и процессов переноса на молекулярном уровне, которые являются его составляющими.
Группа А (по ф/х признакам, характеризующих протекающую реакцию)
Группа Б ( физические признаки, характеризующие фазовый состав с реагентом)
Группа А:
тип химической реакции:
прямое химическое взаимодействие
реакция с химическим воздействием (каталитическая реакция)
реакция с физическим воздействием (под действием света, радиационная реакция, электрохимическая реакция)
термодинамические показатели:
а) тепловой эффект:
экзотермический процесс
эндотермический процесс
смешанный ХП
б) направленность превращения:
обратимые ХП (до Хр)
необратимые (нет равновесия, не достигается)
смешанные ХП
кинетические характеристики:
а) схема превращения
простая реакция
сложная (параллельная, последовательная)
общий случай
б) кинетическая модель
r = f (С, T)
Группа Б
1.фазовый состав:
а) число участвующих фаз с реагентами:
гомогенный ХП (все реагенты в одной фазе)
Гетерогенный (многофазный)
состояние фаз
а) газ
б) жидкость
в) твердое
основная цель изучения ХП изучение скорости превращения в нем и влияния на ХП условий протекания.
Гомогенный ХП – процесс протекающий в одной фазе. В этой фазе выровнены все условия протекания реакции во всем выделявшемся объеме.
простоя реакция
а) необратимая
Гетерогенный химически процесс – процесс, в котором исходные вещества и в общем случае продолжают находится в разных фазах.
Аг + Втв = Rг + S
Гетерогенные процессы подразделяют:
«газ - твердое»
а) адсорбция
б) десорбция
в) обжиг руды
г) окисление Ме
д) горение тв. топлива
«газ - жид»
а) адсорбция
б) десорбция
в) дистилляция
г) ректификация (протекает с химическим взаимодействием)
«жид - тв»
а) адсорбция
б) десорбция
в) кристаллизация
г) растворение
д) выщелачивание
«жид - жид» (несмачивающие)
а) экстракция
б) эмульгирование
«тв - тв»
а) процесс спекания (производство цемента)
б) высокотемпературный синтез неорг материала
многофазная система.
В гетерогенных ХП реактанты находятся в разных фазах, а реакция протекает либо на границе раздела фаз, либо в одной из фаз.
1. «Газ – тв» («жид - тв»)
Aг + Bт = Rг (модель «сжимающаяся сфера»)
происходит уменьшение размера твердого материала по мере протекания процесса вплоть до его исчезновения
структура процесса:
В газовой фазе:
I Перенос реагента А из газового потока к поверхности твердой частицы
II Реакция А с твердым В на наружной поверхности частицы
Перенос продукта реакции R от поверхности в газовый поток
В твердой фазе:
II Реакция В с газообразным компонентом А поверхности
Изменение (уменьшение) размера частицы r
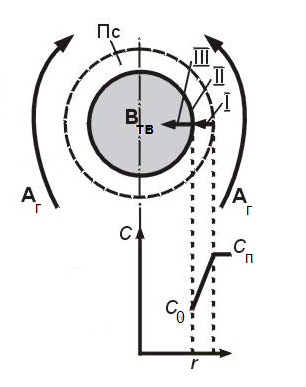
Допущения:
тв частица – шарообразной формы.
поверхность частицы тв. – равнодоступна, т.е. перенос между потоком и частицей, одинаков по всей поверхности.
Тпотока = Тчастицы
По мере протекания процесса происходит уменьшение размера тв материала, вплоть до его исчезновения. ( размер = 0, реакция прошла до конца).
Математическая модель:
WI = WII
WI = -bSr(C0 - CП)
WII = -k(CП)Sr , где: b - коэффициент массообмена, k - константа скорости реакции, Sr – поверхность твердой частицы, tк - время полного превращения, C0 - концентрация А в потоке, R0 - первонач. радиус частицы, CП - концентрация А на поверхности, r - радиус частицы.
Наблюдаемая скорость:
Wн=-kCп=-kC0/(1+k/b)=Kн*C0
Наблюдаемая скорость превращения, отнесенная к одной частице:
Wн(част)= WнSr= Wн*4pr2= - 4pR02КНC0r2= -4pR02КНC0(1 - t/tк)2
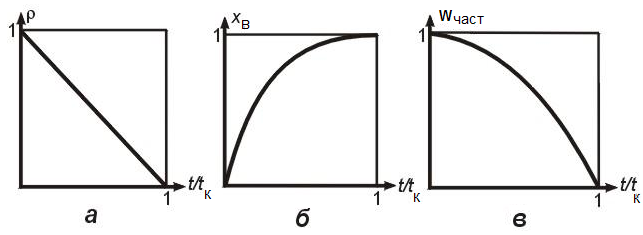
Изменение во времени t безразмерного радиуса частицы r (а), степени превращения твердого реагента xВ (б) и скорости превращения частицы Wн(част) (в) для гетерогенного процесса "сжимающаяся сфера". tк - время полного превращения.
r = 1 - t/tк;
хB = 1 - (1 - t/tк)1/3 ;
Wн(част) = -4pR02КНC0(1 - t/tк)2
Лимитирующие стадии и режимы процесса
Если k<<b, т.е. реакция малоинтенсивна; CП~ C0, Wн=-kС0 кинетический режим: Химическая реакция – лимитирующая стадия
Если k>>b, интенсивность массообмена мала; CП<< C0, Wн=-b С0 диффузионный режим: массоперенос – лимитирующая стадия
В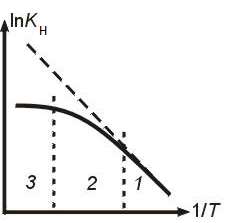 лияние
условий процесса на скорость превращения
лияние
условий процесса на скорость превращения
Влияние температуры
Зависимость наблюдаемой константы КН скорости превращения в гетерогенном процессе "сжимающаяся сфера" от температуры Т. Пунктир – k(T).
Режимы процесса:
1 – кинетический (k<<b, Kн=k);
2 - переходный;
3 – диффузионный (k>>b, Kн=b
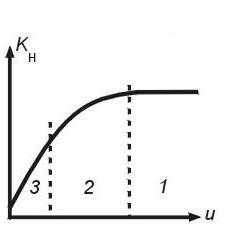
Влияние скорости газового потока
Зависимость скорости обтекания частицы u от температуры Т.
Режимы процесса:
1 – кинетический (при больших скоростях потока с возрастанием b режим не зависит от u);
2 - переходный;
3 – диффузионный
(b << k, Kн=b и увеличивается с увеличением скорости газового потока).
Интенсификация процесса
![]()
Пути уменьшения tк и, следовательно, интенсификации процесса:
увеличение концентрации компонента в газе C0;
дробление частиц - уменьшение R0;
увеличение температуры и, следовательно, константы скорости k;
увеличение скорости потока и, следовательно, коэффициента массообмена b.
Влияние T и u ограничено соответствующим режимом процесса – кинетическим и диффузионным.
«газ – жид»
Взаимодействие "газ-жидкость" представлено в промышленности несколькими разновидностями по способу контакта фаз:
барботаж (диспергированный газ в виде пузырей поднимается в слое жидкости);
орошение (диспергированная в виде капель жидкость пролетает через газ);
пленочное течение (жидкость пленкой стекает по поверхности, поток газа проходит вдоль нее);
контакт в насадочной колонне (близко к пленочному течению - жидкость стекает по насадке в виде нерегулярной, возмущенной пленки, газ проходит в свободном пространстве);
газо-жидкостной поток (потоки газа и жидкости движутся спутно, в одном направлении).
Применение гетерогенные процессы в системе «газ-жидкость» широко используются в химической технологии
а) в качестве самостоятельных процессов получения необходимых продуктов
Абсорбция аммиака растворами азотной кислоты при производстве аммиачной селитры или растворами серной кислоты при производстве сульфата аммония (производство удобрений)
Хлорирование жидких ароматических углеводородов (органический синтез)
б) в качестве вспомогательных процессов очистки газовых смесей
Абсорбция углекислого газа водными растворами моноэтаноламинами
Абсорбция карбоната калия с целью очистки синтез-газа в производстве аммиака
Абсорбция диоксида серы растворами сульфита и гидросульфита аммония при санитарной очистке газов
Основные теоретические положения
С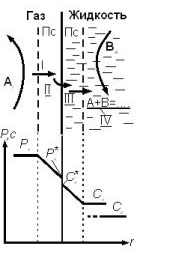 хема
процесса взаимодействия газа с жидкостью:
хема
процесса взаимодействия газа с жидкостью:
соприкасаются потоки газа и жидкости;
имеется граница раздела фаз;
компоненты переносятся через поверхность раздела фаз;
реакция протекает в одной из фаз или в обеих.
В пределах выделенного элемента концентрации компонентов в каждой из фаз одинаковы. В качестве такого элемента можно выделить газовый пузырь с некоторым объемом жидкости вокруг него, или каплю в газовом объеме, или элементарный участок пленочного газо-жидкостного потока
Вариант процесса.
Исходные компоненты содержатся в газе - А и в жидкости - В. Их содержание определено условиями процесса: парциальное давление А в газе - РA и концентрация В в жидкости - СВ. Реакция протекает в жидкой фазе.
Aг + Bж = Rж + (Sг)
Скорость реакции описывается кинетическим уравнением
r = kCACB
где CA - концентрация A в жидкой фазе.
Структура процесса.
1) Перенос компонента A из объема газа через газовый пограничный слой к поверхности раздела фаз (этап I).
2) Перенос A через поверхность раздела из газа в жидкость (этап II).
3) Перенос A от поверхности раздела через пограничный слой в объем жидкости (этап III).
4) Реакция между A и В в жидкости (этап IV).
Полагаем, что реакция сосредоточена в объеме жидкости. Продукты реакции не влияют на скорость процесса и параметры массопереноса
Математическая модель
Математическая модель указанной последовательности этапов основана на равенстве потоков WI, WII и WIII на стадиях переноса и скорости превращения WIV компонента А:
WI = WII = WIII = WIV
Перенос через газовый пограничный слой
WI = -bгS(РA* - РA), где bг - коэффициент массообмена между газом и поверхностью раздела фаз; РA* - парциальное давление А у поверхности раздела фаз; S - величина поверхности раздела фаз.
Перенос через поверхность раздела фаз осуществляется на расстоянии размера молекул, и можно полагать, что приповерхностные парциальное давление в газе РA* и концентрация в жидкости СA* находятся в равновесии
СA* = KaРA*, где Ka - константа абсорбции.
Перенос А через пограничный слой жидкости
WII = -bжS(CA - СA*), где bж - коэффициент массообмена между поверхностью раздела фаз и объемом жидкости.
Реакция протекает в объеме жидкости Vж, и скорость превращения А в объеме:
WIV = -kCACBVж
Приравниваем WI, WII и WIV:
-bгS(РA* - РA) = -bжS(CA - СA*) = - kCACB Vж
Поток через границу раздела фаз заменяется условием фазового равновесия:
СA* = KaРA* .
Из трех уравнений:
СA* = KaРA*
-bгS(РA* - РA) = -bжS(CA - СA*)
-bжS(CA - СA*) = - kCACBVж
можно определить три неизвестные - установившиеся концентрации РA*, СA* и CA.
С помощью несложных математических преобразований получаем
СA* = (bжCA + bгРA)/(bж + bг/Ka)
Здесь использована удельная поверхность раздела фаз
Sуд = S/Vж,
обычно используемая для характеристики развитости площади контакта жидкости и газа.
Если перенос из одной среды в другую проходит через несколько последовательных этапов, то его интенсивность определяют общим коэффициентом массопереноса между газом и жидкостью b:
1/b = Ka/bг + 1/bж
Аппараты, в которых осуществляются газожидкостные реакции:
1) Насадочный абсорбер
2) Колонна с ситчатыми переточными тарелками
3) Пленочный абсорбер
4) Абсорбер с барботажным слоем
Условия процесса – состояние каждой из фаз и параметры их взаимодействия.
Скорость превращения в гетерогенном химическом процессе, выраженная через условия процесса, есть наблюдаемая скорость превращения.
Лимитирующая стадия – этап многостадийного процесса, характеризующийся максимальной движущей силой или минимальной интенсивностью. Лимитирующая стадия определяет режим, или область протекания процесса.
Каталитический процесс.
Ряд химических превращений требует инициирования, чтобы превращения могли протекать с заметной скоростью. Таким инициатором могут быть химические вещества – катализаторы. Химические процессы с их участием называются каталитическими.
Катализ – явление возбуждения химических реакций специальными веществами – катализаторами. Катализатор многократно вступает в промежуточное химическое взаимодействие с веществами, участвующими в реакции, и восстанавливает свой состав после каждого цикла промежуточных взаимодействий.
Катализ является не только методом ускорения реакций, но и методом управления ими для направленного осуществления тех или иных превращений, в том числе с получением веществ , которых нет в природе.
Катализаторами могут быть элементарные вещества (металлы, активированный уголь), химические соединения (оксиды, сульфиды, хлориды), сложные комплексы и многоатомные молекулы, их смеси. Специфичность катализатора зависит как от его состава и строения, так и от вида химической реакции.
Каталитические реакции можно классифицировать по фазовым признакам: гомогенные, гетерогенные и микрогетерогенные. В гетерогенном катализе реагирующие вещества и катализатор находятся в разных фазах (например, катализатор – твердый, а реагирующие вещества – в газовой фазе).
