
Тема: Элементы химической термодинамики и биоэнергетики.
ПЛАН:
Внутренняя энергия и энтальпия.
Тепловые эффекты химических реакций.
Термохимические уравнения.
Закон Гесса.
Энтальпии образования и энтальпии сгорания веществ.
Теплота нейтрализации.
Энтропия системы. Уравнение Больцмана.
Энергия Гиббса.
Термодинамика изучает законы, которые описывают энергетические превращения, сопровождающие физические, химические и биологические процессы. Одним из основных понятий термодинамики является понятие "система".
Система - это тело или группа взаимодействующих тел, реально или мысленно выделенных из окружающей среды.
В зависимости от однородности различают гомогенные и гетерогенные системы.
Гомогенная система - это однородная система, в которой нет частей различающихся по свойствам и разделенных поверхностями раздела. Например: воздух, вода, истинные растворы, плазма крови.
Гетерогенная система - это разнородная система, состоящая из двух или более частей, разделенных поверхностью раздела, где свойства системы резко меняются. Например: цельная кровь, т.е. плазма с клетками - эритроцитами и лейкоцитами; смесь воды и масла и др. Часть гетерогенной системы, ограниченная физическими границами раздела, называется фазой. Таким образом, гомогенные системы являются однофазными, а гетерогенные - двухфазными или многофазными.
Живые системы являются гетерогенными, так как они всегда отделены от окружающей среды оболочкой. В каждой живой клетке имеется множество различных мембран, отделяющих составные части клетки друг от друга.
В зависимости от характера обмена энергией и веществом с окружающей средой выделяют три типа систем: изолированные, закрытые и открытые.
Изолированная система - это система, которая не обменивается с окружающей средой ни веществом, ни энергией (∆m = 0, ∆Е = 0).
Закрытая система - это система, которая обменивается с окружающей средой энергией, но не обменивается веществом (∆m = 0, ∆Е ≠ 0).
Открытая система обменивается с окружающей средой как веществом, так и энергией (∆m ≠ 0, ∆Е ≠ 0).
Абсолютно изолированных систем в природе нет. Живой организм представляет собой открытую систему, жизнедеятельность которой связана с постоянным обменом веществом и энергией с окружающей средой.
Состояние системы характеризуется определенной совокупностью физических и химических величин, которые называются параметрами системы. К ним относятся, масса (т), количество вещества (n), температура (Т), давление (Р), концентрация (с). Значение параметра можно измерять непосредственно.
Для характеристики состояния системы наряду с параметрами используют функции состояния. Их значения рассчитывают по соответствующим формулам исходя из значений параметров, которые описывают данное состояние системы.
Значения параметров и функций состояния системы определяются только состоянием системы. Поэтому при переходе системы из одного состояния в другое изменение этих величин не зависит от пути перехода, а определяется лишь начальным и конечным состоянием системы, т.е. их значениями в этих двух состояниях.
Переход системы из одного состояния в другое называется процессом.
Процессы разделяют в зависимости от изменения параметров системы на изотермические (Т= соnst, Т= 0); изобарические ( р = соnst, р = 0); изохорические (V = соnst, V = 0); адиабатные (Q=0).
Процессы, протекающие в организме человека, осуществляются при постоянных температуре и давлении, т.е. являются изобарно-изотермическими.
Для описания энергетического состояния системы используется ее функция состояния - внутренняя энергия ( Е, кДж/моль).
Внутренняя энергия системы (Е ) – это полная энергия системы, включающая все виды энергии молекул, атомов, электронов и энергию внутри ядра, т.е. внутренняя энергия системы равна сумме потенциальной и кинетической энергии всех частиц, составляющих систему (кроме потенциальной и кинетической энергии системы в целом).
Абсолютное значение внутренней энергии системы определить невозможно. Экспериментально можно определить изменение внутренней энергии Е, происходящее в процессе перехода системы из одного состояния в другое при взаимодействии ее с окружающей средой. Схематично это можно представить следующим образом:
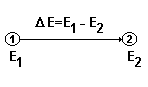
При взаимодействии системы с окружающей средой обмен энергией может осуществляться в виде теплоты и работы. Упорядоченную форму передачи энергии называют работой, неупорядоченную форму - теплотой.
Работа (W) - энергетическая мера направленных форм движения частиц в процессе взаимодействия системы с окружающей средой. Работу, производимую системой над окружающей средой, в термодинамике считают положительной, при этом внутренняя энергия системы уменьшается.
Теплота ( Q ) - энергетическая мера хаотических форм движения частиц в процессе взаимодействия системы с окружающей средой. Если система получает некоторое количество энергии, передаваемое в форме тепла, то теплота считается положительной, при этом внутренняя энергия системы увеличивается.
Таким образом, изменение внутренней энергии системы обусловлено работой, которая совершается при взаимодействии системы с окружающей средой, и передачей теплоты между средой и системой. Соотношение между этими величинами составляет содержание первого начала термодинамики. Первый закон (первое начало) термодинамики впервые был сформулирован немецким физиком Ю. Майером в 1842 г. Известно несколько формулировок первого начала термодинамики:
Энергия не исчезает и не возникает из ничего, а только превращается из одного вида в другой в строго эквивалентных количествах.
Внутренняя энергия изолированной системы есть величина постоянная.
Вечный двигатель первого рода невозможен, т.е. невозможно создать двигатель, который совершал бы работу без затрат энергии.
Если к закрытой системе подвести теплоту Q, то эта энергия расходуется на увеличение внутренней энергии системы ^Е и на совершение системой работы против внешних сил окружающей среды:
Q = ∆Е + W
В изобарно-изотермических условиях, характерных для функционирования живых организмов, совершаемая работа W = p ∆V, тогда
Q = ∆Е + р∆V = (Е2 – Е1) + (рV2 – pV1) = (E2 + pV2) – (E1 + pV1)
Сумму внутренней энергии системы и произведения объема на давление называют энтальпией (н).
Н = Е + рV
Абсолютное значение Н (как и Е) для системы определить нельзя, в термодинамических расчетах используют обычно изменение энтальпии Н = Н2 – Н1 для какого либо процесса (аналогично Е).
Н и Е – это функции, характеризующие состояние системы, поэтому Н и Е не зависят от пути процесса, а зависят только от начального и конечного состояний системы.
При этом тепловой эффект изохорно-изотермического процесса (когда V и Т постоянны) равен изменению внутренней энергии, т.е. Qv = E, а изобарно-изотермического процесса (когда р и Т постоянны) тепловой эффект равен изменению энтальпии, т.е. Qp = H.
Единицы измерения Н и Е – это Дж, кДж, кал и ккал.
Для эндотермических процессов Н0, а для экзотермических процессов Н0.
Химические реакции протекают с выделением или поглощением энергии. Поглощение или выделение энергии связано с тем, что при протекании реакций одни связи разрываются (в исходных молекулах), на что необходимо затратить энергию. Другие связи образуются (в образующихся молекулах), при этом энергия выделяется.
Количество теплоты, которое выделяется или поглощается при проведении химической реакции в изобарно-изотермических условиях, характеризуется изменением энтальпии системы и называется изменением энтальпии реакции Нр. или тепловым эффектом реакции.
Реакции, протекающие с выделением энергии из системы в окружающую среду, называются экзотермическими. В результате таких процессов энтальпия системы уменьшается и для экзотермических процессов Нр.< 0.
Реакции, при протекании которых энергия поглощается системой из окружающей среды, называются эндотермическими. В результате таких процессов энтальпия системы уменьшается и для эндотермических процессов Нр.> 0.
Изменение энтальпии реакции (тепловой эффект реакции) приводится обычно для одного моля основного вещества и измеряется в Дж, кДж, килокалориях (ккал), причем 1 ккал = 4,184кДж.
Раздел химии, изучающий тепловые эффекты реакций, называется термохимией.
Тепловые эффекты реакций можно включать в уравнения реакций.
Химические уравнения, записанные с указанием энтальпии реакции (теплового эффекта), называются термохимическими.
Величина теплового эффекта записывается обычно в правой части уравнения со знаком плюс для экзотермической реакции и со знаком минус для эндотермической реакции, причем термохимические уравнения могут иметь дробные коэффициенты (1/2, 3/2 и др.). В термохимических уравнениях обычно указываются агрегатные состояния реагирующих веществ; если вещество в твердом состоянии существует в нескольких аллотропных модификациях, указывают модификации.
Например:
Н2(газ) + ½ О2(газ) = Н2О(газ) + 241,8кДж или
Н2(газ) + ½ О2(газ) = Н2О(газ) ; Нр = 241,8кДж
N2(газ) + O2(газ) = 2NO(газ) – 180,8кДж или
N2(газ) + O2(газ) = 2NO(газ); Нр = 180,8кДж .
Изменение энтальпии реакции можно определить как экспериментально, так и с помощью расчетов с использованием энтальпий образования веществ, участвующих в химической реакции, с использованием закона, установленного русским ученым Гессом в 1840 году:
Изменение энтальпии реакции, т.е. тепловой эффект реакции не зависит от пути ее протекания, а зависит только от начального и конечного состояния веществ, участвующих в реакции.
Закон Гесса выполняется только для изохорно-изотермических процессов (Т = const, V = const) и изобарно-изотермических процессов (Т= const, р = const ).
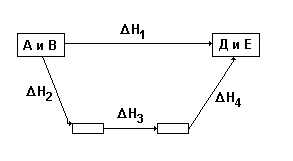
Закона Гесса можно пояснить с помощью следующего примера: из исходных веществ А и В можно получить конечные продукты Д и Е двумя путями: 1 путь – сразу по одной реакции из А и В получаются продукты Д и Е, причем тепловой эффект этой реакции равен Н1; 2 путь – вещества Д и Е получаются из А и В в несколько реакций, тепловые эффекты которых равны Н2, Н3 и Н4. Закон Гесса утверждает, что тепловые эффекты будут связаны таким соотношением:
Нр = Н2 + Н3 + Н4
Изменение энтальпии системы в результате химической реакции определяют обычно при стандартных условиях (количество вещества – 1 моль; давление – 760 мм рт. ст. – 101325 Па; температура –298 К, 25 С).
При расчетах изменения энтальпии (тепловых эффектов) химических реакций при стандартных условиях на основе закона Гесса используются стандартные энтальпии образования и энтальпии сгорания веществ.
Стандартная энтальпия образования сложного вещества - это изменение энтальпии реакции получения одного моля вещества из простых веществ при стандартных условиях, например:
Н2(г) + 1/2О2(г) = Н2О(г); Н298 обр. = - 241,8кДж/моль,
т.е. энтальпия образования газообразной воды при стандартных условиях равна - 241,8кДж на 1 моль воды. Для различных веществ числовые значения энтальпии образования при стандартных условиях приводятся в справочниках и обозначаются как Н298 обр.. Энтальпии образования простых веществ (О2, Н2, Cl2 и др.) равны нулю. Значение стандартной энтальпии образования сложного вещества зависит от природы вещества и его агрегатного состояния.
Стандартная энтальпия сгорания вещества – это изменение энтальпии реакции окисления в избытке кислорода одного моля вещества, взятого в стандартном состоянии при данной температуре до образования конечных продуктов окисления. Стандартные энтальпии сгорания обозначаются Н298 сгор., их числовые значения приводятся для различных веществ в справочниках.
В термохимических расчетах используются следствия из закона Гесса.
Так, если известны энтальпии образования веществ, участвующих в реакции, то из закона Гесса следует:
Изменение энтальпии реакции (т.е. тепловой эффект реакции) равно разности алгебраической суммы энтальпий образования продуктов реакции и алгебраической суммы энтальпий образований исходных веществ с учетом стехиометрических коэффициентов. (1-е следствие)
Например, для реакции аА + bВ dD + еЕ получаем:
Н298 реакции = (dН298 обр. (D) + eН298 обр. (E)) – (aН298 обр. (A) + bН298 обр. (B)).
Подставляя численные значения энтальпий образования продуктов реакции D и Е и исходных веществ А и В, найденные в справочнике, определяем тепловой эффект этой реакции (изменение энтальпии реакции) Н298 реакции (при стандартных условиях).
Тепловой эффект реакции можно определить и по энтальпиям сгорания веществ, а именно:
Изменение энтальпии реакции равно разности алгебраической суммы энтальпий сгорания исходных веществ и алгебраической суммы энтальпий сгорания продуктов реакции с учетом стехиометрических коэффициентов. (2-е следствие)
Например, для реакции аА + bВ dD + еЕ получаем:
Н298 р-ции = (аН298 сгор. (А) + вН298 сгор. (В)) – (dН298 сгор. (D) + еН298 сгор. (Е)).
Тепловой эффект химических реакций в лабораторных условиях определяют с помощью калориметра. В лабораторном практикуме по общей химии калориметрически определяют стандартную энтальпию (тепловой эффект) реакции нейтрализации.
Теплота реакции нейтрализации - это тепловой эффект реакции нейтрализации 1 моля эквивалента кислоты 1 молем эквивалента основания.
Если взять сильную кислоту HCl и сильное основание NaOH, то уравнение реакции нейтрализации имеет вид:
HCl + NaOH = NaCl + H2O + Qнейтр.
В ионной форме:
H + Cl- + Na + OH- Na + Cl- + H2O или
H + OH- H2O + 57,22кДж/мольэкв.
Таким образом, реакция нейтрализации сильной кислоты и сильного основания сводится к образованию H2O из ионов H и OH- и тепловой эффект этой реакции постоянный и равен 57,22кДж/мольэкв., а изменение энтальпии Н298 = - 57,22кДж/мольэкв.
Стандартная энтальпия реакции нейтрализации сильных кислот и сильных оснований является величиной постоянной, которая равна Н298 = - 57,22кДж/мольэкв. (или – 13,75ккал/мольэкв.).
При нейтрализации слабых кислот (Н2СО3, Н2S, HCN и др.) и слабых оснований (NH3 и др.) энтальпия нейтрализации меньше (по абсолютной величине), так как при этом затрачивается энергия на ионизацию кислоты или основания.
Главным источником энергии для живых организмов является химическая энергия, заключенная в продуктах питания. Окисление в организме человека основных составных частей пищи (белков, жиров, углеводов) сопровождается выделением энергии. В медицинской и санитарно-гигиенической практике энергетическую характеристику продуктов питания принято выражать в калориях (1 калория = 4,18 Дж), при этом калорийность пищи указывается в расчете на 1 грамм продукта, а не 1 моль (т.к. продукты представляют смесь питательных веществ сложного состава и строения).
Калорийностью питательных веществ называется энергия, которая выделяется при окислении (сгорании) 1 г питательных веществ.
Согласно закону Гесса, теплота, которая выделяется при окислении основных составных частей пищи, не зависит от того, как и где они окисляются, при условии, что продукты реакции остаются неизменными. Окисление жиров, углеводов и белков в организме происходит до тех же продуктов, что и при сгорании их в калориметре: С → СО2 Н → Н2 N →N2. конечным продуктом азотистого обмена является не свободный азот, а другие продукты (мочевина, мочевая кислота), но на практике принято расчеты вести, предполагая образование N2. В медицинской практике для энергетической характеристики большинства продуктов питания принята энтальпия реакции их сгорания. Так, при сгорании жиров выделяется 9 –9,5 ккал/г, углеводов – 4 – 4,1 ккал/г, белков - 4 – 4,1 ккал/г. Регуляция биоэнергетики организма возможна не только с помощью выбора отдельных продуктов, но и с использованием различного их сочетания.
Для взрослого человека необходимо в сутки: жиров – 60-70 г, белков – 80 – 100 г (при интенсивном физическом труде – 130 – 140 г), углеводов в 4 –5 раз больше, чем белков.
В основе научной диетологии лежит положение о соответствии калорийности пищевого рациона энергозатратам человека.
Суточная потребность человека в энергии составляет: при легкой работе в сидячем положении – 2000 – 2800 ккал, при умеренной мышечной работе – 3000- 3600 ккал, при интенсивном физическом труде – 4000 – 5000 ккал, при особо тяжелом труде – до 7000 ккал.
На основании знаний 1 закона термодинамики, закона Гесса и следствий из него, знаний о химическом составе продуктов питания и их энергетических характеристик, будущий врач должен уметь с учетом профессии человека и на основе энергетического баланса его жизнедеятельности составить оптимальный рацион питания.
