
- •Конспекты
- •Соединения с открытой цепью
- •I. Углеводороды
- •Номенклатура алканов
- •1.2. Способы получения
- •Химические свойства
- •Алкены (этиленовые углеводороды, олефины)
- •2.1. Строение, изомерия и номенклатура
- •Способы получения
- •Химические свойства
- •Гидратация.
- •3. Галогенирование.
- •4. Гидрогалогенирование.
- •Гипогалогенирование.
- •3. Алкадиены.
- •Методы получения
- •Химические свойства.
- •4. Алкины (ацетиленовые углеводороды).
- •4.1. Методы получения.
- •4.2. Химические свойства.
- •Моногалогенпроизводные алканов.
- •Предельные одноатомные спирты.
- •Многоатомные предельные спирты.
- •Непредельные одноатомные спирты.
- •Альдегиды и кетоны.
- •I. Предельные альдегиды и кетоны.
- •2. Ненасыщенные альдегиды и кетоны.
- •2.1. Оксосоединения с сопряженными двойными связями.
- •2.2. Кетены.
- •3. Диальдегиды и дикетоны.
- •1. Предельные одноосновные кислоты.
- •1.2. Методы получения.
- •1.2. Физические свойства.
- •1.3. Химические свойства.
- •1.3.2. Образование ацилгалогенидов.
- •1.3.3. Образование ангидридов.
- •1.3.4. Этерификация. Сложные эфиры.
- •2. Амины.
- •1.2. Глюкоза.
- •1.3. Другие моносахариды.
- •4.2. Структура целлюлозы.
2. Амины.
Если в аммиаке водородные атомы заместить на углеводородные остатки, то получаются амины. В зависимости от степени замещения водородов в аммиаке различают первичные (RNH2), вторичные (R2NH) и третичные (R3N) амины. При азоте может быть и четыре радикала (R4N+Cl ), такие замещенные амины называют четвертичными аммониевыми солями.
В случае аминов приняты названия по радикалам, с которыми связан азот. Систематическая номенклатура аминов исходит из того, что остаток аммиака в аминах в суффиксе называется амин, а в префиксе – амино. В случае вторичных и третичных аминов за основу названия принимается название углеводорода, соответствующего большему радикалу, а меньшие радикалы вместе с аминогруппой рассматриваются как замещающая группа. Приведем некоторые наиболее часто встречающиеся амины и их названия

2.1. Методы получения.
2.1.1. Алкилирование аммиака и аминов. Этот метод получения аминов уже рассматривался как пример SN- реакции галогенпроизводных алканов (реакция Гофмана, 1849 г.). Взаимодействие галогеналканов с аммиаком приводит к смеси всевозможных аминов и тетраалкиламмонийгалогенида. Это происходит потому что каждая последующая реакция алкилирования образовавшегося в предыдущей стадии амина идет легче, чем предыдущая. Все сказанное проиллюстрируем на примере реакции иодистого метила с аммиаком
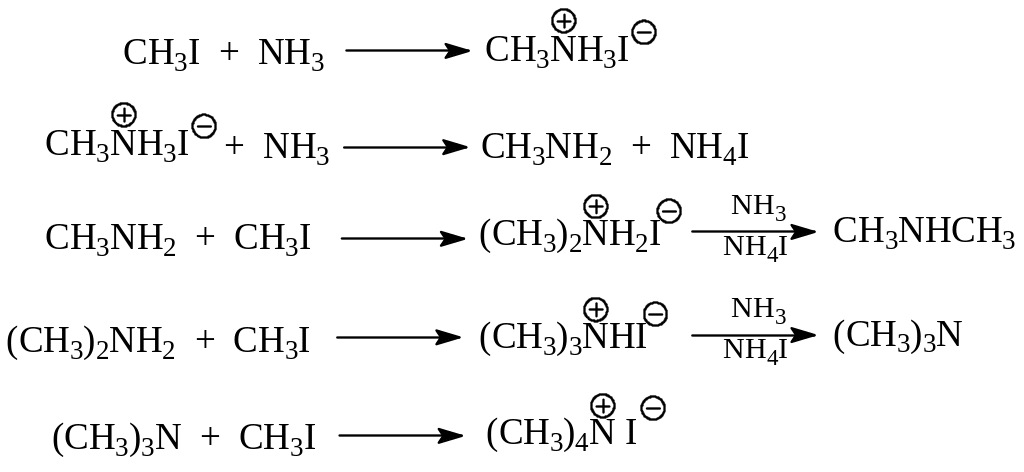
Недостатки метода получения аминов через реакцию Гофмана очевидны – это образование смеси аминов. Однако этот метод базируется на доступных исходных продуктах, а смесь аминов благодаря существенному различию в температурах кипения может быть успешно разделена.
2.1.2. Расщепление амидов карбоновых кислот по Гофману (1882 г.). Расщепление амидов по Гофману рассматривалось раньше как характерная реакция незамещенных по азоту амидов с гипобромитом или гипохлоритом натрия, ведущая к первичным аминам
![]()
2.1.3. Восстановление азотсодержащих соединений. Восстановление азотсодержащих соединений различных групп: нитросоединений, нитрилов, оксимов, амидов, иминов (Шиффовых оснований, азометинов) с использованием разных восстановителей представляет собой универсальный метод синтеза аминов. При этом используются химические восстановители: диборан, литийалюминийгидрид, амальгама натрия и уксусная кислота, натрий и спирт, цианборгидрид натрия и др. Применение любого из указанных восстановителей имеет свои особенности. Например, литийалюминийгидрид в эфирном растворе восстанавливает все указанные выше типы азотсодержащих соединений, диборан восстанавливает только нитрильную группу, но не реагирует с нитро- и сложноэфирной группами. При каталитическом восстановлении азотсодержащих соединений чаще всего используются никель на кизельгуре и никель Ренея, хромит меди при высоких температурах (2500, 300 атм).
Нитросоединения при восстановлении дают первичные амины. Этот метод получения аминов в основном применяется для синтеза ароматических аминов. Это, скорее всего, связано с тем, что для синтеза алифатических аминов предложено множество других методов, в то время как восстановление ароматических нитросоединений - практически единственный способ получения ароматических аминов.
При каталитическом восстановлении нитрометана получается метиламин
![]()
Эта реакция сильно экзотермична. При восстановлении 1 моля нитрометана выделяется столько тепла, что ее достаточно для нагрева стальной бомбы в 10 кг до 1000.
Нитрилы карбоновых кислот при восстановлении также превращаются в первичные амины. Нитрил масляной кислоты при взаимодействии с литийалюминийгидридом дает бутил амин, капронитрил натрием в спирте восстанавливается в гексиламин
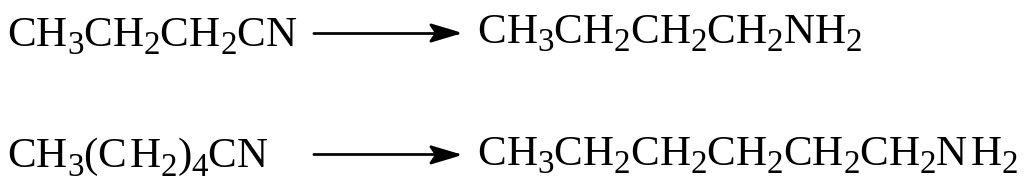
Практическое применение нашло восстановление динитрила адипиновой кислоты в гексаметилендиамин
![]()
Исходный динитрил обычно получают из адипиновой кислоты. Стадия восстановления динитрила осуществляется каталитически на никеле Ренея при 200 атм или же с использованием других катализаторов. Гексаметилендиамин используется при получении одного из полиамидов – найлона конденсацией адипиновой кислоты с диамином.
Оксимы, обычно получаемые реакцией гидроксиламина с карбонильными соединениями, легко восстанавливаются любым из упомянутых выше восстановителей до первичных аминов. Радикал, связанный с аминогруппой, может быть первичным или вторичным
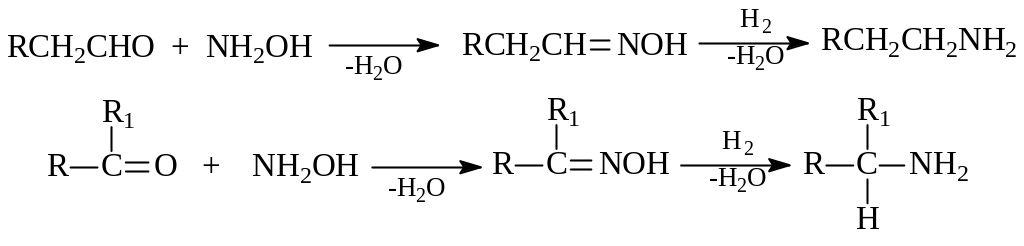
Амиды карбоновых кислот, по сравнению с другими азотсодержащими соединениями, проявляют наименьшую реакционную способность по отношению к химическим восстановителям. Их можно восстановить только литийалюминийгидридом в эфирном растворе. Восстановление можно вести и каталитически, например, используя хромит меди при 2500 300 атм.
Несмотря на трудности, которые возникают из-за относительно низкой реакционной способности амидов, восстановление их часто используется в препаративной практике. Это связано с тем, что восстановлением амидов можно получить все три типа аминов

Имины восстанавливаются в первичные или во вторичные амины, в которых аминогруппа связана с первичным или вторичным углеводородным остатком. При осуществлении этой реакции обычно исходят не из готовых азометинов, а получают их по ходу реакции взаимодействием альдегидов и кетонов с аммиаком или амином. В таком варианте реакция носит название восстановительного аминирования. Восстановление при этом осуществляют каталитически или с помощью цианборгидрида натрия.
![]()
Приведем несколько примеров получения аминов восстановительным аминированием альдегидов и кетонов
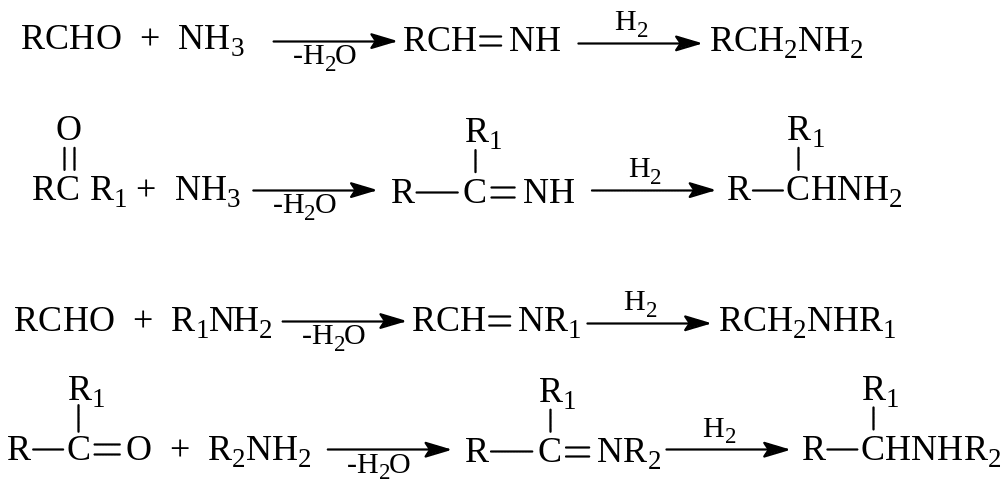
2.1.4. Синтез Риттера. Взаимодействие алкенов или спиртов с цианистым водородом или нитрилами карбоновых кислот в присутствии концентрированной серной кислоты носит название реакции Риттера. В результате этой реакции получаются первичные амины. Возможно, реакция Риттера – лучший способ получения первичных аминов с третичным углеводородным радикалом.
Предполагается, что вначале алкен или спирт образуют карбокатион

Присоединение карбокатиона к нитрилу за счет неподеленной пары электронов азота и последующая гидратация промежуточной частицы приводят к амиду. В результате гидролиза амида получается амин
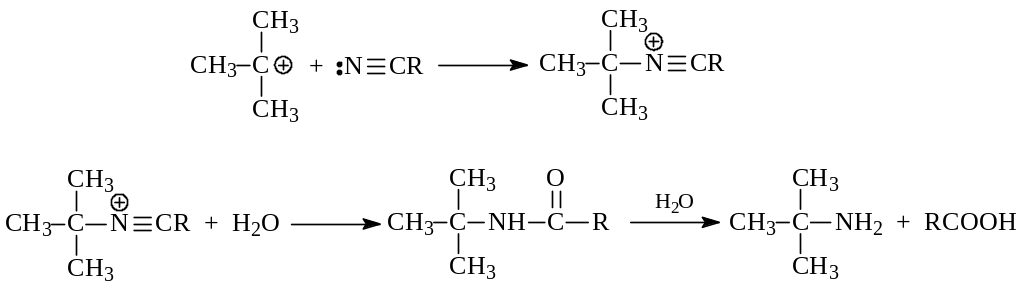
2.2. Химические свойства.
Поведение аминов в химических реакциях всецело определяется аминогруппой. Атом азота аминогруппы несет неподеленную пару электронов, которую он стремиться обобщить. Этим обусловлена основность аминов и их способность выступать в роли нуклеофильных реагентов.
2.2.1. Кислотно-основные свойства. Подобно аммиаку, амины являются основаниями. По этой причине они взаимодействуют с кислотами с образованием солей
![]()
Мерой основности служит константа основности Кb, выражающая способность амина отщеплять протон от воды
![]()
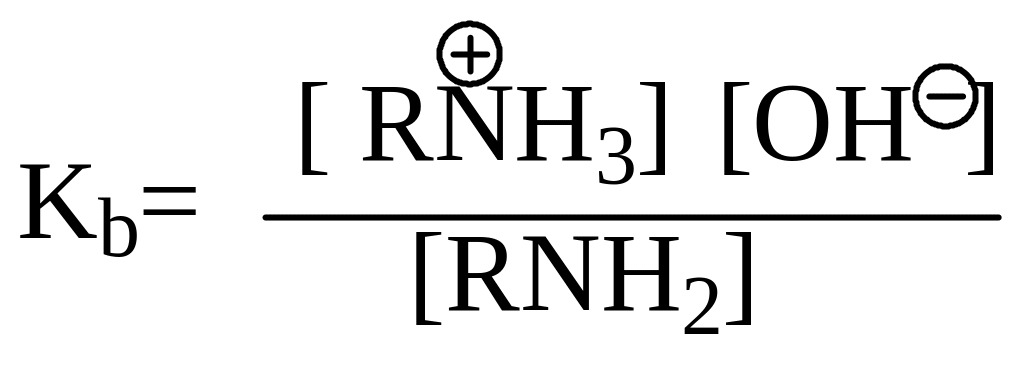
Какова же основность аминов различных групп? Приведем значения Кb для аммиака, первичного, вторичного и третичного амина
NH3 CH3CH2NH2 (CH3CH2)2NH (CH3CH2)3N
1,8.10-5 5,1.10-4 10,0.10-4 5,6.10-4
Основность азотсодержащих соединений обусловлена наличием неподеленной пары электронов у атома азота. И в случае аминов эти электроны позволяют принять протон или другую электрофильную частицу и выступить, таким образом, в качестве основания. После образования связи между азотом и электрофилом азот получает положительный заряд. В образовавшемся соединении этот заряд скомпенсирован противоионом.
Степень основности аминов зависит от электронной плотности у азота и от доступности неподеленной пары электронов азота для кислой частицы. Электронодонорные заместители, в частности алкильные радикалы, подают электроны азоту и повышают электронную плотность на этом атоме. По этой причине амины являются более сильными основаниями, чем аммиак. Из приведенных выше сведений об основности аминов разных типов видно, что основность третичных аминов ниже ожидаемых значений. Трудно объяснить это обстоятельство пространственными затруднениями подходу протона к азоту с учетом размеров этой частицы. Поэтому предполагается, что алкильные заместители у азота в случае третичных аминов затрудняют не электрофильную атаку протоном, а сольватацию и стабилизацию образовавшейся положительной частицы молекулами растворителя.
Первичные и вторичные амины, имеющие водородные атомы у азота, проявляют и кислотные свойства. Однако эти свойства можно обнаружить лишь при взаимодействии аминов с сильными основаниями. В следующей реакции

переход протона от амина к основанию В возможен только в том случае, если основность этого основания выше, чем основность амид – аниона.
Примерами реакций, в которых первичные и вторичные амины выступают как кислоты, являются реакции с металлическими натрием или калием

Литиевые соли легко могут быть получены также реакцией амина с фениллитием в эфирном растворе
![]()
Амины относятся к очень слабым кислотам, константа кислотности Ка которых находится на уровне 10-33.
2.2.2. Алкилирование аминов. Эта реакция (реакция Гофмана) уже рассматривалась (см. раздел 2.1.1). В дополнение к известным сведениям следует отметить, что реакция Гофмана позволяет получить вторичные и третичные амины с различными радикалами у азота. В качестве примера приведем алкилирование этиламина метилиодидом и алкилирование метилэтиламина бромистым пропилом
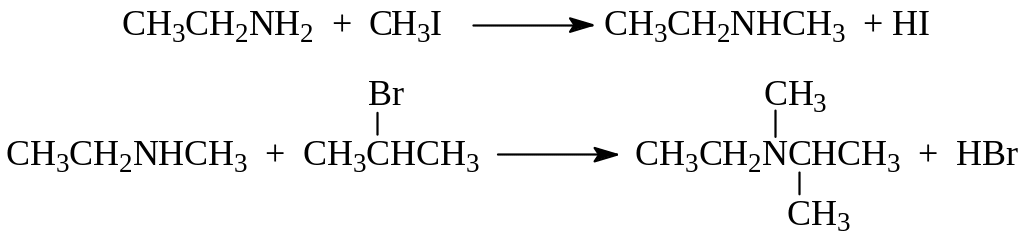
2.2.3. Ацилирование. Первичные и вторичные амины способны замещать свои водородные атомы на остаток карбоновой кислоты. Происходит это при взаимодействии амина с карбоновой кислотой, а еще лучше с ее ангидридом или галогенангидридом при комнатной температуре
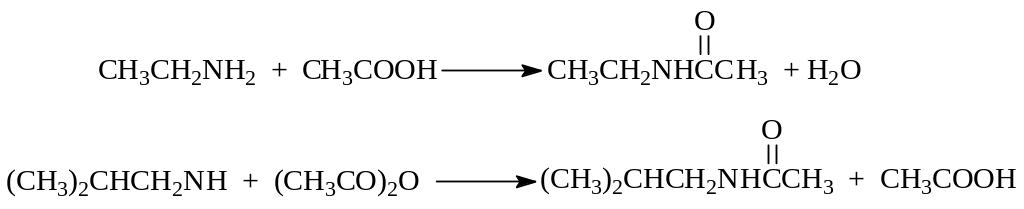
При ацилировании галогенангидридами кислот моль амина связывается выделившейся в ходе реакции галогенводородной кислотой. Чтобы избежать этого ацилирование галогенангидридами обычно проводят в присутствии щелочи
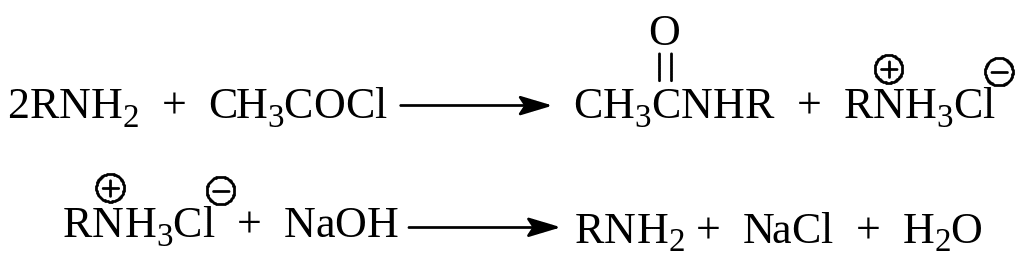
Как видно из приведенных реакций, при ацилировании аминов получаются замещенные амиды карбоновых кислот, не обладающие основным характером и способные гидролизоваться до амина и карбоновой кислоты

Следует отметить, что в первичные амины можно ввести и два кислотных остатка, хотя это достигается с большим трудом.
По возможному механизму ацилирование аминов сводится к нуклеофильному присоединению к карбонильной группе за счет неподеленной пары электронов азота с последующим отрывом протона и элиминированием галогена
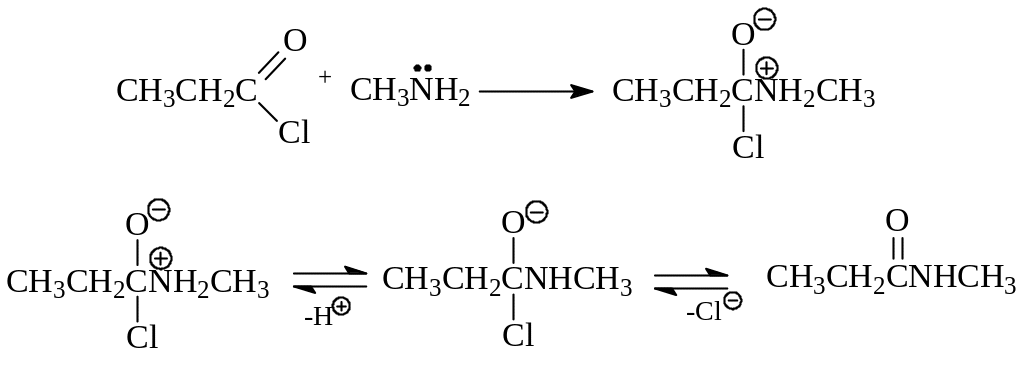
По аналогичному механизму «присоединения – элиминирования» протекает и реакции с участием кислоты, ее ангидрида и даже сложного эфира.
2.2.4. Отношение к азотистой кислоте. Амины различных типов резко отличаются по своему отношению к азотистой кислоте.
Первичные амины реагируют с азотистой кислотой, которая обычно получается в ходе реакции из нитрита натрия и НCl, с образованием неустойчивых солей диазония. Соль диазония распадается дальше до карбокатиона, который в условиях реакции сразу или перегруппировавшись в другой, более стабильный ион, превращается в спирты и алкены
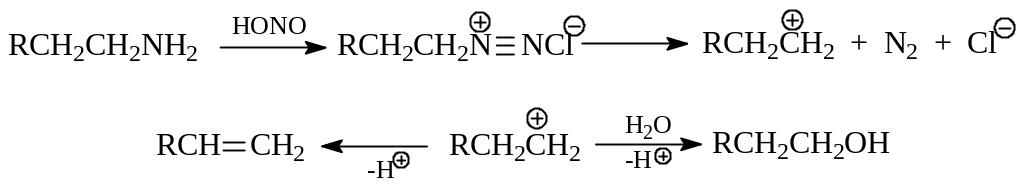
Вторичные амины азотистой кислотой нитрозируются в нитрозамины, представляющие собой нейтральные масла желто – оранжевого цвета
![]()
Нитрозамины, полученные из вторичных аминов, могут представить опасность для здоровья. Известно, что N - нитрозодиметиламин и N - нитрозодиэтиламин обладают канцерогенной активностью и вызывают рак.
Третичные амины с азотистой кислотой не реагируют.
2.2.5. Образование иминов. При взаимодействии с альдегидами и кетонами первичные амины образуют имины (азометины, основания Шиффа)
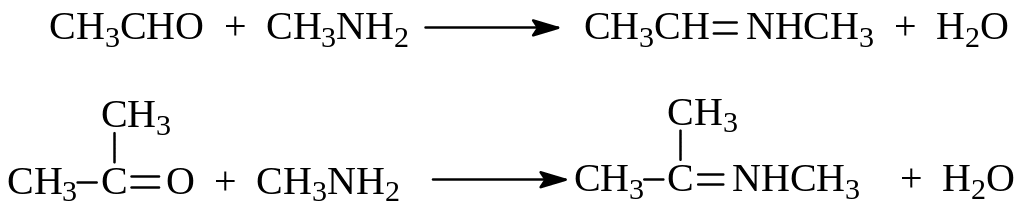
Реакция образования иминов вполне укладывается в рамки уже рассмотренного механизма нуклеофильного присоединения по карбонильной группе с последующей стадией элиминирования. Неподеленная пара электронов на атоме азота позволяет аминам выступать в качестве нуклеофильного реагента
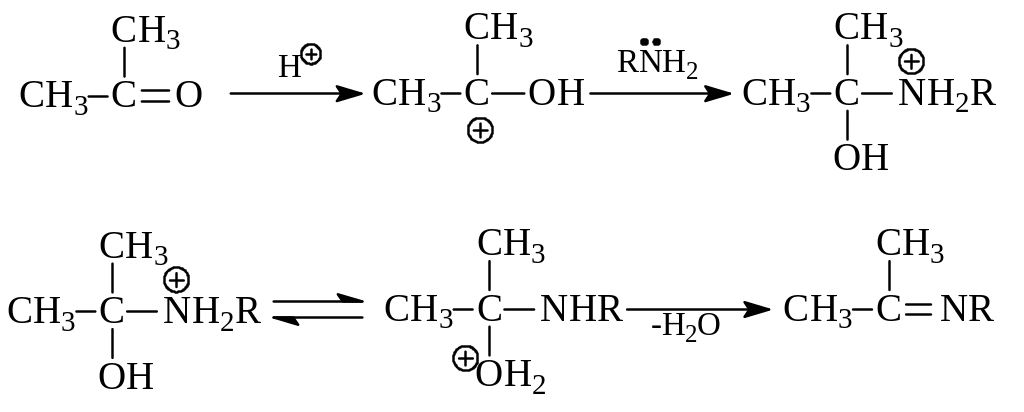
2.2.6. Образование четвертичных аммониевых оснований. При алкилировании аминов по Гофману происходит постепенное введение в молекулу углеводородных остатков, процесс завершается образованием солей четвертичного аммония
![]()
Отметим попутно, что если алкилирование сводится к метилированию с использованием иодистого метила, то весь процесс называют исчерпывающим метилированием аминов. По числу введенных в молекулу амина метильных радикалов можно судить о строении амина.
При взаимодействии галогенида четвертичного аммония с влажной окисью серебра образуется гидроокись четвертичного аммония и осаждается осадок галогенида серебра.
![]()
Водные растворы гидроокисей по основности, обусловленной гидроксил – ионами, приближаются к основности едких щелочей.
Гидроокиси четвертичного аммония при нагревании до 1250 и выше распадаются с образованием третичного амина, алкена и воды
![]()
Эта реакция носит название элиминирования по Гофману. Предполагается, что она по механизму аналогична дегидрогалогенированию по механизму Е2
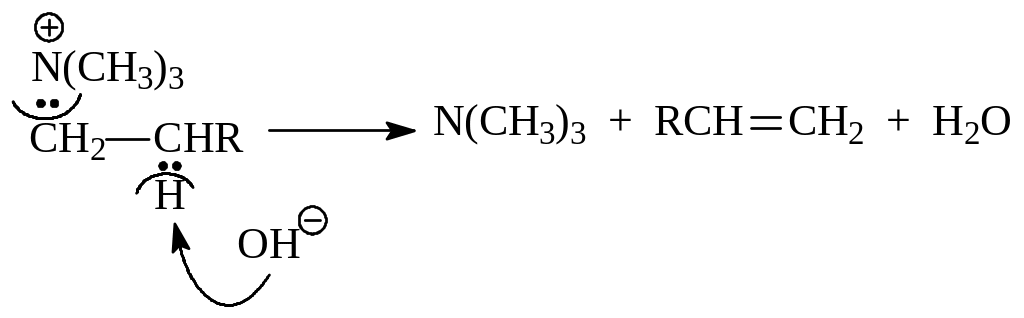
Элиминирование по Гофману используется при установлении строения аминов.
2.2.7. Окисление аминов. Амины всех трех типов окисляются довольно легко. Однако при окислении первичных и вторичных аминов образуется сложная смесь продуктов и поэтому определенное значение имеет лишь окисление третичных аминов, приводящее к их оксидам
![]()
В оксидах третичных аминов связь между атомами азота и кислорода – донорно-акцепторная (семиполярная).
Оксиды аминов определенного строения, содержащие β - водородный атом, при нагревании около 1500 распадаются на алкен и производное гидроксиламина
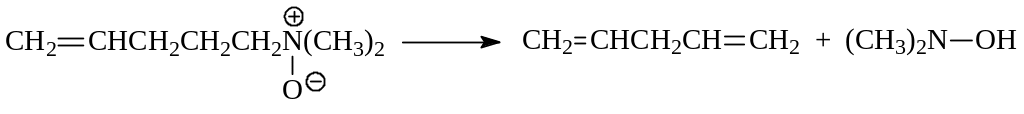
Эта реакция носит название элиминирования по Коупу и используется для синтеза алкенов с определенным положением двойной связи.
Углеводы.
Углеводы относятся к числу важнейших классов природных органических соединений, без которых невозможно представить себе жизнь на земле. Здесь речь идет не об использовании углеводов в качестве строительных и конструкционных материалов (древесина), не об изготовлении из них одежды (хлопок, лен, вискозный и ацетатный шелк) и не о бумаге, играющей выдающуюся роль в развитии цивилизации. Некоторые углеводы составляют основу питания живых организмов и просто «вплетены» в процессы жизнедеятельности. Это хорошо видно по той роли, которую играет один из углеводов – глюкоза – в этих процессах.
Глюкоза образуется в зеленых листьях растений в результате процесса под названием фотосинтез. В этом процессе происходит химическое связывание углекислого газа и воды за счет использования энергии солнечных лучей под воздействием катализатора – хлорофилла
![]()
Несмотря на более чем столетний период изучения фотосинтеза он в химических лабораториях и в промышленности еще не воспроизведен.
Образовавшиеся при фотосинтезе молекулы глюкозы объединяются между собой двумя различными способами с образованием целлюлозы – универсального строительного материала в зеленом мире или же крахмала, являющегося питательным веществом и запасаемого для молодого поколения растений. Однако крахмалом питаются и живые организмы, в желудке которых он гидролизуется и снова образует глюкозу. Током крови глюкоза разносится по всему организму, доставляется к каждой клетке. Проникнув с помощью инсулина в клетку, глюкоза здесь окисляется до углекислоты и воды. При этом выделяется энергия, запасенная при фотосинтезе в глюкозе.
Имеются и другие направления использования глюкозы организмом. Она частично превращается в гликоген и запасается в печени, используется организмом для синтеза жиров и аминокислот.
Свое название углеводы (уголь + вода) получили из-за того, что их состав формально может быть выражен формулой (С.Н2О)n.
В химическом отношении углеводы представляют собой полиоксиальдегиды (альдозы) и полиоксикетоны (кетозы) или более сложные соединения, превращающиеся в них при гидролизе. Один углевод отличается от другого и числом углеродных атомов. По этому признаку различают треозы, тетрозы, пентозы, гексозы и др.
Основанием для отнесения углевода к моно-, ди- или полисахаридам служит их отношение к гидролизу. К моносахаридам относят углеводы, которые неспособны гидролизоваться в более простой углевод. Если при гидролизе углевода образуется два моносахарида, то его относят к дисахаридам. Наконец, углевод, при гидролизе которого образуется много молекул моносахарида, называют полисахаридом.
1. Моносахариды.
Как уже было указано, углеводы в своей молекуле содержат карбонильную группу и несколько гидроксильных групп. Поэтому они во многих реакциях ведут себя как спирты и альдегиды и кетоны. Однако углеводы не просто повторяют свойства спиртов и карбонильных соединений. Даже ожидаемые и известные реакции с участием углеводов протекают своеобразно и часто приводят к неожиданным продуктам.
1.1. Восстановление. Моносахариды имеют в своей молекуле две способные восстанавливаться функциональные группы: карбонил и гидроксил. Поскольку карбонильная группа восстанавливается до гидроксильной, то в результате восстановления альдоз и кетоз получаются многоатомные спирты – глициты, содержащие на один гидроксил больше, чем в исходном моносахариде. При восстановлении глюкозы, в молекуле которого имеется пять гидроксилов, получается шестиатомный спирт, носящий название глюцита или сорбита. В качестве восстановителей могут быть использованы молекулярный водород в присутствии обычных катализаторов гидрирования (Ni, Pd, Pt), хромит меди, литийалюминийгидрид и боргидрид натрия, амальгама натрия.
В отличие от альдоз, которые при восстановлении дают лишь один продукт, кетозы образуют два спирта. Это вызвано тем, что при восстановлении кетоз возникает новый асиметрический центр и получается два энантиомера

При взаимодействии с иодистоводородной кислотой восстанавливается не только карбонил, но и гидроксильные группы. Например, при нагревании с НI из глюкозы образуется 2-иодгексан. Отсюда становится понятным, что шесть углеродных атомов, входящих в молекулу глюкозы, построены линейно, без ответвлений от главной цепи.
Многоатомные спирты, получаемые восстановлением моносахаридов, используются на практике. В качестве примера укажем, что упомянутый выше сорбит применяется как заменитель сахара в пище больных диабетом и при синтезе витамина С.
1.2. Окисление. Окисление углеводов с использованием различных окислителей сыграло исключительно важную роль при установлении их строения.
В моносахаридах имеется несколько способных окисляться функциональных групп: альдегидная группа, первичный и вторичный гидроксилы, кетогруппа.
Наиболее легко окислению подвергается альдегидная группа в альдозах. При этом моносахариды превращаются в одноосновные кислоты, которые в данном случае называют гликоновыми. Для избирательного окисления альдегидной группы можно использовать даже такие слабые окислители как бромная вода
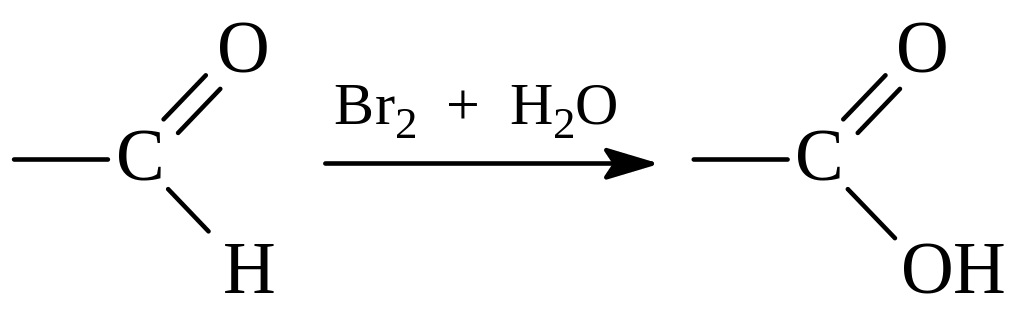
Для той же цели применяются реактивы Толленса, Фелинга и Бенедикта. При использовании реактива Толленса, представляющего собой аммиачный раствор окиси серебра, альдоза окисляется в гликоновую кислоту, а катион одновалентного серебра одновременно восстанавливается до металлического серебра (реакция серебряного зеркала)

При окислении углевода реактивом Фелинга или Бенедикта (соль двухвалентной меди, стабилизированный винной кислотой или лимонной кислотой) также получается карбоновая кислота и выпадает в осадок оксид одновалентной меди.
Таким образом, при окислении некоторых углеводов вышеуказанными окислителями образуются одноосновные кислоты и одновременно идет процесс восстановления до металлического серебра и оксида меди. Углеводы, обладающие восстановительными свойствами, называются восстанавливающими. Углеводы, лишенные этих свойств, называются невосстанавливающими.
Казалось бы, что к восстанавливающим могут быть отнесены только альдозы с учетом легкости их окисления по сравнению с кетозами. Однако это не так, кетозы также относятся к числу восстанавливающих сахаров. Оказалось, что окисляется не кетогруппа, а находящиеся с кетозой в равновесии энатиомерные альдозы
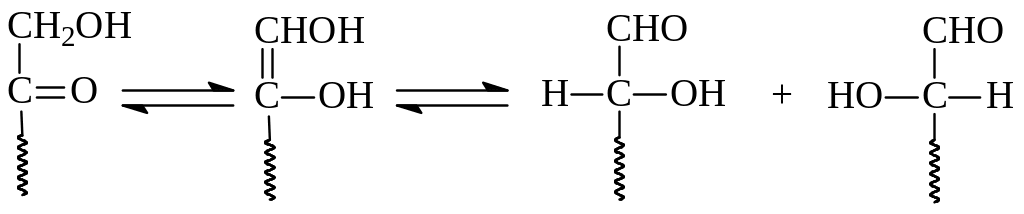
Отметим, что хотя альдегиды окисляются легче, чем первичные спирты, в случае альдоз удалось проводить окисление первичного гидроксила, сохранив при этом альдегидную группу. Такие кислоты, содержащие в своей молекуле кроме карбоксила еще гидроксилы и альдегидную группу, называются уроновыми кислотами. Для получения уроновой кислоты в альдозе приходится защитить альдегидную группу и только потом проводить окисление.
Для окисления углеводов применяется и азотная кислота различной концентрации. В этом случае окисляется и альдегидная, и первичная гидроксильная группы с образованием дикарбоновых кислот, которые называются гликаровыми (сахарными)
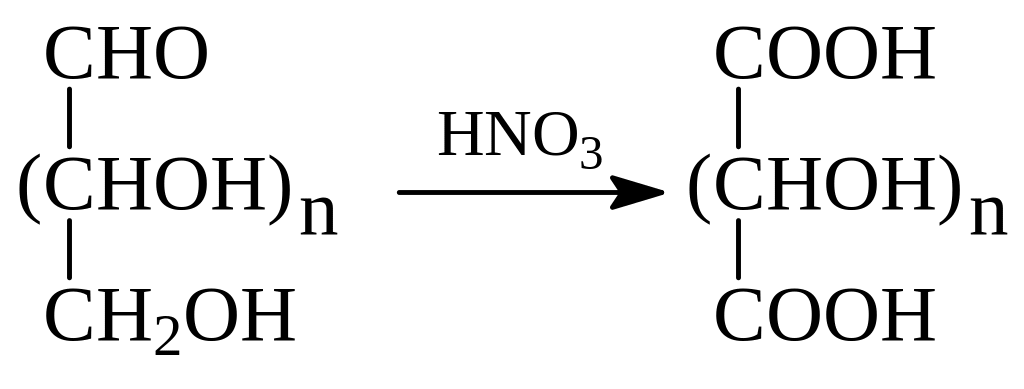
При окислении моносахаридов с использованием концентрированной азотной кислоты окисляется, кроме альдегидной и первичной гидроксильной группы, и вторичный гидроксил до кетона При специально подобранных условиях может быть окислен и кетон, который протекает, как известно, с разрывом углерод-углеродных связей между карбонилом и остальной частью молекулы

Такой вариант окисления часто используется при определении размера кольца в циклических моносахаридах.
Наконец, углеводы можно подвергнуть окислительному расщеплению иодной кислотой (Малапраде, 1928 г). Периодат – ион IO4- окисляет с
одновременным расщеплением С-С- связи виц-диолы и α-оксикарбонильные соединения. При этом получаются карбоновые кислоты и карбонильные соединения (в случае углеводов -α-оксикарбонильные соединения) Вот несколько примеров, поясняющих сказанное
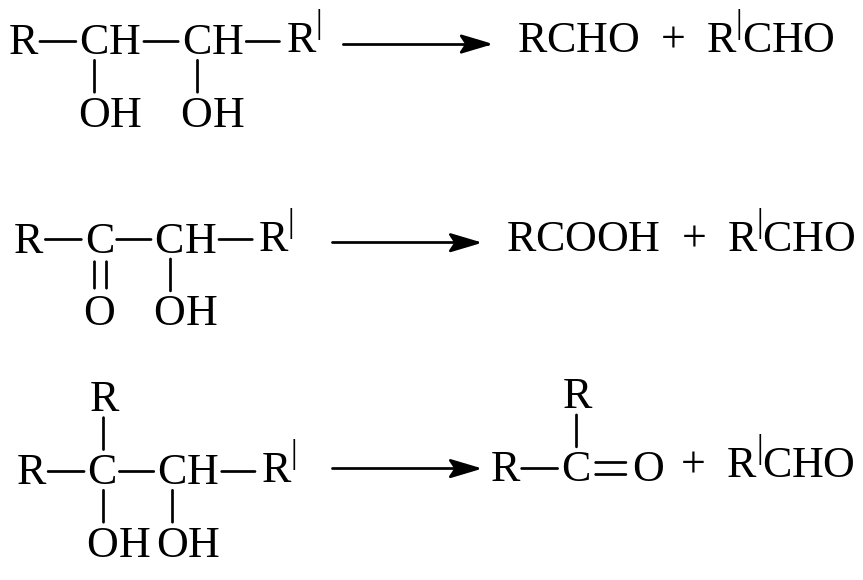
Состав продуктов окислительной фрагментации и количество израсходованной иодной кислоты дают богатую информацию относительно строения углевода. Так, на окисление глюкозы расходуется 5 молей иодной кислоты и образуется 5молей муравьиной кислоты и 1 моль формальдегида
![]()
1.1.3. Алкилирование. Подобно спиртам, моносахариды могут быть проалкилированы за счет водородов гидроксильной группы. В рассматриваемом случае в качестве метилирующих средств чаще всего используются метилиодид (в присутствии Ag2O) или диметилсульфат (в присутствии щелочи)

При промышленном получении простых эфиров углеводов обычно используют алкилхлориды в щелочной среде.
1.1.4. Этерификация. Сложные эфиры углеводов широко используются на практике. Их получают этерификацией углеводов как полиолов минеральными и карбоновыми кислотами, ангидридами и галогенангидридами последних. В качестве катализаторов этерификации используются кислоты, в том числе кислоты Льюиса, и основания (ацетат натрия, пиридин).
При этерификации моносахаридов по расходованию ацилирующего агента возможно установить число гидроксильных групп в молекуле. Например, при ацетилировании глюкозы уксусным ангидридом получается пентаацетат глюкозы
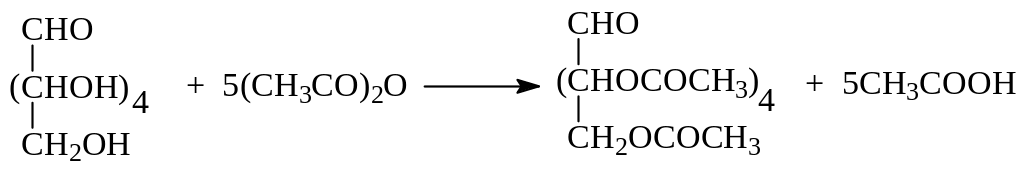
Отсюда следует, что глюкоза содержит пять гидроксильных групп.
Как и любые сложные эфиры, ацетаты углеводов гидролизуются как в кислой, так и щелочной среде с регенерацией гидроксильных групп. Для этой же цели можно воспользоваться и реакцией переэтерификации. Приведенные здесь сведения в последующем, после изучения строения углеводов, будут дополнены новыми фактами.
1.1.5. Образование озазонов. Имея в своей молекуле карбонильную группу, моносахариды вступают в реакцию со многими, но не всеми, производными аммиака и дают соответствующие производные. Одной из таких реакций является образование озазона при взаимодействии углевода с фенилгидазином (Э.Фишер, 1928 г)
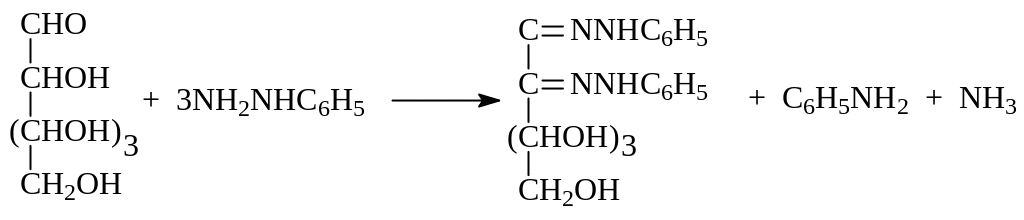
Удивительным в этой реакции является то, что в реакцию вступает не только альдегидная группа в альдозах, но и соседний с ним углерод, несущий гидроксил. Объяснение этому заключается в следующем. Вначале при взаимодействии альдегидной группы альдозы с фенилгидразином образуется ожидаемый фенилгидразон, который находится в равновесии с с енгидразинной и кетогидразинной таутомерными формами

Кетогидразинная форма уже сама может реагировать как кетон с еще одной молекулой фенилгидразина. При этом получается гидразиногидразон, который с участием третьей молекулы фенилгидразина как основания претерпевает - элиминирование в - иминогидразон. Реакция последнего с еще одной молекулой фенилгидразина по иминогруппе приводит к озазону

Установлено, что несколько моносахаридов могут дать один и тот же озазон. Происходит это, потому что при образовании озазона исчезает асимметрический цент, обуславливавший существование энантиомеров
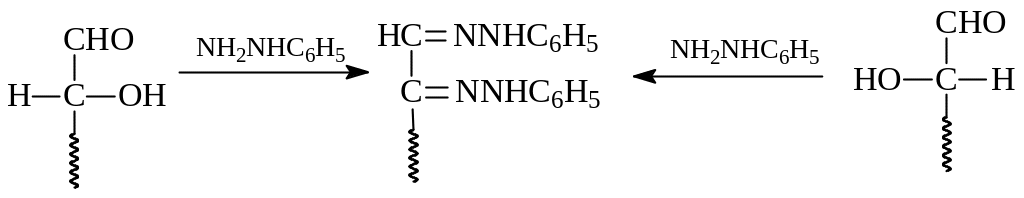
В приведенных реакциях альдозы отличались конфигурацией при втором углеродном атоме, если первый углерод в составе карбонильной группы обозначить цифрой один. Такие альдозы называются эпимерами.
Один и тот же озазон дают не только эпимеры, но и близкие им по строению кетозы
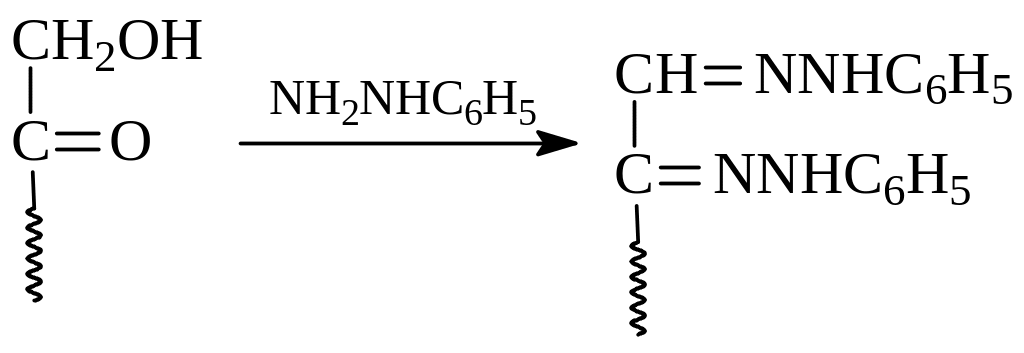
Озазоны легко гидролизуются в кислой среде с образованием озонов, относящихся к α-дикарбонильным соединениям
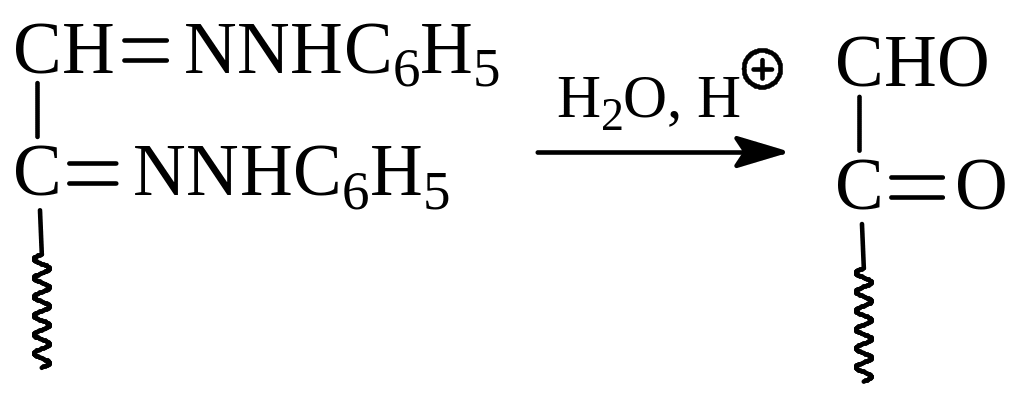
Поскольку альдегидная и кето- группа заметно отличаются по реакционной способности при восстановлении, например, цинком и кислотой, то появляется возможность из озона перейти к кетозам. Таким образом, последовательность реакций, включающей получение озазона, его гидролиз и восстановление, позволяет из эпимерных альдоз получить кетозу.
1.1.6. Увеличение длины углеродной цепи альдоз. Соединения, в молекуле которых имеется альдегидная функция, способны присоединять синильную кислоту по механизму нуклеофильного присоединения и образовать циангидрины
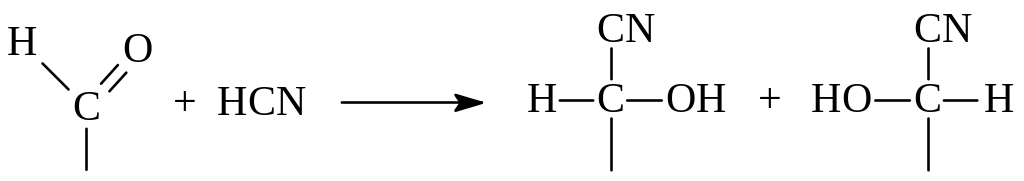
Как видно из рассмотрения молекулы циангидрина, карбонильный углерод в продукте реакции становится асимметрическим. Поэтому в результате реакции получается не один, а два циангидрина, различающиеся конфигурацией при этом углероде – энантиомеры. При гидролизе циангидрина, представляющего собой нитрил оксикарбоновой кислоты, получается сама кислота. Применительно к моносахаридам все это было показано Килиани (1886 г). Вскоре Э.Фишер (1890 г.) установил, что карбоновые кислоты (в виде лактона) могут быть восстановлены амальгамой натрия в альдозы. Таким образом, по методу Килиани – Фишера одна альдоза может быть превращена в смесь двух других альдоз, содержащих на один углерод больше и являющихся эпимерами. В качестве примера рассмотрим превращение альдопентозы в эпимерные альдогексозы
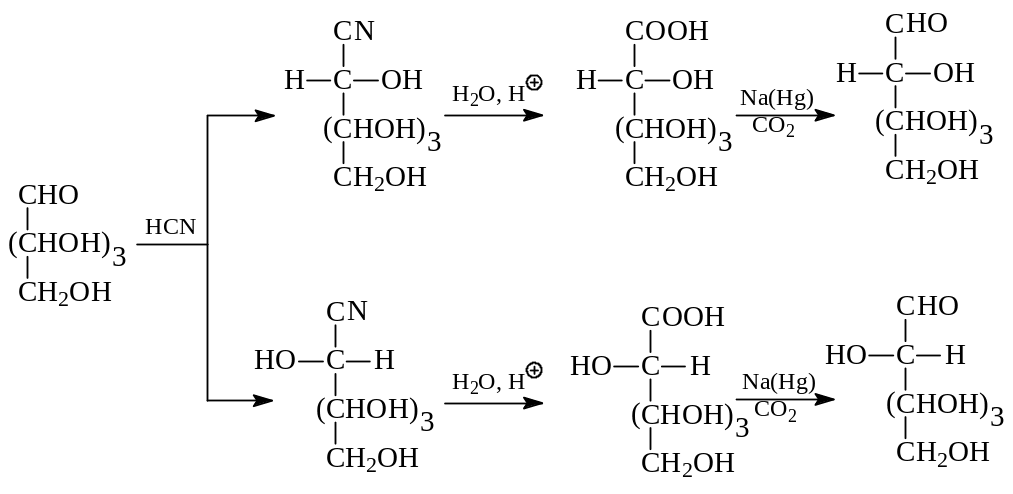
1.1.7. Уменьшение длины углеродной цепи альдоз. Имеется несколько схем превращения альдоз с большим числом углеродных атомов в альдозы с меньшей длиной углеродной цепи. При деградации альдоз по Руффу вначале их окисляют бромной водой до глюконовых кислот, затем кальциевые соли этих кислот окисляют перекисью водорода в присутствии трехвалентного железа (реактив Фентона) в альдозу, содержащую на один атом углерода меньше. Прежний карбонильный углерод моносахарида покидает молекулу соли кислоты при свободнорадикальном декарбоксилировании в виде карбонат - иона. К сожалению, выходы при деградации по Руффу составляют лишь 30 – 40%. Для примера приведем получение альдопентозы из альдогексозы по Руффу
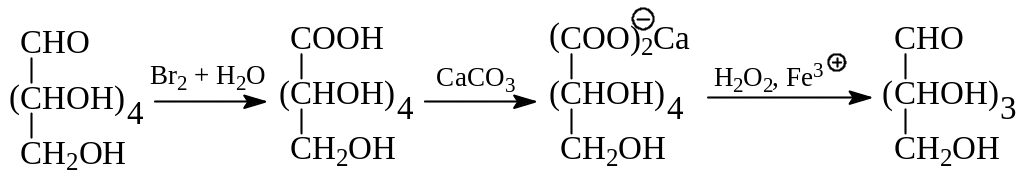
Для укорачивания длины углеродной цепи альдозы используется и другая схема (метод Воля). По этому методу вначале из альдозы получают оксим, который при дегидратации под действием уксусного ангидрида превращается в нитрил. При этом происходит также этерификация с участием всех свободных гидроксильных групп. В дальнейшем их регенерируют переэтерификацией сложного эфира метанолом. Из нитрила нагреванием с щелочью удаляется цианистый водород, который связывается обычно ионами серебра. Пример осуществления этой схемы, связанный с превращением альдогексозы в альдопентозу, дается ниже
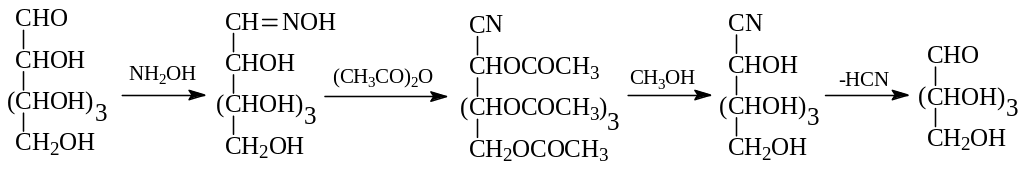
При деградации углеводов как по Руффу, так и по Волю, эпимерные альдозы дают одну и ту же альдозу с меньшим числом углеродных атомов. Это происходит потому, что рассматриваемое превращение сопровождается исчезновением асимметрического углерода, обуславливавшего существование эпимеров.
1.1.8. Превращение альдозы в ее эпимер. Под действием щелочей моносахариды вступают в так называемую реакцию эпимеризации. При этом происходит превращение одного эпимера в другой и устанавливается равновесие между ними. В этом равновесии участвует также кетоза, изомерная эпимерным альдозам. Причина эпимеризации – образование из альдозы под действием щелочи ендиола, который дальше может превращаться в любой из эпимеров и изомерную кетозу
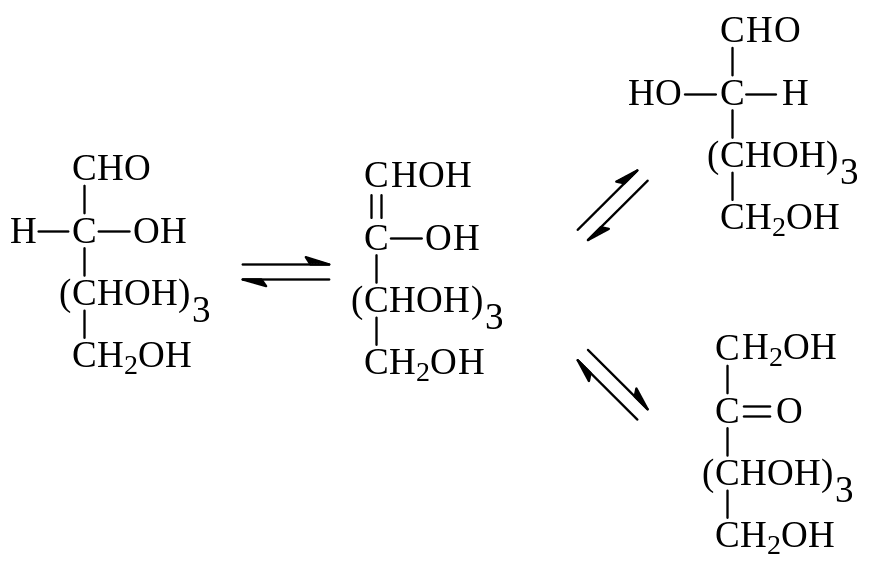
При разделении смеси двух альдоз и кетозы, находящихся в равновесии, можно было бы получить каждый из них в отдельности. Однако сделать это нелегко. Поэтому при необходимости получения одного эпимера из другого поступают по другому. Исходную альдозу окисляют бромной водой до глюконовой кислоты, которую обрабатывают основанием (пиридином). При этом образуется равновесная смесь эпимерных кислот, которую можно разделить и каждую из кислот по отдельности восстановить (в виде лактона) по методу Фишера до соответствующей альдозы
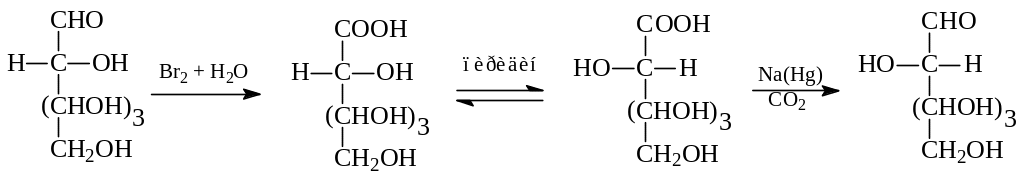
Химия углеводов не исчерпывается рассмотренными выше реакциями. В дальнейшем они будут дополнены новой информацией.
